不同气候条件下南海西沙海域鸢乌贼(Sthenoteuthis oualaniensis)渔业生物学比较研究*
陆化杰 宁 欣 刘 维 张羽翔 陈子越 陈新军, 3, 4, 5, 6
不同气候条件下南海西沙海域鸢乌贼()渔业生物学比较研究*
陆化杰1宁 欣1刘 维2张羽翔2陈子越1陈新军1, 3, 4, 5, 6
(1. 上海海洋大学海洋科学学院 上海 201306; 2. 海南省海洋与渔业科学研究院 海口 570100; 3. 国家远洋渔业工程技术研究中心 上海 201306; 4. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306; 5. 农业农村部大洋渔业开发重点实验室 上海 201306; 6. 农业农村部大洋渔业资源环境科学观测实验站 上海 201306)
为探讨不同气候条件对鸢乌贼()渔业生物学影响, 根据2015年8月(厄尔尼诺年)、2016年8月(拉尼娜发生期)和2017年8月(正常时期)我国灯光罩网船在南海采集的1 970尾鸢乌贼样本, 对其胴长、体重、性腺成熟度、胃饱满度、初次性成熟胴长进行了比较研究。结果表明: 不同年间鸢乌贼雌雄比例不同, 2017年最高, 2015年次之, 2016年最低; 优势胴长组不同, 2015年最大, 2017年次之, 2016年最小; 优势体重组也不同, 2015年最大, 2017年次之, 2016年最小。协方差分析表明不同年间胴长与体重的关系均不存在性别间显著性差异, 2015、2016和2017年分别最适用线性、幂和指数函数表示; 不同年间样本性成熟组成存在差异, 雌雄样本性成熟样本分别占对应总数的30.96%和25.40%、46.41%和11.15%、7.35%和28.46%; 胃饱满度组成也不同。不同年间初次性成熟胴长不同, 2015、2016和2017年雄性初次性成熟胴长分别为184.12、144.41、132.70 mm; 雌性分别为192.66、143.68、188.52 mm。结果表明, 不同气候变化引起的海洋环境的变化对鸢乌贼渔业生物学产生影响: 温度升高导致鸢乌贼个体减小, 性成熟胴长减小, 雌雄间的个体差异变大。
鸢乌贼; 渔业生物学特性; 性成熟; 厄尔尼诺; 拉尼娜; 南海
鸢乌贼()为暖水性大洋头足类, 隶属头足纲(Cephalopoda)、枪形目(Idiosepiida)、柔鱼科(Ommastrephidae)、鸢乌贼属() (王尧耕等, 2005), 主要分布于东太平洋、印度洋西北部及南海(张鹏等, 2010)。鸢乌贼生命周期较短, 一般为一年生, 生长速度快, 繁殖力强(粟丽等, 2016), 具有垂直迁移的特性, 白天位于中下层海域, 夜间上浮捕食, 分布于海面表层至1000 m水层(陈新军等, 2009), 是我国头足类渔业重要的捕捞对象, 具有很高的开发潜力(张宇美等, 2013)。近年来, 极端气候频发, 引起海洋气候环境复杂多变(Turner, 2020)。厄尔尼诺与拉尼娜事件为中东太平洋赤道海域温度大范围升高和降低现象, 是全球性年际气候变率的主导模式, 对太平洋、印度洋及周围大陆等大范围的地区有重要影响(朱益民等, 2007)。鸢乌贼资源补充量大, 易受海洋环境变化影响(陈新军等, 2006)。目前有学者对鸢乌贼渔业生物学受海洋环境的变化影响有初步的探讨(陆化杰等, 2018; 江艳娥等, 2019), 但针对厄尔尼诺、拉尼娜以及正常气候条件下鸢乌贼生物学的对比研究尚未见报道。鉴于此, 本研究根据不同气候年间采集的1 970尾鸢乌贼样本, 对比了其渔业生物学特性, 并结合海洋环境变化, 分析了极端气候变化对南海鸢乌贼的影响, 为后续鸢乌贼的资源预测及可持续性开发提供参考。
1 材料与方法
1.1 调查时间与海域
采样海域位于南海西沙群岛海域, 采样时间为2015年、2016年和2017年的8月1—31日。调查海域为15°45N—19°16′N、109°21′—113°15′E (图1)。每天从渔获物中随机抽取鸢乌贼样本20—30尾, 记录站点并冷冻保存, 不同年间采样数量见表1。
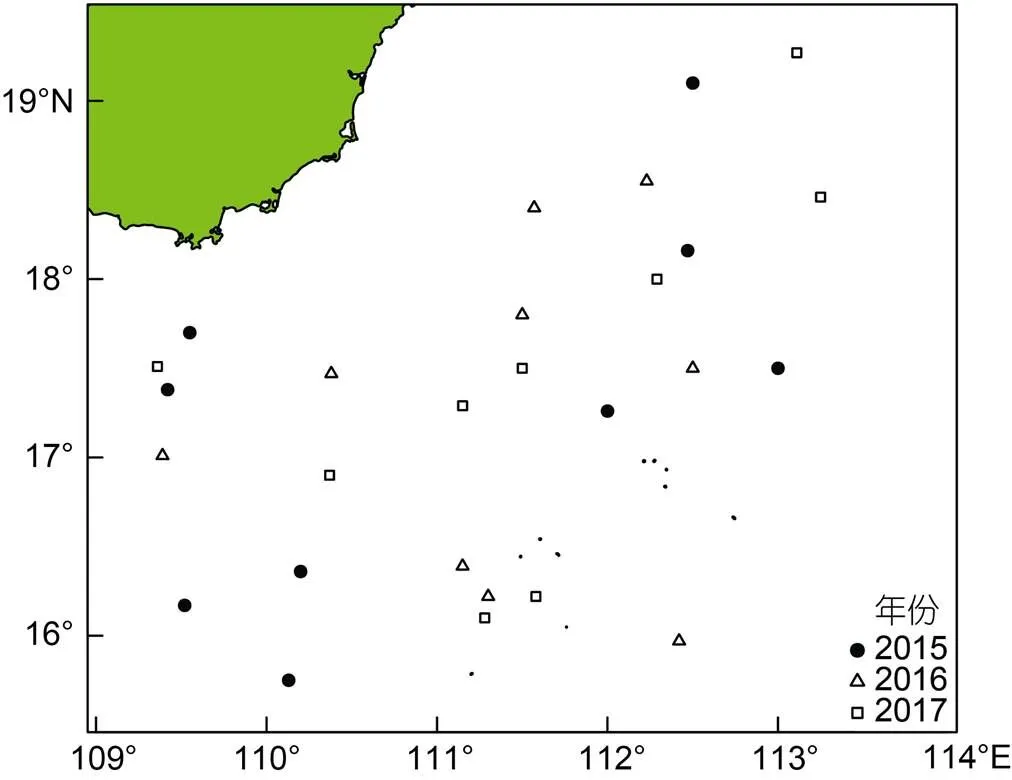
图1 鸢乌贼采样分布图
调查渔船为海南省三亚榆丰渔业公司所属的灯光罩网渔船“琼三亚72057”和“琼三亚72068”, 两船为同一船型: 总长33 m, 型宽6.2 m, 总吨位430 t, 主机功率237 kW, 副机功率163 kW, 发电机功率200 kW, 平均航速9 kn。
1.2 样本生物学测定
样本经实验室解冻后进行生物学测量, 胴长(mantle length, ML)精确至1 mm、体重(body weight, BW)精确至1 g, 鉴定其性别(sex)、性腺成熟度(maturity stage)和胃饱满度(stomach stage), 其中性腺成熟度分为Ⅰ—Ⅴ期, Ⅰ、Ⅱ期为性未成熟期, Ⅲ、Ⅳ、Ⅴ期为性成熟期(李建华等, 2016), 胃饱满度分为1—5级(陆化杰等, 2014)。
1.3 极端气候条件确立
依据美国国家海洋和大气管理局定义, Nino 3.4区海表温度距平指数连续3个月高于0.5 °C为一次厄尔尼诺事件, 连续3个月低于0.5 °C为一次拉尼娜事件(Chen, 2007b)。
2015年为罕见的厄尔尼诺年, 全年海表面温度距平(sea surface temperature anomaly, SSTA)均高于0.5 °C。2016年7月至年末SSTA均低于0.5 °C, 为拉尼娜事件。2017年在捕捞月之前均为正常月份, 未发生厄尔尼诺事件或拉尼娜事件。
1.4 分析方法
(1) 对不同年份样本的性别比例、胴长和体重组成、胃饱满度和性腺成熟度分布进行频度分析(粟丽等, 2016; 陆化杰等, 2018)。
(2) 采用不同函数模型拟合ML与BW的生长方程, 最大似然法估计模型参数, 赤池信息准则(AIC, Akaike’s information criterion)选取最低值方程为最优模型(Imai, 2002)。
(3) 采用Logistic曲线, 推算不同年间南海鸢乌贼的初次性成熟胴长(Tafur, 2001; 李建华等, 2016)。

式中,p为组内性成熟样本比例;l为各组胴长(mm); 初次性成熟胴长ML50%=–。
2 结果
2.1 性别比例
研究表明, 不同年间鸢乌贼性别比例不同, 2017年最高, 2015年次之, 2016年最低(详见表2)。
2.2 胴长组成
不同气候年间雌雄胴长组成均不相同, 其中2015年雄性胴长范围84—250 mm, 优势胴长组100—160 mm, 占比达到83.92%; 雌性胴长范围99—283 mm, 优势胴长组100—160 mm, 达到78.33% (图2a)。2016年雄性胴长范围56.5—236.5 mm, 优势胴长组60—120 mm, 占比达到80.40%; 雌性胴长范围59.5—225 mm, 优势胴长组60—140 mm, 达到75.97% (图2b)。2017年雄性胴长范围59—154 mm, 优势胴长组100—140 mm, 占比达到75.29%; 雌性胴长范围71—229 mm, 优势胴长组80—140 mm, 达82.19% (图2c)。
表1 鸢乌贼样本采集

Tab.1 Sample collection of S. oualaniensis
表2 鸢乌贼性别比例

Tab.2 Female to male ratio of S. oualaniensis
2.3 体重组成
不同气候年间雌雄样本体重组成均不相同。其中2015年雄性体重范围18—791 g, 优势体重组30—150 g, 占比达到77.60%; 雌性体重范围21—941 g, 优势体重组30—180 g, 达到77.92% (图3a)。2016年雄性体重范围7—206 g, 优势体重组0—90 g, 占比达到77.02%; 雌性体重范围7—387 g, 优势体重组0—90 g, 达到75.27% (图3b)。2017年雄性体重范围14—188g, 优势体重组30—90 g, 占比达到76.17%; 雌性体重范围13—584 g, 优势体重组0—90 g, 达到77.82% (图3c)。
2.4 胴长与体重关系
协方差分析表明, 不同气候年间, 样本的胴长和体重的生长均不存在性别间显著性差异(2015年:=2.150,=0.143>0.05; 2016年:=0.02,=0.881> 0.05; 2017年:=2.232,=0.136>0.05)。通过模型优化比较(表3), 线性函数为2015年(厄尔尼诺年)南海鸢乌贼胴长和体重关系最适表达模型, 幂函数为2016年(拉尼娜发生期)最适表达模型, 指数函数为2017年(正常时期)最适表达模型(图4):
胴长与体重: BW=3.993 3 ML–427.249 (2015年); BW=2×10–4ML2.730 4(2016年); BW=4.511e0.022 8 ML(2017年)。

图2 鸢乌贼胴长组成
注: a. 2015年胴长组成分布; b. 2016年胴长组成分布; c. 2017年胴长组成分布

图3 鸢乌贼体重组成
注: a. 2015年体重组成分布; b. 2016年体重组成分布; c. 2017年体重组成分布
表3 鸢乌贼胴长与体重生长模型的生长参数与AIC值比较

Tab.3 Comparison of parameters and AIC for mental length growth models of S. oualaniensis
2.5 胃饱满度组成
研究表明, 不同气候年间鸢乌贼胃饱满度的组成不同。2015年(厄尔尼诺年)胃饱满度主要为2—3级, 占总样本的72.17%, 雌雄胃饱满度的组成不完全相同: 雄性以2级最多, 达到其总数的45.40%, 其他由高到低依次为3级、1级、4级和5级, 分别占26.98%、20.32%、6.03%和1.27%; 雌性样本中2级最多, 达到其总数的36.82%, 其他由高到低依次为3级、1级、4级和5级, 分别占35.15%、17.57 %、10.04%和0.42% (图5a)。2016年(拉尼娜发生期) 1级胃饱满度占总样本的85.98%, 雄性绝大多数为1级, 占雄性总数的93.33%, 2级和3级分别为5.83%和0.83%, 无4级及以上的样本; 雌性中也以1级胃饱满度最多, 占雌性总数的78.63%, 其他由高到低依次为2级、3级和4级, 占17.56%、3.05 %和0.76%, 无5级雌性样本(图5b)。2017年(正常时期)胃饱满度2—4级为优势组成, 占样本总数的76.52%, 雄性以4级最多, 占其总数的33.20%, 其他由高到低依次为3级、5级、2级和1级, 分别占雄性总样本21.09%、20.70%、17.19%和7.81%; 雌性中同样以4级最多, 占雌性总样本的30.89%, 其他由高到低依次为5级、3级、2级和1级, 占27.64%、19.51 %、11.38%和10.57% (图5c)。

图4 鸢乌贼胴长与体重关系
2.6 性腺成熟度分布
研究表明, 不同气候年间南海西沙海域鸢乌贼性成熟度分布不同。2015年鸢乌贼雄性个体Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期样本数依次为149、86、68和12尾, 分别占雄性样本的47.30%、27.31%、21.59%和3.81%; 雌性鸢乌贼个体Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期样本数依次为115、50、52和22尾, 分别占雌性样本的48.12%、20.92%、21.76%和9.20%。两个性别均未出现Ⅴ期样本, 性成熟样本数(Ⅲ期以上)分别占雄性和雌性样本总数的25.40%和30.96% (图6a)。2016年雄性Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期样本数依次为292、202、60和2尾, 分别占雄性样本的52.52%、36.33%、10.79%和0.36%;雌性鸢乌贼个体Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期和Ⅴ期样本数依次为136、58、46、61和61尾, 分别占雌性样本的37.57%、16.02%、12.71%、16.85%和16.85%。其中雄性未出现Ⅴ期样本, 性成熟样本数分别占雄性和雌性样本总数的11.15%和46.41% (图6b)。2017年雄性个体Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期样本数依次为99、82、52和20尾, 分别占雄性样本的39.13%、32.41%、20.55%和7.90%; 雌性鸢乌贼个体Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期样本数依次为220、7、4和14尾, 分别占雌性样本89.80%、2.86%、1.63%和5.71%。两个性别均未出现Ⅴ期样本, 性成熟样本数分别占雄性和雌性样本总数的28.46%和7.35% (图6c)。

图5 鸢乌贼胃饱满度组成
注: a. 2015年胃饱满度组成; b. 2016年胃饱满度组成; c. 2017年胃饱满度组成

图6 鸢乌贼性腺成熟度组成
注: a. 2015年性腺成熟度组成; b. 2016年性腺成熟度组成; c. 2017年性腺成熟度组成
2.7 初次性成熟胴长估算
研究表明, 不同气候年间南海西沙海域鸢乌贼雌雄个体的初次性成熟胴长不同: 2015年(厄尔尼诺年)雄性为184.12 mm (图7a), 雌性为192.66 mm (图7b); 2016年(拉尼娜发生期)雄性为144.41 mm (图7c), 雌性为143.68 mm (图7d); 2017年(正常时期)雄性为132.70 mm (图7e), 雌性为188.52 mm (图7f)。


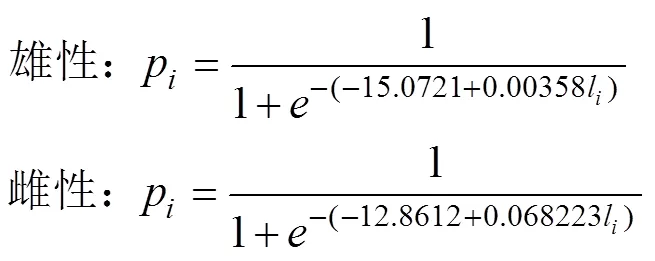
3 讨论与分析
3.1 生长特征
不同气候条件下雌雄个体生长存在差异, 但雌性胴长与体重均大于雄性, 这与其他学者的结果相同(Bello, 2001)。胴长相同个体, 雌性触腕长于雄性, 鳍宽也更宽, 因此一般认为雌性比雄性捕食能力强, 摄食量更大(Chembian, 2013), 本研究中不同年间雌雄胃饱满度较高(3级以上)的个体占比分别为45.61%、34.29% (2015年); 3.82%、0.83% (2016年); 78.05%、75% (2017年), 雌性均高于雄性, 也印证这一观点, 即高效的营养获取使雌性生长速度更快。
不同气候年间胴长与体重组成存在差异, 2015年间(厄尔尼诺)鸢乌贼优势胴长组最大, 2017年(正常时期)次之, 2016年(拉尼娜)最小。分析认为, 厄尔尼诺期间南海西沙海域鸢乌贼索饵场温度偏低, 拉尼娜期间温度偏高(陆化杰等, 2018), 温度降低, 鸢乌贼个体增大, 这与其他学者研究结论一致, 如加利福尼亚湾茎柔鱼()在2009—2010年厄尔尼诺期间个体偏小(Hoving, 2013); Forsythe等(1989)发现福氏枪乌贼()在水温相差1 °C的水域中饲养, 个体大小可以相差三倍; 柔鱼()处在生产力水平较高亚热带锋的秋季产卵群个体明显大于冬春群个体(Ichii, 2011)。另有学者研究发现, 头足类成体个体大小受卵粒大小影响, 两者呈正相关(Segawa, 1990), 雌性鸢乌贼9—10个月左右成熟, 多次产卵且产卵期长(可持续4个月), 期间需大量摄食保证产卵, 因此鸢乌贼繁殖行为易受环境影响, 进而影响性成熟个体大小, 也为本结果提供了佐证(German, 2002; Laptikhovsky, 2005)。

图7 鸢乌贼初次性成熟胴长
注: a. 2015年雄性初次性成熟胴长; b. 2015年雌性初次性成熟胴长; c. 2016年雄性初次性成熟胴长; d. 2016年雌性初次性成熟胴长 e. 2017年雄性初次性成熟胴长; f. 2017年雌性初次性成熟胴长
不同气候年间胴长与体重关系也不相同, 2015年(厄尔尼诺)、2016年(拉尼娜)和2017年(正常时期)南海西沙鸢乌贼胴长与体重关系分别最适用线性函数、幂函数和指数函数表示, 且三年均不存在性别间显著性差异。江艳娥等(2019)对2012年(拉尼娜)南海鸢乌贼研究发现雌雄个体之间不存在性别间显著性差异, 胴长体重关系最适合用幂函数表示, 这与本研究结论相同。陆化杰等(2018)、李建华等(2016)对2016年、2014年(正常时期)南海群岛海域中沙、南沙鸢乌贼研究发现其胴长与体重关系存在性别间显著性差异, 且胴长与体重关系最适用幂函数表示; Chen等(2007a)对2004年(厄尔尼诺)西北印度洋鸢乌贼的研究认为胴长与体重关系最适用幂函数表示, 这与本研究结果不同。不同海域生长方程不同, 可能是捕捞海域不同, 受索饵对象和海洋环境因素影响导致。
3.2 繁殖特征
不同气候条件下南海西沙群岛鸢乌贼雌雄组成存在差异, 2017年(正常时期)雌雄比接近于1, 这与李建华等(2016)对2014年(正常时期)中西太平洋鸢乌贼研究结果相同, 但在2015年(厄尔尼诺)、2016年(拉尼娜)雄性个体数量均多于雌性。初步分析认为, 雌性鸢乌贼承担产卵的任务, 性成熟时性腺大且重。有研究发现, 在不考虑温度和营养等外界因素条件下, 性腺重量与胴体肌肉重量呈反比(Gabr, 1999)。相关研究还表明, 雌性产卵时会将胴体肌肉作为能量储备, 导致雌雄个体在生殖方面的投入不同, 而温度变化一般不会导致雄性头足类精子活度变化(Naud, 2006), 但会使雌性头足类改变卵粒的大小与产卵次数(Pecl, 2008), 这一现象也可能会加剧雌雄数量差异性, 雌性鸢乌贼生长过程中更高的生殖投入可能导致雌性个体数量较少。
本研究表明, 2015年、2017年8月捕捞鸢乌贼性成熟个体占比存在显著差异, 2015年性成熟鸢乌贼数量(27.79%)多于2016年(25.05%)和2017年(18.07%), 且2015年雌、雄鸢乌贼性成熟个体占比(30.96%、25.40%)差异较2016年(41.41%、11.15%)和2017年(7.35%、28.46%)小, 原因可能是厄尔尼诺期间, 南海温度偏低(刘成程等, 2017), 造成性腺投入量少(Pecl, 2004), 生长相同重量性腺对营养物质与氧气等养料需求减少, 性成熟较往年提前, Hoving等(2013)对茎柔鱼的研究中也发现性成熟提前的现象。
不同气候条件鸢乌贼初次性成熟胴长存在差异, 正常时期(雄性132.70 mm, 雌性188.52 mm)雌雄间初次性成熟胴长差异较大, 可能是正常时期较厄尔尼诺期间海水表面温度偏高, 温度升高使雌雄间个体大小差异更大, Pecl(2004)等学者对澳大利亚拟乌贼()的研究与本结论一致, 厄尔尼诺期年间初次性成熟胴长(雄性184.12 mm, 雌性192.66 mm)明显长于拉尼娜年间(雄性144.41 mm, 雌性143.68 mm), 联系胃饱满度分布探究, 2015年全部样本胃饱满度以2—3级为主, 占样本总数的72.17%, 而2016年鸢乌贼样本中胃饱满度1级占优势地位, 达样本总数的85.98%, 可能因为拉尼娜期间, 南海鸢乌贼索饵场受海表面信风与海流影响, 海水上层水体营养不足, 导致鸢乌贼初次性成熟胴长明显下降, 营养物质的丰富程度可能是比温度更重要的影响因素。
4 结论与展望
本研究通过厄尔尼诺(2015年)、拉尼娜(2016年)、正常时期(2017年)鸢乌贼渔业生物学资料对不同海洋环境下鸢乌贼的个体差异进行了探究, 发现其对海洋环境变化响应剧烈, 渔业生物学特性差异明显: 2015年南海鸢乌贼雄性数量多于雌性, 整体样本个体较大, 性成熟时间提前; 2016年雄性数量也多于雌性且雌雄性别比例差异最大, 海域营养水平较低, 初次性成熟胴长小; 2017年雌雄数量较为接近且雌雄间初次性成熟胴长差异大。鸢乌贼生长速度快, 捕捞量大, 在南海渔业中处于重要地位(张宇美等, 2013), 今后应对海水表面温度、海水表面盐度、海水表面风场、叶绿素浓度等海洋环境因子如何具体影响鸢乌贼生长进行更深层的研究, 从而为鸢乌贼的开发提供更充分、更充实的依据。
王尧耕, 陈新军, 2005. 世界大洋性经济柔鱼类资源及其渔业. 北京: 海洋出版社, 78—93
刘成程, 张文超, 晏 宏, 2017. 南海西沙海域温度异常对厄尔尼诺-南方涛动活动的响应. 地球环境学报, 8(2): 148—156
李建华, 陈新军, 方 舟等, 2016. 3个不同海区鸢乌贼渔业生物学的初步比较. 海洋渔业, 38(6): 561—569
朱益民, 杨修群, 陈晓颖等, 2007. ENSO与中国夏季年际气候异常关系的年代际变化. 热带气象学报, 23(2): 105—116
江艳娥, 陈作志, 林昭进等, 2019. 南海海域鸢乌贼中型群与微型群渔业生物学比较. 水产学报, 43(2): 454—466
张 鹏, 杨 吝, 张旭丰等, 2010. 南海金枪鱼和鸢乌贼资源开发现状及前景. 南方水产, 6(1): 68—74
张宇美, 颜云榕, 卢伙胜等, 2013. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究. 广东海洋大学学报, 33(3): 56—64
陆化杰, 王从军, 陈新军, 2014. 4—6月东太平洋赤道公海鸢乌贼生物学特性初步研究. 上海海洋大学学报, 23(3): 441—447
陆化杰, 童玉和, 刘 维等, 2018. 厄尔尼诺年春季中国南海中沙群岛海域鸢乌贼的渔业生物学特性. 水产学报, 42(6): 912—921
陈新军, 刘必林, 王尧耕, 2009. 世界头足类. 北京: 海洋出版社, 1065—1066
陈新军, 邵 峰, 2006. 印度洋西北部公海鸢乌贼资源特征及其与海况的关系. 中国海洋大学学报, 36(4): 611—616
粟 丽, 陈作志, 张 鹏, 2016. 南海中南部海域春秋季鸢乌贼繁殖生物学特征研究. 南方水产科学, 12(4): 96—102
Bello G, 2001. Dimorphic growth in male and female cuttlefish(Cephalopoda: Sepiidae) from the Adriatic Sea. Helgoland Marine Research, 55: 124—127
Chembian A J, 2013. Studies on the Biology, Morphometrics and Biochemical composition of the Ommastrephid squid,(Lesson, 1830) of the south west coast of India. Cochin: Doctor Dissertation of Cochin University of Science and Technology, 46
Chen X J, Liu B L, Tian S Q, 2007a. Fishery biology of purpleback squid,, in the northwest Indian Ocean. Fisheries Research, 83(1): 98—104
Chen X J, Zhao X H, Chen Y, 2007b. Influence ofon the western winter-spring cohort of neon flying squid () in the northwestern Pacific Ocean. ICES Journal of Marine Science, 64(6): 1152—1160
Forsythe J W, Hanlon R T, 1989. Growth of the Eastern Atlantic squid,Steenstrup (Mollusca: Cephalopoda). Aquaculture Research, 20(1): 1—14
Gabr H R, Hanlon R T, Hanafy M H, 1999. Reproductive versus somatic tissue allocation in the cuttlefish Sepia dollfusi Adam (1941). Bulletin of Marine Science, 65(1): 159—173
German Z, Chesalin N, Michael C, 2002. Main results of long-term worldwide studies on tropical nektonic oceanic squid genus: An overview of the soviet investigations. Bulletin of Marine Science, 71(2): 1019—1060
Hoving H J T, Gilly W F, Markaida U, 2013. Extreme plasticity in life-history strategy allows a migratory predator (jumbo squid) to cope with a changing climate. Global Change Biology, 19(7): 2089—2103
Ichii T, Mahapatra K, Sakai M, 2011. Changes in abundance of the neon flying squidin relation to climate change in the central North Pacific Ocean. Marine Ecology Progress Series, 441: 151—164
Imai C, Sakai H, Katsura K, 2002. Growth model for the endangered cyprinid fishbased on otolith analyses. Fisheries Science, 68(4): 843—848
Laptikhovsky V V, Nigmatullin C M, 2005. Aspects of female reproductive biology of the orange-back squid,(Steenstup) (Oegopsina: Ommastrephidae) in the eastern tropical Atlantic. Scientia Marina, 69(3): 383—390
Naud M J, Havenhand J N, 2006. Sperm motility and longevity in the giant cuttlefish,(Mollusca: Cephalopoda). Marine Biology, 148(3): 559—566
Pecl G, 2004. Therelationships between season of hatching, growth and condition in the southern calamary,. Marine and Freshwater Research, 55(4): 429—438
Pecl G, Jackson G D, 2008. The potential impacts of climate change on inshore squid: biology, ecology and fisheries. Reviews in Fish Biology and Fisheries, 18(4): 373—385
Pecl G, Moltschaniwskyj N, Tracey S R, 2004. Inter-annual plasticity of squid life history and population structure: ecological and management implications. Oecologia, 139(4): 515—524
Segawa S, 1990. Food consumption, food conversion and growth rates of the oval squidby laboratory experiments. Nippon Suisan Gakkaishi, 56(2): 217—222
Tafur R, Villegas P, Rabí M, 2001. Dynamics of maturation, seasonality of reproduction and spawning grounds of the jumbo squid(Cephalopoda: Ommastrephidae) in Peruvian waters. Fisheries Research, 54(1): 33—50
Turner R, McConney P, Monnereau I, 2020. Climate change adaptation and extreme weather in the small-scale fisheries of Dominica. Coastal Management, 48(5): 436—455
COMPARISON IN FISHERY BIOLOGY OFIN DIFFERENT CLIMATE EVENTS IN THE SOUTH CHINA SEA
LU Hua-Jie1, NING Xin1, LIU Wei2, ZHANG Yu-Xiang2, CHEN Zi-Yue1, CHEN Xin-Jun1, 3, 4, 5, 6
(1. College of Marine Sciences of Shanghai Ocean University, Shanghai 201306, China; 2. Hainan Academy of Ocean and Fishery Sciences, Haikou 570100, China; 3. National Distant-water Fisheries Engineering Research Center, Shanghai Ocean University, Shanghai 201306, China; 4. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China; 5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China; 6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China)
The effect of different climate events on the fishery biology of the purple back flying squid() was studied based on 1 970 samples collected during El Niño year (August 2015), La Niña year (August 2016), and normal year (August 2017) in the South China Sea. The result indicated that the ratio of females to males was different in the different years, the largest in 2017, the second in 2015, and the smallest in 2016. The mantle length (ML) and body weight (BW) composition was also different in those years with a different high concentration (the largest in 2015, then in 2017, and smallest in 2016). The relationship between the ML and BW was different and there was no significant difference in gender among those years, and the relationship could be best described by linear (2015), power (2016), and exponent (2017) functions. The matured individuals were different in those years, accounting for 25.40%, 11.15%, and 28.46% for males, and 30.96%, 46.41%, 7.35% for females, respectively. In addition, the feeding stages were different. The first mature mantle length was different in those years, being 184.12 mm, 144.41 mm, and 132.70 mm for males; and 192.66 mm, 143.68 mm, and 188.52 mm for females in 2015, 2016, and 2017, respectively. Warmer seawater could resulted in smaller body size, shorter fist mature ML, and enlarged individual difference between male and female.
; fisheries biological characteristic; gonad maturity stage; the El Niño year; the La Niña year; the South China Sea
* 国家重点研发计划项目, 2019YFD0901404号, 2019YFD090402号; 国家自然科学青年基金项目, NSFC 4150618号。陆化杰, 博士, 副教授, 硕导, E-mail: hjlu@shou.edu.cn
2020-11-02,
2021-03-25
S931; S932; Q958
10.11693/hyhz20201100304

