氟盐作氟化剂制备LiFSI的研究
蒋家巧,姬文晋,苏小辉
(广东工业大学 轻工化工学院,广东 广州 510006)
锂离子电池的出现推动了新能源汽车及动力电池需求市场的飞速发展[1],科技飞跃同时对电解质性能的要求也越来越高,需兼具高电压、高能量密度、安全等特性[2]。传统六氟磷酸锂因高温易分解,在高电压锂离子电池领域应用受限制[3],而双氟磺酰亚胺锂(LiFSI)不仅具备高导电性,且高低温均适用,深受市场青睐[4]。然而LiFSI的研制普遍存在:制备工艺复杂、纯度低、产率低、成本高、后处理麻烦等问题[5]。以双氯磺酰亚胺(HClSI)为原料,经过成盐、氟盐氟化、锂型分子筛(Li-LSX)阳离子交换制备LiFSI有望解决上述问题。
1 实验部分
1.1 试剂与仪器
Na-LSX、氟化钠、氟化钾、氟化钙、氟化锂、氟化锌、氯化钠、氯化钾、氯化钙、氯化锂、氯化锌、碳酸二甲酯、乙腈、甲醇均为分析纯;HClSI,纯度99.8%,电池材料。
AAS-6880原子分光光度计;LC-MS 2020液相-质谱联用仪;AVANCE Ⅲ HD400 核磁共振仪;ZDF-12-10马弗炉;D8401多功能搅拌器;HH-S1电热数显恒温水浴锅。
1.2 LiFSI制备
1.2.1 合成MFSI 无水无氧条件下,将MmCln和碳酸二甲酯(DMC)搅拌至溶解。加入适量HClSI[n(MmCln)/n(HClSI)=n/2][6],30 ℃反应1 h后加入适量MmFn[n(MmFn)/n(MmCln)=1.2],持续反应5 h。收集滤液,得MFSI粗产物[7]。其合成反应式如下:
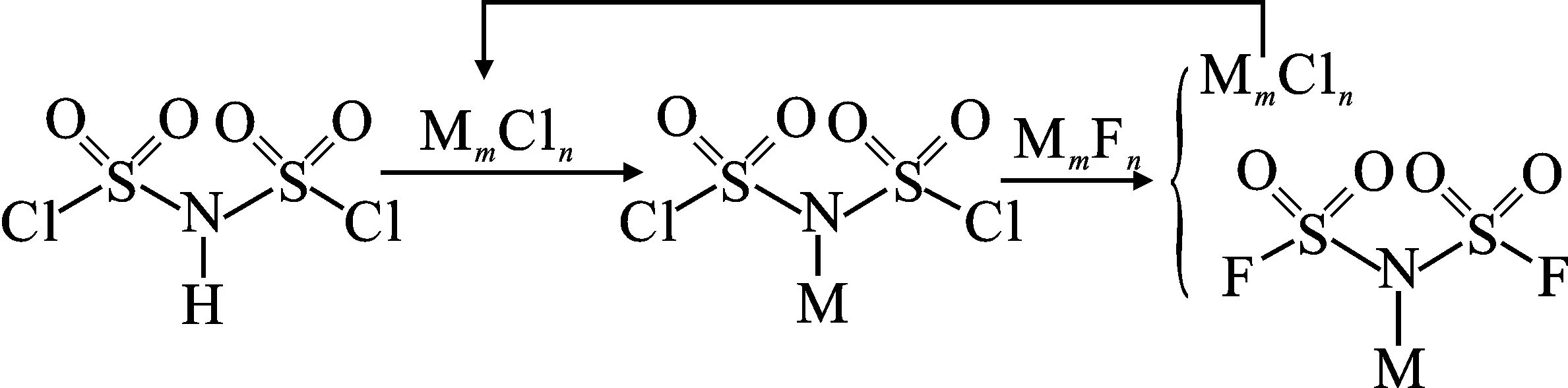
注:M为Ca、Zn、Li、K、Na
1.2.2 Li-LSX的制备 称取适量活化后的Na-LSX原粉和0.4 mol/L的LiCl溶液90 ℃搅拌交换2 h。滤出滤粉,与新的LiCl溶液重复交换4次[8-9],过滤、烘干。将滤粉与LiCl粉末研匀后置于马弗炉焙烧,按2.5 ℃/min升温到450 ℃恒温3 h至交换完成,自然降温得Li-LSX[10]。
1.2.3 阳离子交换 称适量Li-LSX浸泡在0.6 mol/L MFSI溶液中,200 r/min下搅拌24 h后换新的Li-LSX对滤液重复交换3次,得LiFSI粗产物[11]。粗产物及Li-LSX装于坩埚,拌匀后置于马弗炉焙烧,按2.5 ℃/min升温到300 ℃后恒温1 h,至离子交换平衡[12]。自然降温,过滤,干燥,得LiFSI产物 。
交换过的Li-LSX经300 ℃活化后可作为1.2.2节的原料,循环利用[13]。
1.3 表征及测试
1.3.1 阳离子交换度 假设FSI离子浓度相同的MFSI所得LiFSI浓度相同,则经原子吸收分光光度计分析各产物中阳离子的浓度,可确定MFSI与Li-LSX阳离子交换程度[14]。产物经HNO3溶解后以空气-乙炔火焰,于260~600 nm波长范围测试[15]。
1.3.219F NMR 用氘代氯仿作溶剂,AVANCE Ⅲ HD400 核磁共振仪测定LiFSI氟谱。
1.3.3 LC-MS 采用LC-MS 2020型液质联用仪测试样品结构,色谱柱为岛津VP-ODS柱,250 mm×2.0 mm。柱温40 ℃,流速1 mL/min,流动相A为AN、B为甲醇梯度洗脱,进样量10 μL;质谱条件:ESI离子源,负离子扫描,MRM监测模式[16]。
1.3.4 产物收率分析 假设相同质量的HClSI,经相同物质的量氟离子氟化及足量Li-LSX锂化后所得产物质量相同[17]。则该反应的收率计算如下式所示:

式中m实际——产物的实际质量,g;
m理论——产物的理论质量,g。
2 结果与讨论
2.1 19F NMR分析
采用不同氟盐作氟化剂(A:NaF,B:ZnF2,C:CaF2,D:KF,E:LiF)所得LiFSI的19F NMR结果见图1。
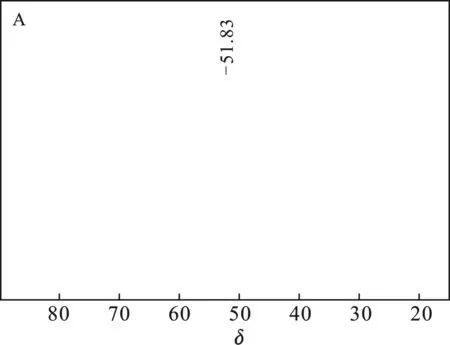
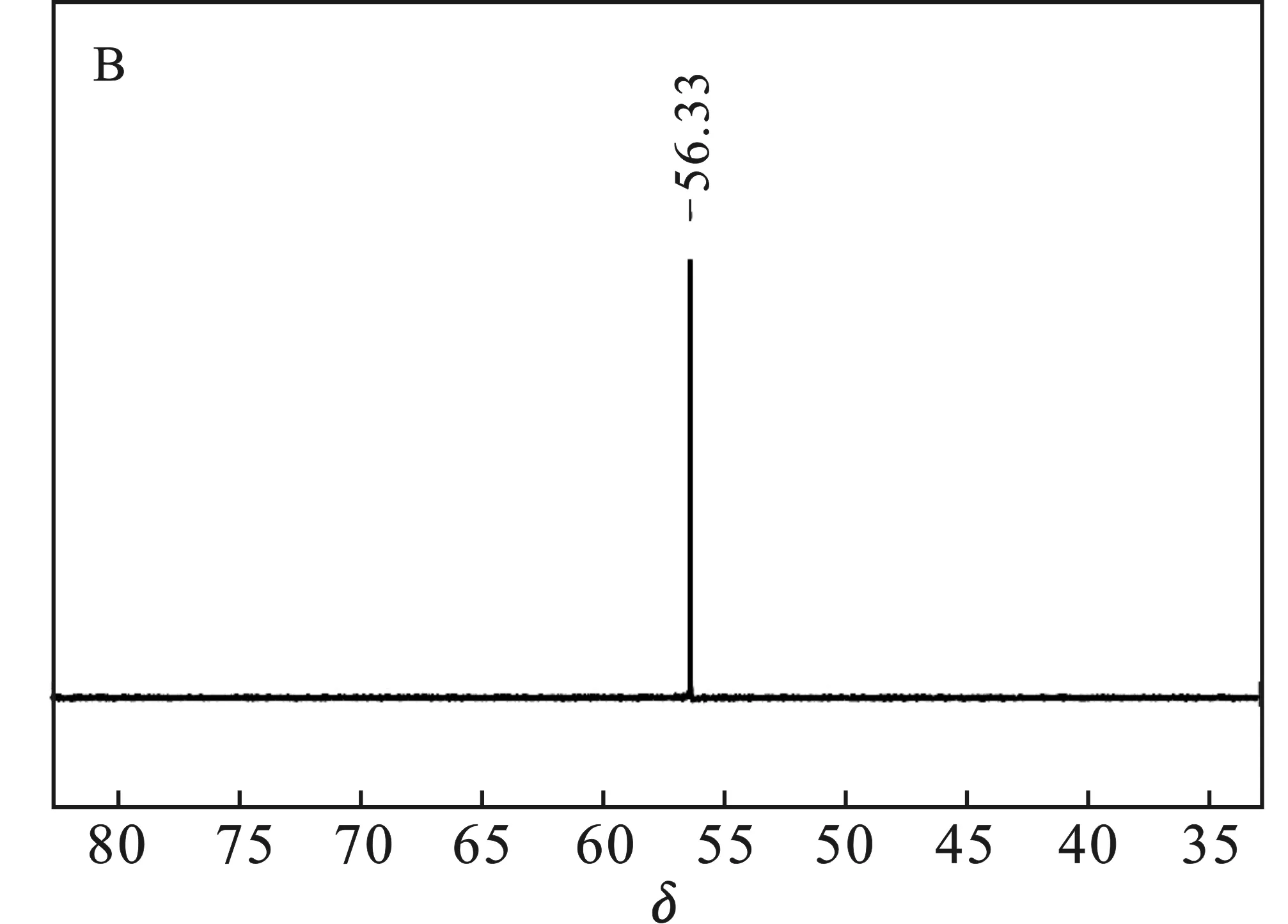
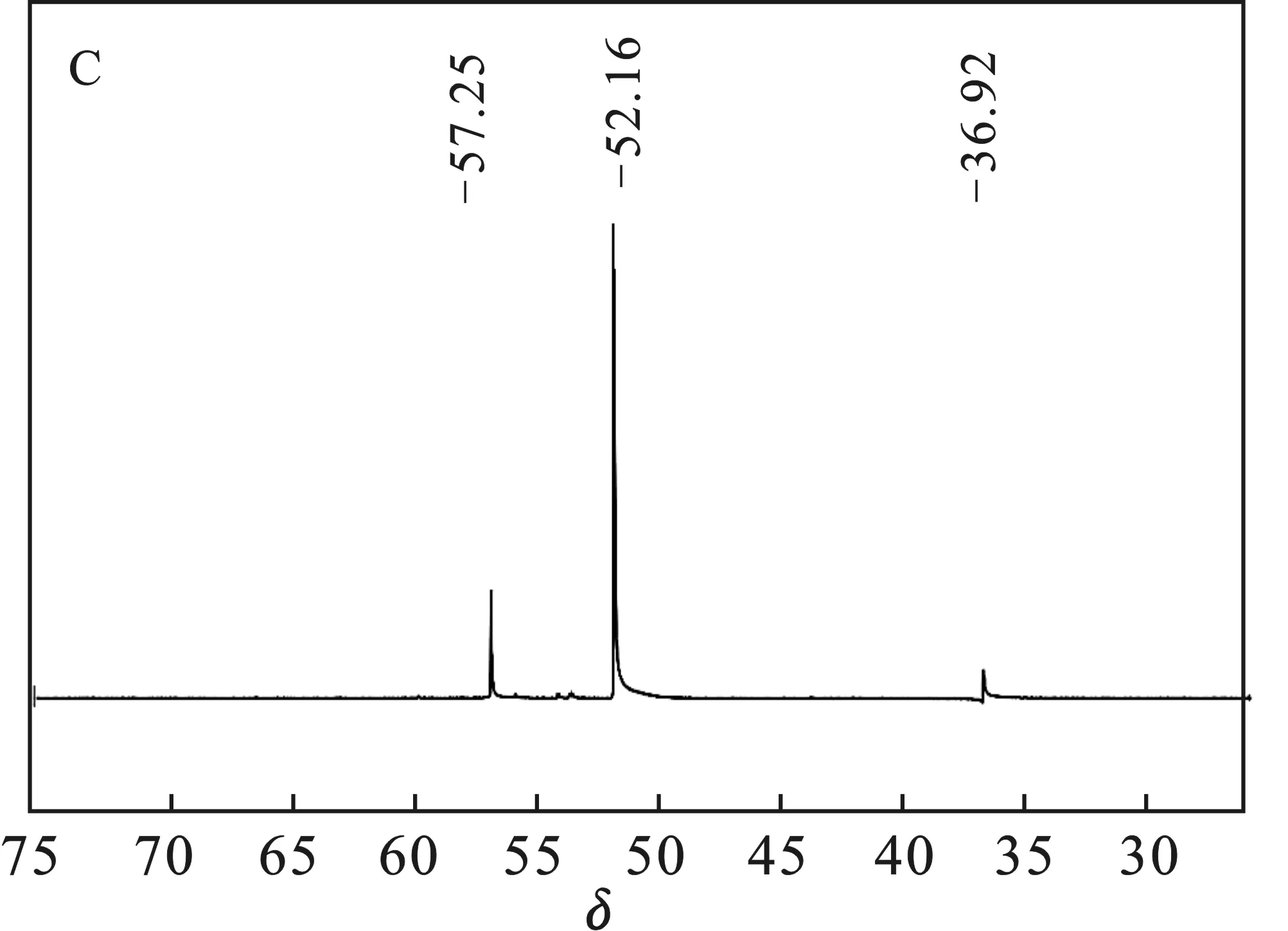
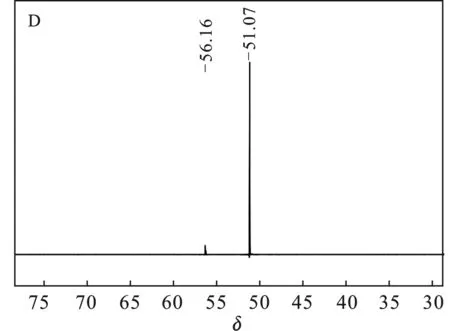
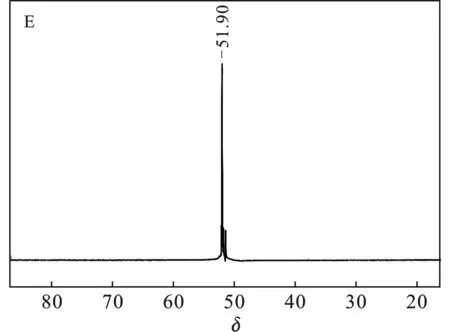
图1 粗产物19F NMR谱图Fig.1 19F NMR spectrum of crude product
图1中δ=51.07 ~52.16均为产物LiFSI的吸收峰;图1(B)δ= 56.33为Zn(FSI)2,图1(C)δ= 57.25为Ca(FSI)2,δ= 36.92为SO2F,可能是因为Ca(ClSI)2氟化不完全[18-19];图1(D)δ=56.16为NaFSI。综上所得,经NaF、LiF氟化所得LiFSI纯度较高;K+、Ca2+因与Li-LSX阳离子交换不完全,存在少量杂质;Zn2+与Li-LSX基本不能交换,因而ZnF2不能作为该方案的氟化剂。
2.2 LC-MS分析
采用不同氟盐所得LiFSI经负离子源模式分析的LC-MS结果见表1。
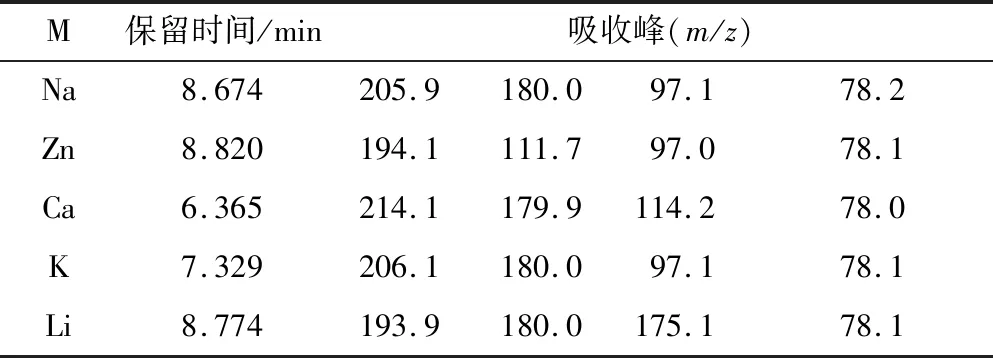
表1 LC-MS测试结果Table 1 Test results of LC-MS
由表1可知,质荷比214.1是N(SO2Cl)2离子峰,质荷比114.2是NSO2Cl离子峰,说明CaF2未将Ca(ClSI)2氟化完全;质荷比205.9和206.1是N(SO2F)2和CN离子加和峰;质荷比194.1和97.1分别是NSO2F离子双倍峰和单倍峰;质荷比179.9及180.0是N(SO2F)2的离子峰;质荷比111.7为NSO2F和CN的加和峰;质荷比78.0,78.1,78.2是NSO2的离子峰[20]。表中LC-MS结果基本符合LiFSI离子分布,CaF2因氟化不完全不能作为该反应的氟化剂。
2.3 阳离子含量分析
Li-LSX骨架内外分布有大量Li+可与MFSI阳离子交换后所得LiFSI,经AAS检测各产物中阳离子的百分含量见表2。
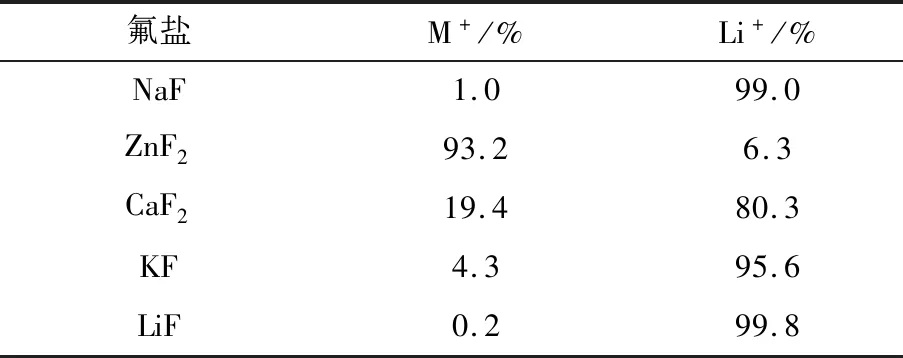
表2 产物中阳离子含量Table 2 The content of cation in product
由表2可知,用NaF和LiF作氟盐,可制得纯度99%以上的LiFSI,阳离子交换基本完全;但ZnF2和KF与Li-LSX锂化交换不完全,可能因LSX分子筛锂化后骨架振动孔径变小,从而离子半径较大的阳离子难以进入β笼实现阳离子交换[21]。
2.4 不同氟化剂所得LiFSI的收率
采用相同质量的原料,经不同氟盐氟化所得MFSI及离子交换后LiFSI的收率见表3。
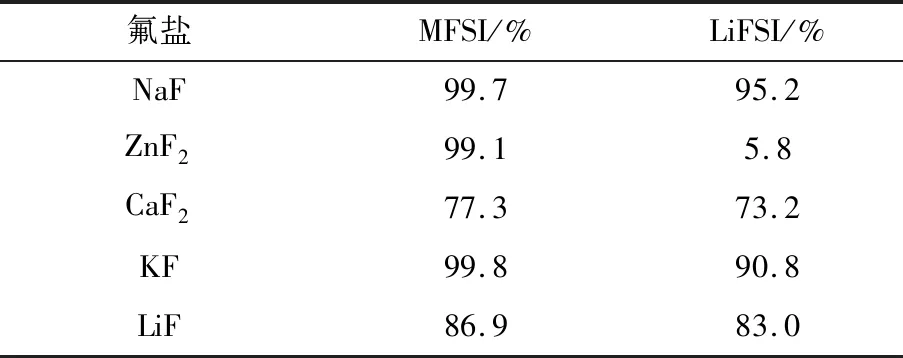
表3 不同氟盐所得MFSI和LiFSI的收率Table 3 Yields of MFSI and LiFSI obtained by different fluorite
由表3可知,NaF作氟化剂,LiFSI收率最高,KF次之。LiF、CaF2因氟化性能较差,产物收率较低,而ZnF2基本不能和Li-LSX实现阳离子交换,因而不能作为该反应的氟盐。若Li-LSX的制备及阳离子交换过程能再简化,则可进一步降低生产成本。
3 结论
HClSI经成盐、氟化、Li-LSX阳离子交换制备LiFSI,不仅能解决制备LiFSI纯度低、产率低、成本高、后处理麻烦等难题,中间副产物还能循环利用、节能又环保。在所有氟盐中,NaF因氟化性能好、阳离子半径较小、价格便宜是该方案的最佳氟盐。

