核桃响应低温胁迫转录因子ICE1基因的克隆与分析
李津津,刘凯,王芳,王红霞,张志华
(1河北农业大学 山区研究所,河北省山区农业工程技术研究中心,国家北方山区农业工程技术研究中心,河北 保定 071001;2 河北农业大学 园艺学院,河北 保定 071001)
低温胁迫对植物的地理分布和生长发育有着重要影响。当植物受到低温胁迫时,转录因子通过结合基因启动子上的顺式作用元件激活低温响应基因COR(Cold-Related)的表达[1]。bHLH(Basic/helix-loop-helix)因含有大约60个氨基酸组成高度保守的bHLH结构域而得名,包含basic和HLH区域,而且是转录因子大家族成员之一,广泛存在于植物中,在植物生长、胁迫应答、信号转导和次生代谢调控中有重要作用[2-3]。ICE属于一种类似MYC的bHLH转录因子,可与CBF3启动子中MYC作用元件特异性结合,并诱导CBF/DREB1下游基因的转录表达[4]。目前,在模式植物拟南芥中ICE1(Inducer of CBF Expression1)-CBF(C-Repeat-Binding-Factor)-COR(Cold-Related)低温信号途径已经基本清晰,为其他植物研究抗寒分子机制的发展提供了理论依据[5]。自2003年Chinnudamy等[6]首次发现拟南芥突变体ice1中CBF3及CBFs下游基因的表达出现了下降,而且抗寒能力下降。研究人员陆续在黑枸杞[7]、枣[8]桑树[9]、桃[10]、苦荞[11]鉴定出了bHLH基因家族转录因子,并且在忍冬[12]、猕猴桃[13]、油菜[14]、茶树[15]、赤桉[4]等植物中鉴定了ICE1同源基因,但未发现在核桃中有报道。ICE是ICE-CBF-COR冷响途径最上游调控因子[5]。在响应低温应答过程中,ICE1转录因子被激活,其下游基因CBFs及COR被诱导表达,以提高自身抵御低温胁迫的能力[16]。已有研究表明,将油菜ICE1基因转化烟草后,在低温胁迫下转基因烟草明显比野生型对照有较高的承受能力[14]。过表达ICE1基因水稻在4 ℃低温胁迫后,转基因株系存活率和脯氨酸含量明显增加,相对电导率和丙二醛含量积累速率明显下降,提高了抗低温胁迫能力[17]。已有多项研究证实ICE1基因通过不同作用方式参与植物自身提高耐寒性能力的过程[18,21]。因此,抗寒机制研究对促进培育抗寒核桃新品种有重要意义。
核桃(JuglansregiaL.),为胡桃科胡桃属的落叶乔木,分布和栽培遍及世界多个国家和地区,是重要的木材树种、生态树种、经济树种和生物能源树种。核桃是喜温树种,适宜生长的温度范围是年均温 9~16 ℃,极端最低气温-25 ℃[22]。由于核桃自身特性,低温胁迫对核桃的生长发育是一个限制因子。特别是晚霜,使核桃的组织器官受冻,影响产量,甚至使核桃绝收。目前为止,关于核桃的研究主要集中在栽培、物理防寒等方面,用分子水平来提高核桃抗寒性还未见报道。本研究通过核桃低温胁迫下高通量转录组测序及RT-PCR技术分析并克隆得到核桃中ICE同源基因,并对其进行了理化性质、蛋白性质、种间同源基因比对及系统进化等生物信息学分析及转录表达分析,旨在为培育核桃耐低温新品种,为研究ICE基因在核桃中的低温响应机制奠定基础。
1 材料与方法
1.1 试验材料
供试材料是种植于河北农业大学标本园的2 a生盆栽核桃(JuglansregiaL.),为同一株砧木上嫁接“辽宁8号”(耐低温)和“清香”(不耐低温)[23]的共计20株嫁接苗。试验材料分为正常组(冷处理0 h)和0.5 ℃(冷处理48 h),正常组和冷处理组各处理10株嫁接苗。低温处理48 h后采集每株第1片复叶上第2片单叶送至北京诺禾致源科技股份有限公司用于RNA-Seq测序,3次重复。其中,研究JrICE1在不同组织表达的供试材料为河北农业大学标本园“清香”核桃,分别采集其根、嫩茎(4月26日)、嫩叶(4月26日)、雄花、雌花、老叶(7月15日)组织,采集后液氮速冻,送至北京诺禾致源科技股份有限公司用于RNA-Seq测序,3次重复。
1.2 核桃ICE1基因的分子克隆
该研究通过转录组测序[padj<0.05 and log2(golden change>0)]及利用RT-PCR技术结合分析并克隆得到核桃中1个ICE1同源基因。核桃JrICE1全长克隆引物序列,见表1。
由表1可知,找到其全长序列并设计引物,以核桃叶片cDNA为模板扩增出基因的编码序列。PCR扩增产物经1.2 %琼脂糖凝胶电泳检测,将符合预期片段大小的片段回收连接pMD18-T载体上由上海生工公司完成DNA测序。
1.3 核桃ICE基因的生物信息学分析
采用NCBI中Blast进行序列的查找与分析,利用ORF Finder (https://www.ncbi.nlm.nih.gov /orffnder/)查找ICE基因的ORF并完成核苷酸的翻译。利用NCBI中的Conserved Domain(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测该基因的保守区域;利用在线分析工具Gene Structure Display Server预测基因结构;利用蛋白质的理化性质使用ExPASy (https://web.expasy.org/ protparam/)在线网站分析;利用PSIPRED(http://bioinf.cs. ucl.ac.uk /psipred)分析蛋白的二级结构,利用NetPhos 3.1 Server和Net NGlyc 1.0 Server分别预测蛋白的糖基化和磷酸化位点;利用 SignalP 3.0 Server(http://www.cbs.dtu.dk/services/SignalP)在线工具对信号肽预测;利用TMHMM 法分析蛋白质的跨膜区:基于 HMM 方法(http://www.cbs.dtu.dk/services/TMHMM/)的蛋白质跨膜区预测工具;利用ngLOC与Nuc-PLoc在线软件预测亚细胞定位。利用DNAMAN8.0对其氨基酸进行多序列同源比对;利用MEGA 7.0构建ML系统发育树。
2 结果与分析
2.1 核桃JrICE1基因克隆
根据设计的引物,以核桃叶片总RNA反转录的cDNA为模板,进行PCR扩增后,产物经1.2 %琼脂糖凝胶电泳检测显示1条1 000~2 000 bp 的特异性条带(图1),与预期一致。测序结果见图2,经 NCBI 数据库检索分析(表2),比对得到1条全长基因序列。经NCBI的ORF进行开放阅读框分析1 659 bp 全长序列,编码552个氨基酸,命名为JrICE1。

表2 核桃JrICE1基本信息Table 2 Basic information of the JrICE1 in walnut
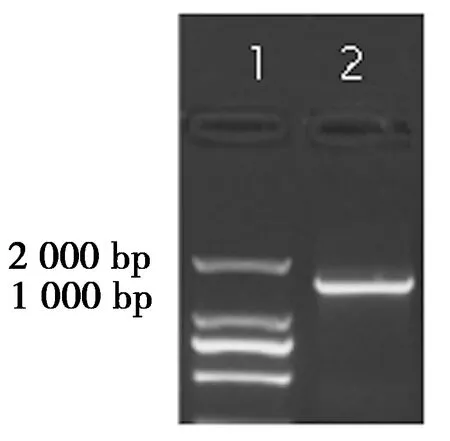
图1 核桃JrICE1基因的PCR扩增Figure 1 PCR amplification of the JrICE1 gene in walnut注: 泳道1是DL 2 000 DNA Marker; 泳道2是JrICE1 全长。
将上述回收基因片段送至生工生物工程股份有限公司测序,测序结果见图2。
2.2 核桃JrICE1的生物信息分析
利用ExPasy对基因的等电点(pI)、蛋白大小(kDa)等蛋白理化性质进行预测,见表3。

注: *终止密码子。图2 核桃JrICE1基因的 cDNA序列及其预测的氨基酸序列Figure 2 The cDNA sequence and its predicted amino acid sequence of walnut JrICE1 gene

表3 核桃JrICE1蛋白质理化性质和一级结构分析Table 3 Analysis of physicochemical properties and primary structure of protein of the walnut JrICE1
由表3可知,JrICE1等电点为5.73,偏酸性;蛋白的分子量为60.51 kDa;不稳定系数为57.26,为不稳定蛋白;脂肪系数为72.30,亲水系数为-0.530,为亲水性蛋白。
根据JrICE1测序获得实际序列,利用NCBI在线分析软件CD-SEARCH对核桃JrICE1蛋白质结构域预测分析见图3。
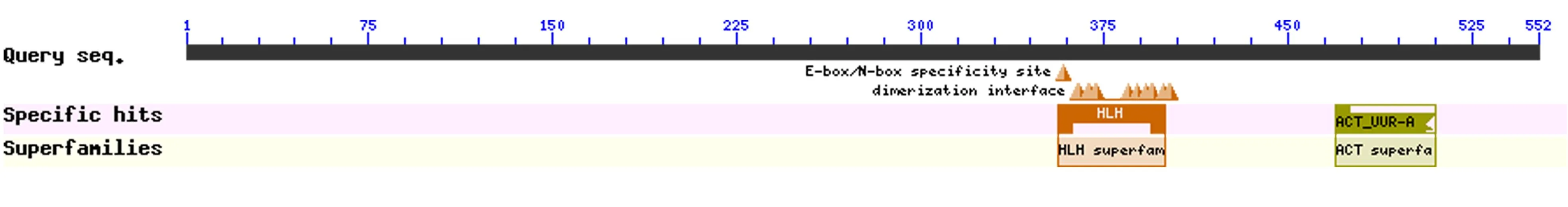
图3 核桃JrICE1保守结构域及位置Figure 3 Conserved domains and locations of the JrICE1
由图3可知,发现该蛋白均包含bHLH结构,并且包含3个功能位点:DNA结合区域、E-box的特异性结合位点以及ACT结构位点,可以看出符合bHLH家族类型特点。此外,该蛋白还有1个与磷酸丝氨酸磷酸化酶相关基因结合的位点。
利用Net NGlyc 1.01.0预测蛋白的糖基化见图4。
由图4可知,发现JrICE1蛋白有2个糖基化位点(位置分别为:131和335);在JrICE1蛋白发现60个磷酸化位点(丝氨酸45个、苏氨酸12个、酪氨酸3个);该蛋白存在多个蛋白激酶结合位点(细胞周期蛋白依赖性激酶I(CKI)、细胞周期蛋白依赖性激酶II(CKII)、胰岛素受体(INSR)、蛋白激酶A (PKA)、蛋白激酶C (PKC)、蛋白激酶G (PKG)、ATM激酶、细胞周期素依赖蛋白激酶5 (CDK5)、细胞分裂周期激酶2 (CDC2)、DNA依赖性蛋白激酶(DNAPK)、促分裂素原活化蛋白激酶(6p38 MAPK)、糖原合成酶激酶3 (GSK3)等12个。
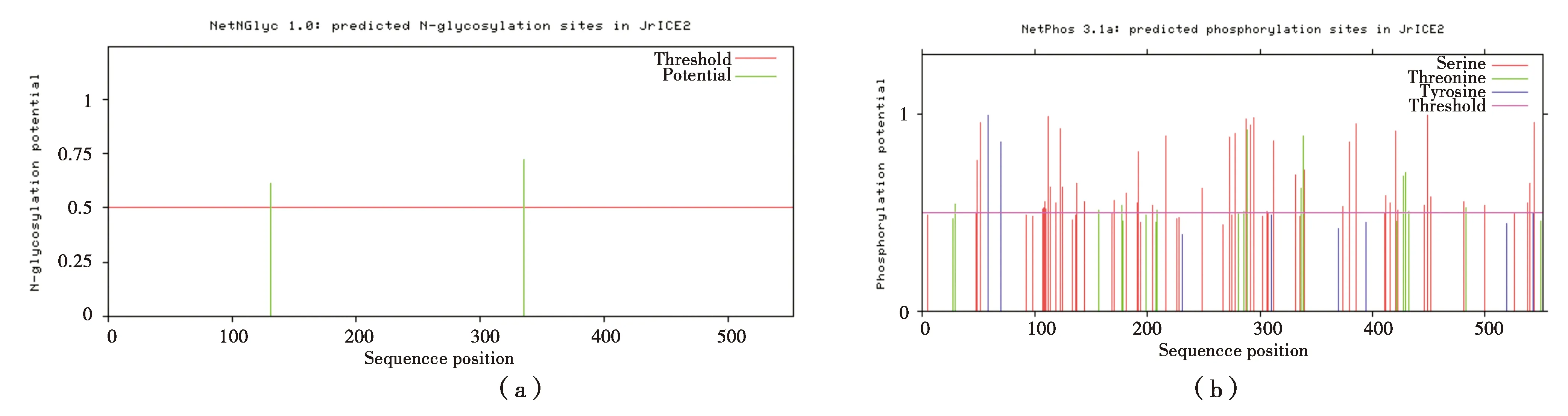
利用SignalP 3.0 Server在线工具对JrICE1蛋白的信号肽进行分析,发现JrICE1蛋白没有信号肽(图4-c),推测该蛋白为非分泌蛋白;基于HMM方法的蛋白质跨膜区预测(参见图4-d),预测JrICE1蛋白均不存在跨膜结构域;利用蛋白质二级结构预测在线工具PSIPRED对JrICE1蛋白二级结构预测(图4-e),发现JrICE1有9处螺旋结构。利用Nuc-PLoc在线软件分析得出,JrICE1蛋白位于细胞核。分析JrICE1蛋白的三级结构,结果显示存在螺旋、折叠等结构(图4-e)。
2.3 核桃JrICE1蛋白系统发育分析
利用DNAMAN 8软件对核桃JrICE1蛋白序列与其他15种植物进行比对,见图5。
如图5可知,核桃和其他植物一样具有bHLH基因家族的典型功能区域,包括富S区(A)、NLS区(B)、bHLH结构域(B+C),下游含转膜区(E),且在bHLH结构域高度保守,其他区域还有部分变异,但是仅有JrICE1含有类泛素化(SUMO)结合位点(D)。
利用MEGA7.0软件,建立16种植物ICE蛋白序列的系统发育树,并通过MEME在线分析软件分析15种植物的保守基序,结果见图6。
由图6可知,核桃JrICE1与毛果杨(Populustrichocarpa)、甜杨(Populussuaveolens)关系最近。

注: PtICE1(毛果杨,Populus trichocarpa,ABN58427.1);HvICE2(大麦,Hordeum vulgare,ABA25897.1);AtiICE1(节节麦,Aegilops tauschii,EMT15292.1);AtICE1(拟南芥,Arabidopsis thaliana,AAP14668.1);TaICE87(小麦,Triticum aestivum,ACB69502.1),TuICE1(乌拉图小麦,Triticum urartu,EMS66007.1);OSICE1(水稻,Oryza sativa,NP_001045272.1);BrsICE1(大白菜,Brassica rapa subsp. Chinensis,ACB70963.1)ZmICE2(玉米,Zea mays,ACG46593.1);GmICE1(大豆,Glycine max,NP_001238560.1);SlICE1(番茄,Solanum lycopersicum,AGG38826.1);MdbHLH1(苹果,Malus domestica, ABS50251.1)。
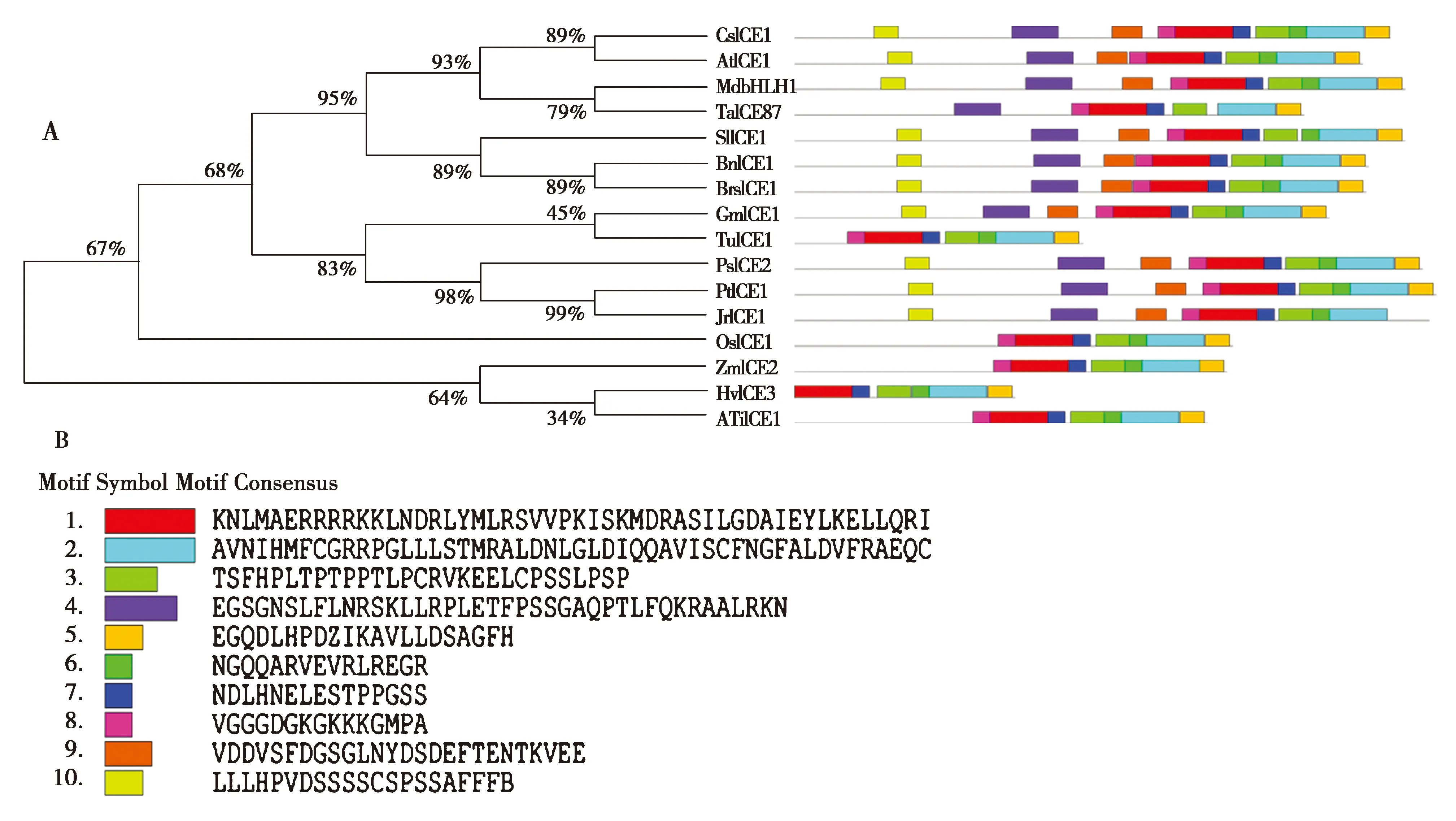
注: A是系统进化树和基序;B是10个保守基序。
2.4 基于RNA-Seq核桃JrICE1基因转录表达分析
基于RNA-Seq核桃JrICE1基因转录表达分析,见图7。
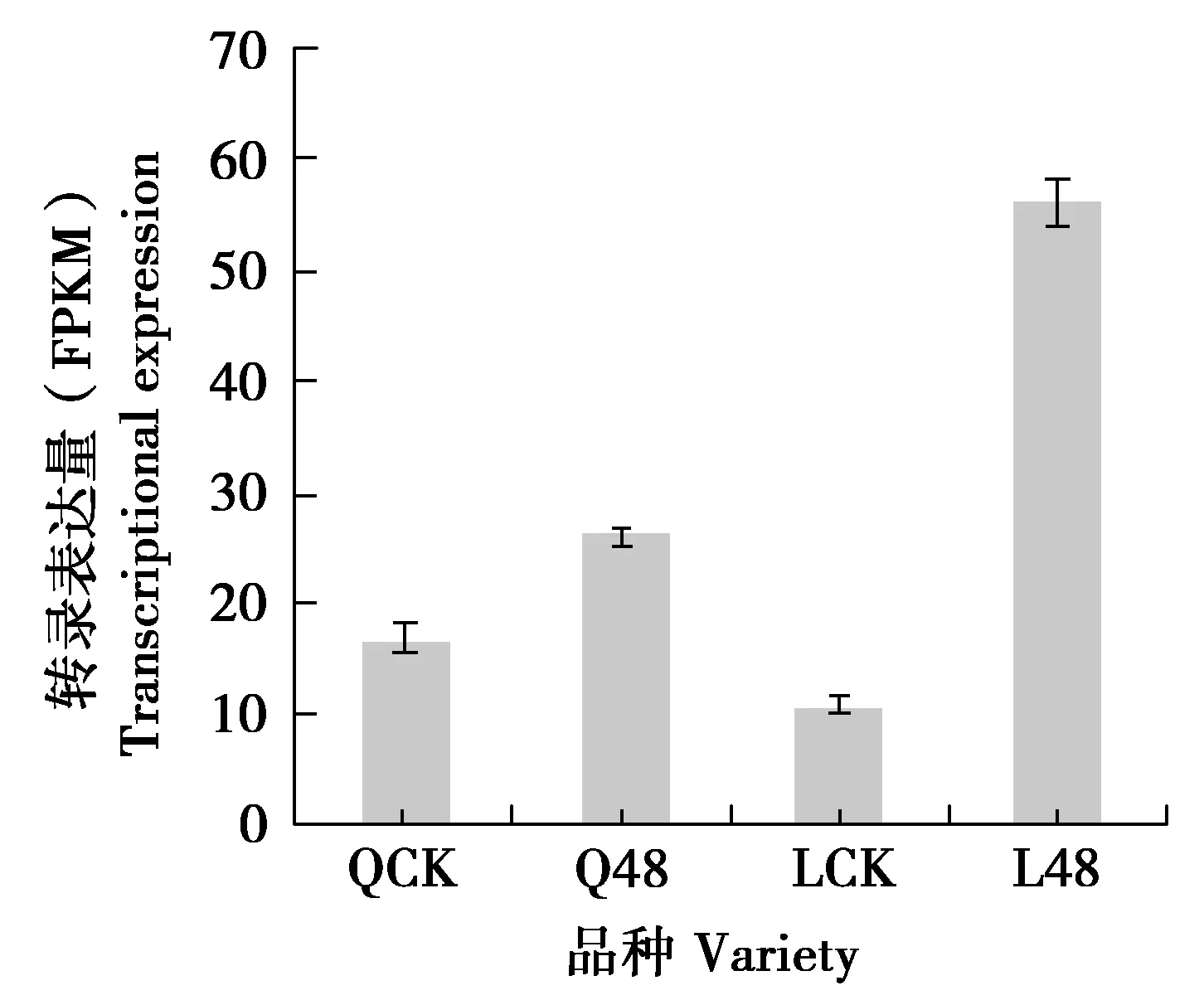
注: QCK是清香对照;Q48是清香48 h低温;LCK是辽宁8号对照;L48是辽宁8号48 h低温。
由图7可知,利用转录组分析JrICE1在“辽宁8号”(耐低温)和“清香”(不耐低温)低温胁迫48 h后中的表达模式表明,JrICE1在“辽宁8号”叶片呈现显著上升,比对照上升0.53倍;JrICE1在“清香”叶片呈现显著上升,比对照上升4.5倍。
利用转录组分析JrICE1在“清香”核桃不同组织中的表达情况,结果见图8。
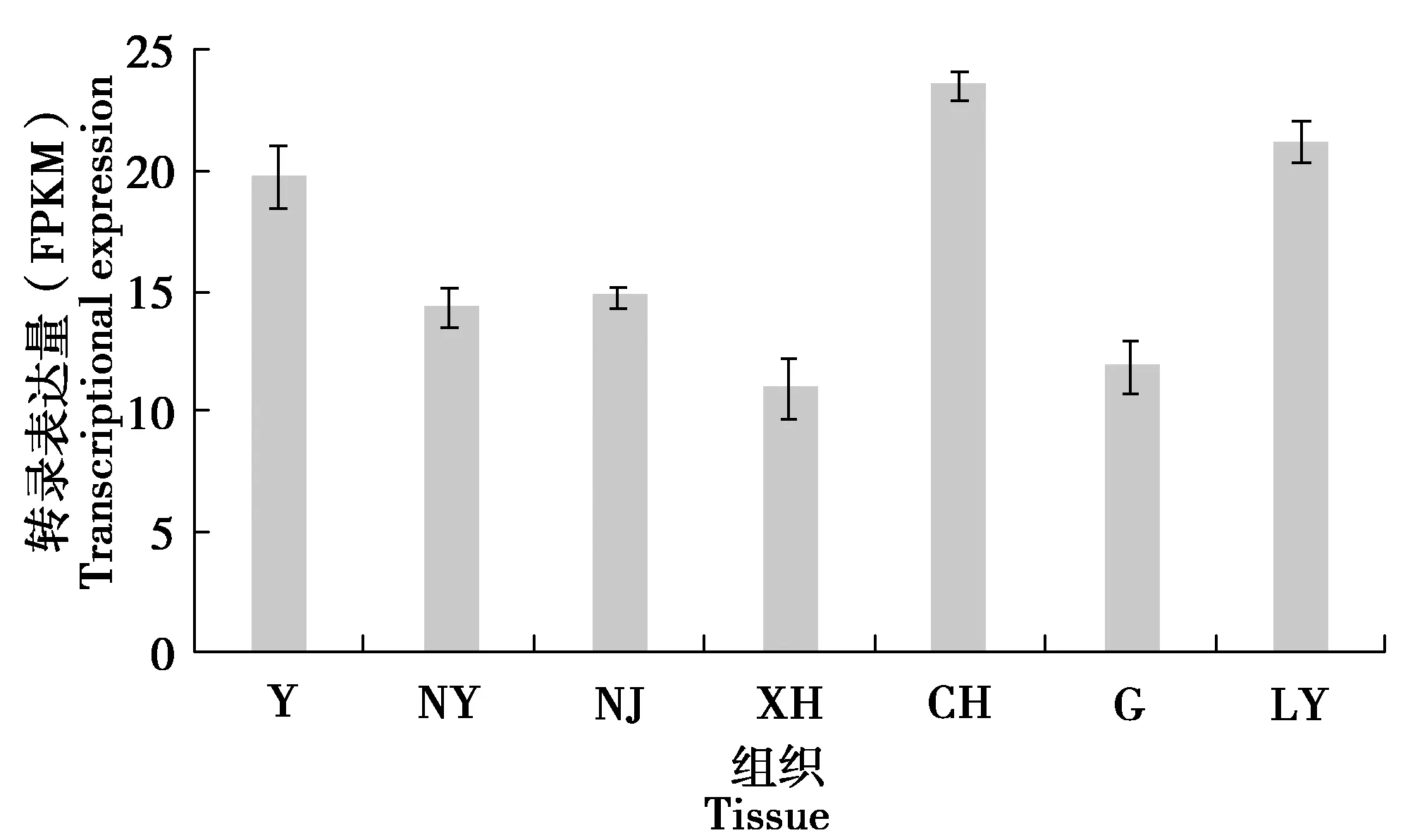
注: Y是芽;NY是嫩叶;NJ是嫩茎;XH是雄花;CH是雌花;G是根;LY是老叶。
由图8可知,JrICE1在“清香”核桃的芽、嫩叶、嫩茎、雄花、雌花、根、老叶中都有表达,其中表达量最高的是雌花,表达量最低的是雄花,其次是老叶、芽、嫩茎、嫩叶和根,暗示了JrICE1可能在雄花器官中起到更加重要的作用。
3 讨论
植物在生长的过程中,往往会受到生物胁迫或者非生物胁迫,严重影响植物的生长发育,植物需要自身抗逆的调节来应对胁迫维持自身正常生长。有研究表明,ICE1基因可以调控冷反应基因,使植物抵御寒冷的逆境环境[6]。本研究通过同源克隆与RNA-Seq结合的方式,在核桃叶片中分离出ICE基因,通过进化分析表明核桃JrICE1与毛果杨(Populustrichocarpa)、甜杨(Populussuaveolens)关系最近。JrICE1在蛋白序列比对表明含有GAQPTLFQKRA这11个保守的氨基酸序列(图5),这与Mohamed[24]等人研究一致。JrICE1具有1 659 bp的完整开放阅读框,且蛋白是一种偏酸性的不稳定亲水蛋白,亚细胞定位于细胞核,这和已研究的其他植物相似[12-13,24]。利用NCBI中的Conserved Domian-Search预测保守结构域,发现该基因包含bHLH结构,并且包含3个功能位点:DNA结合区域、E-box的特异性结合位点以及ACT结构位点,结果表明符合bHLH家族类型特点,并属于核桃ICE基因,证明了基因克隆的准确性。核桃JrICE1与已报道其他典型植物的ICE序列比对,发现JrICE1上游含有富含二硫键的S区(图5-A),主要是维持基因的稳定性[25]。通过NLS区(图5-B)和转膜区(图5-E)保证蛋白转运到细胞核,而且JrICE1含有一个类泛素化(SUMO)结合位点,这与已报道的甜杨[3]、忍冬[12]、火龙果[24]结构相似,研究表明符合核桃ICE1作为转录因子特性。
已有研究报道,在拟南芥[6]、烟草[26]、水稻[27]、番茄[28]中证实了ICE可以正调控植物的抗寒性。在本研究中,将“辽宁8号”(耐低温)和“清香”(不耐低温)低温(0.5 ℃)胁迫48 h后通过叶片转录组测序表明,JrICE1表达呈现显著上升,说明JrICE1在核桃中主要起正调控作用;不同组织转录表达分析表明,JrICE1在叶与花器官中转录表达较高,而且在不同组织中均有表达,说明JrICE1在核桃生长发育中具有重要功能,但具体的调控机制还有待于进一步研究。
4 结论
本研究利用同源克隆与转录组测序技术结合的方法,克隆了核桃中ICE同源基因,并进一步对其进行生物信息分析及转录表达分析。结果表明:JrICE1的 CDS序列全长为1 659 bp,最大开放阅读框1 659 bp,编码552个氨基酸。JrICE1蛋白为不稳定亲水性蛋白,理论等电点5.73。同源比对发现JrICE1蛋白具有bHLH基因家族的典型功能区域,且在bHLH结构域高度保守。通过进化分析表明核桃JrICE1与毛果杨(Populustrichocarpa)、甜杨(Populussuaveolens)关系最近。“辽宁8号”(耐低温)和“清香”(不耐低温)低温胁迫48 h后叶片转录组测序结果分析表明,JrICE1在“辽宁8号”和“清香”叶片中表达均显著上升,说明JrICE1在核桃响应低温胁迫的过程中主要发挥正调控作用。不同组织转录表达分析表明,JrICE1在不同组织中均有表达,在叶与花器官中转录表达水平较高,说明JrICE1在核桃生长发育过程具有重要功能。以上研究说明ICE基因可能在核桃的生长发育特别是应对低温胁迫中起着重要作用。本研究为揭示JrICE1在核桃低温胁迫响应过程中的功能提供参考,为解析核桃低温响应机制,培育核桃耐低温品种奠定基础。

