镉胁迫对蓖麻有机酸含量及镉吸收的影响
王沛琦,胡尊红,胡学礼,刘旭云,杨 谨,李文昌
(云南省农业科学院经济作物研究所,云南昆明650205)
镉(Cd)是毒性最强的重金属之一[1],其具有极高的迁移性和生物可利用性,Cd 在植物体内累积会对其造成极大的毒害,并使作物减产;同时Cd 进入食物链后还会直接危害人类健康[2-3]。许多研究表明,植物产生的有机酸在植物外部排斥Cd 和内部耐受Cd 的机制中起着重要的作用[4-5]。植物体内或根系环境中的有机酸含有1 个或多个羧基,其作为重金属元素的配基,与重金属配位结合,改变重金属的形态,降低重金属的毒性等[6-8]。PINTO 等[9]研究发现,Cd 胁迫下玉米主要产生柠檬酸,高粱主要产生苹果酸,这些有机酸与Cd 发生络合沉淀,变成低毒或无毒的Cd 络合物,减少了Cd 对根系的毒害性,进而提高了植物的耐受机制。秦丽等[10]研究表明,随着Cd 胁迫浓度的增加以及胁迫时间的延长,续断菊根部合成的有机酸总量均呈上升趋势,说明植物可以通过调节根系分泌物来改变根际状态以适应Cd 的胁迫,减轻Cd 对植物的伤害。孙瑞莲等[11]研究认为,叶片中的有机酸含量与其Cd 生物积累量有关,其中,酒石酸、柠檬酸和乙酸可以指示不同生育期龙葵叶片中镉的积累量。可见,Cd 胁迫会刺激植物产生有机酸,与进入植物体内的Cd 进行络合,进而提高植物的抗性。目前,有关蓖麻对重金属Cd 的吸收及Cd 胁迫下蓖麻体内有机酸含量对Cd积累调控的研究相对较少。
本研究以前期筛选出来的耐Cd 蓖麻品种滇蓖2 号为材料,采用盆栽试验,分析了蓖麻根及叶片中草酸、苹果酸、柠檬酸3 种有机酸的含量差异及其与植株中镉积累的关系,以期评价有机酸在蓖麻Cd 积累与解毒过程中的作用,为Cd 污染农田土壤的修复提供依据。
1 材料和方法
1.1 试验材料
供试材料为宿生耐镉蓖麻品种滇蓖2 号,由云南省农业科学院经济作物研究所选育。
试验土壤取自云南省农业科学院老楼耕作层(0~20 cm)的土壤,土壤类型为红壤土,其基本理化性质如表1 所示。

表1 供试土壤理化性质
1.2 试验设计
2019 年在云南省农业科学院经济作物研究所温室进行盆栽试验。每个花盆装风干过筛土20 kg,以分析纯 CdCl2·2.5 H2O 为处理剂,设 6 个 Cd2+质量分数水平,分别为 0(CK)、20、50、100、200、300 mg/kg,共 6 个处理,每个处理 3 个重复,共 18 盆。CdCl2·2.5 H2O 与风干土充分混匀装盆后,静置平衡20 d[11]。选取成熟饱满的蓖麻种子经10%次氯酸钠消毒,用温水浸泡24 h 后,每盆播种6 粒,出苗后每盆定苗3 株,正常水分管理。
1.3 测定项目及方法
1.3.1 生物量测定 Cd 胁迫60 d 后,对蓖麻植株的株高、根长、侧根数、地上部鲜质量、地下部鲜质量进行测定。待其自然阴干后对其干质量进行测定。
1.3.2 体内有机酸测定 Cd 胁迫60 d 后,分别称取去叶脉的新鲜干净叶片和根0.5 g,加入2 mL0.5 mol/L的HCl 研磨成匀浆,于60 ℃水浴中提取l h;匀浆离心后取上清液过滤,定容至50 mL,4 ℃保存。采用外标法测定植物体内与重金属螯合的3 种主要有机酸(草酸、苹果酸、柠檬酸)的含量[12]。HPLC 液相条件:Agilent 1 100 高效液相色谱仪,Kromasil C18 反相色谱柱(250.0 mm×4.6 mm,5.0 μm),流动相为10 mmol/L 磷酸二氢钠(用磷酸调节溶液pH为 2.8),进样量为 10 μL,流速为 0.8 mL/min,柱温25 ℃,走样时间为20 min,紫外波长214 nm。以草酸、苹果酸、柠檬酸为标准样品。
1.3.3 植株重金属Cd 含量测定 Cd 胁迫60 d 后,植物样品(根、茎、叶)在105 ℃下杀青30 min,然后70 ℃烘箱烘干至恒质量,用电子天平分别称量各部分干质量。采用植物粉碎机粉碎样品后过筛,备测。样品采用浓硝酸-高氯酸(V浓硫酸∶V高氯酸=4∶1)的混合液进行微波消解后,定容并过滤,用原子火焰分光光度计对植株Cd 含量进行测定[1]。

式中,C1、C2、C3、C4分别代表蓖麻根部、茎、叶及土壤的 Cd 含量(mg/kg);M1、M2分别代表根部生物量(g)及蓖麻茎叶生物量(g)。
1.4 数据处理
采用Excel 2007 对试验数据进行处理并作图;用SPSS Statistics 19.0 软件对数据进行方差分析和差异显著性检验(Duncan,P<0.05)。
2 结果与分析
2.1 Cd 胁迫对蓖麻植株生长的影响
从表2 可以看出,蓖麻植株的生长随着Cd 胁迫质量分数的增加呈现出先升高后下降的趋势,其中,株高、茎粗、根长、侧根数、根干质量及地上部分干质量在低剂量(20 mg/kg)胁迫下与对照相比均增加,且差异达显著水平(P<0.05);在Cd 质量分数为50 mg/kg 时,株高、茎粗、根长、侧根数、根干质量及地上部分干质量较20 mg/kg 有所下降,但株高、侧根数、根干质量及地上部分干质量与对照相比有一定增加,茎粗、根长较对照相比有所下降,但差异不显著;随着Cd 胁迫质量分数升高各指标逐渐降低,在Cd 质量分数为300 mg/kg 时达到最小值,较CK 分别下降了 68.33%、53.85%、51.73%、91.62%、92.19%及93.00%,与对照相比差异均达显著水平(P<0.05)。综上所述,蓖麻在Cd 胁迫下呈现出低促高抑的现象。
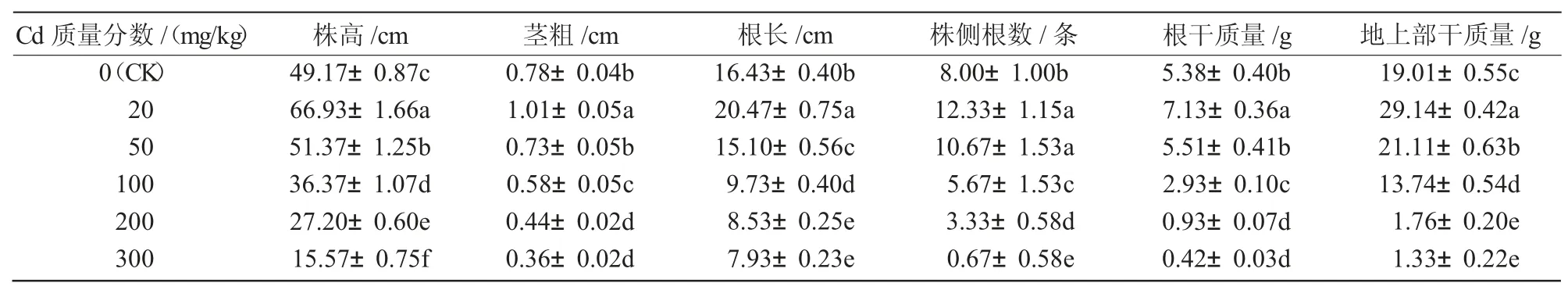
表2 Cd 胁迫对蓖麻植株生长的影响
2.2 蓖麻对Cd 的富集特征
由表3 可知,蓖麻根、茎及叶中Cd 含量随着Cd 质量分数的增加而逐渐增加;在Cd 质量分数为20 mg/kg 时,根、茎及叶中Cd 含量与对照相比差异不显著,当Cd 质量分数为50 mg/kg 及以上时,根、茎及叶中Cd 含量大幅增加,蓖麻各组织富集Cd 的能力并无下降或趋于饱和的状态,且与对照相比呈显著差异(P<0.05)。在Cd 胁迫时,蓖麻各组织Cd含量总体呈现出根>茎>叶。
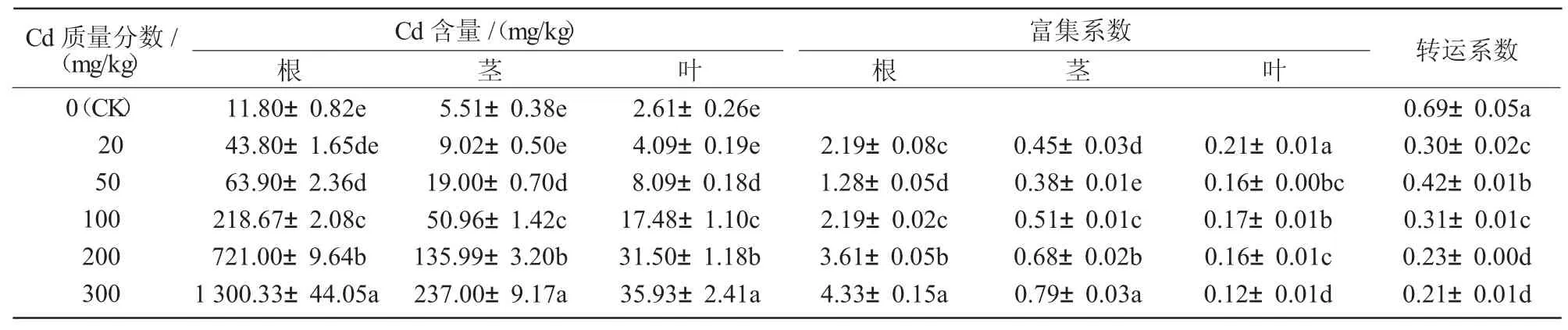
表3 蓖麻对Cd 的富集和转运系数
从富集系数看,不同Cd 质量分数下,蓖麻根对Cd 的富集系数为1.28~4.33,均大于1,当Cd 质量分数为300 mg/kg 时,蓖麻根对Cd 的富集能力最强,当Cd 质量分数为50 mg/kg 时,蓖麻根对Cd 的富集能力最弱;蓖麻茎、叶对Cd 的富集系数均小于1,其中,当 Cd 质量分数为 300 mg/kg 时,蓖麻茎对Cd 的富集能力最强,当Cd 质量分数为50 mg/kg时,蓖麻茎对Cd 的富集能力最弱,当Cd 质量分数为20 mg/kg 时,蓖麻叶对Cd 的富集能力最强,当Cd 质量分数为300 mg/kg 时,蓖麻叶对Cd 的富集能力最弱。从转运系数看,不同浓度下蓖麻对Cd 的转运系数均小于1,说明在较高剂量的Cd 胁迫下,蓖麻由根向茎叶转运镉的能力较弱,蓖麻将大部分Cd 积累在根部,限制Cd 向上转移。
2.3 有机酸含量测定
3 种有机酸混合标样的HPLC 图谱如图1 所示,3 种有机酸待测样品的图谱如图2 所示,3 种低分子量有机酸检出的顺序依次为草酸、苹果酸、柠檬酸。通过外标法建立的线性回归方程为:草酸,y=4.095 1x-16.41(R2=0.999 9),保留时间为3.610 min;苹果酸,y=0.489 4x-0.956 4(R2=0.999 5),保留时间为 5.707 min;柠檬酸,y=0.159 9x+1.533 6(R2=0.999 4),保留时间为11.790 min。

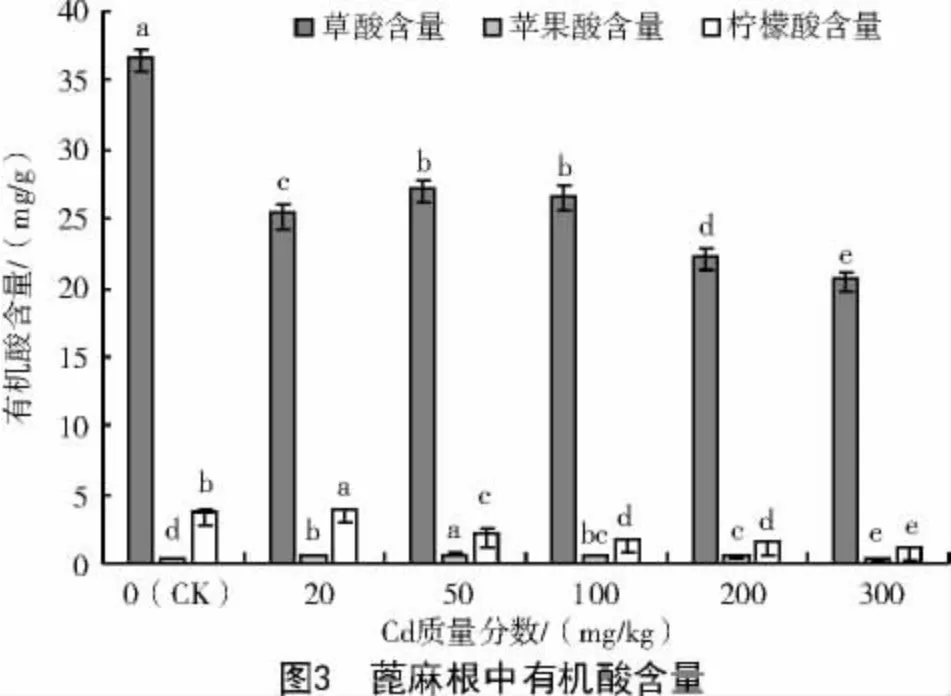
2.4 Cd 胁迫对蓖麻3 种有机酸含量的影响
由图3 可知,随着Cd 质量分数的提高,蓖麻根部3 种有机酸含量变化明显,草酸的含量随着Cd质量分数的升高逐渐降低,当Cd 质量分数达到300 mg/kg 时,草酸含量下降到20.73 mg/g,仅为对照的56.55%。苹果酸、柠檬酸含量随着Cd 质量分数的升高呈现出先增加后降低的趋势,苹果酸在Cd 质量分数为50 mg/kg 时达到最大,为0.69 mg/g,柠檬酸在Cd 质量分数为20 mg/kg 时达到最大,为3.95 mg/g;当 Cd 质量分数达到 300 mg/kg 时,苹果酸、柠檬酸含量均下降到最低,分别为0.34、1.20 mg/g,分别为对照的84.47%和32.18%,柠檬酸的下降幅度大于苹果酸。Cd 处理下,根部有机酸含量大小为草酸>柠檬酸>苹果酸。
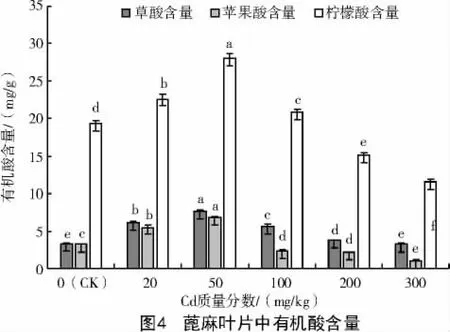
由图4 可知,随着Cd 质量分数的升高,蓖麻叶片中3 种有机酸的含量均呈现出先增加后降低的趋势,在Cd 质量分数为50 mg/kg 时3 种有机酸含量达最大,但上升幅度各不相同,草酸、苹果酸、柠檬酸分别上升到7.59、6.76、28.05 mg/g;当Cd 质量分数达到300 mg/kg 时,草酸、苹果酸、柠檬酸含量均下降到最低,分别为3.22、1.02、11.48 mg/g,分别为对照的97.57%、32.36%和59.53%,苹果酸的下降幅度最大,其次是柠檬酸,且二者与对照间呈显著差异,草酸下降幅度最小,与对照间差异不显著。Cd 处理下,叶片有机酸含量大小为柠檬酸>草酸>苹果酸。
2.5 蓖麻体内Cd 含量与3 种有机酸含量的相关性分析
植物体内有机酸主要是光合作用及呼吸作用的中间产物,受植物生长状况的影响,有机酸在植物体内重金属的积累中发挥了较大作用[5]。本研究中,3 种有机酸在Cd 质量分数为100 mg/kg 时均表现出下降的趋势,故以Cd 剂量为100 mg/kg 为分界点,对蓖麻体内Cd 含量与3 种有机酸含量的相关性进行分析。
从表4 可以看出,蓖麻3 种有机酸含量与不同器官的镉含量之间存在显著的相关性;当Cd 质量分数<100 mg/kg 时,草酸与柠檬酸含量与根、茎、叶中Cd 含量呈显著负相关,苹果酸含量与根、茎、叶中Cd 含量呈显著正相关。
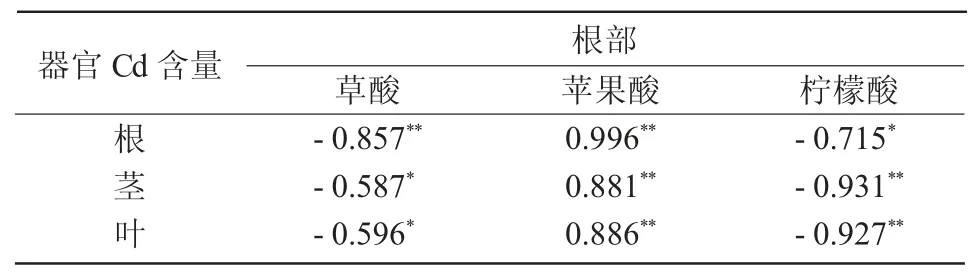
表4 Cd 质量分数 <100 mg/kg 时蓖麻体内Cd 含量与根部有机酸含量的相关性
从表5 可以看出,当Cd 质量分数≥100 mg/kg时,草酸、柠檬酸及苹果酸含量与根、茎、叶中Cd 含量呈极显著负相关。
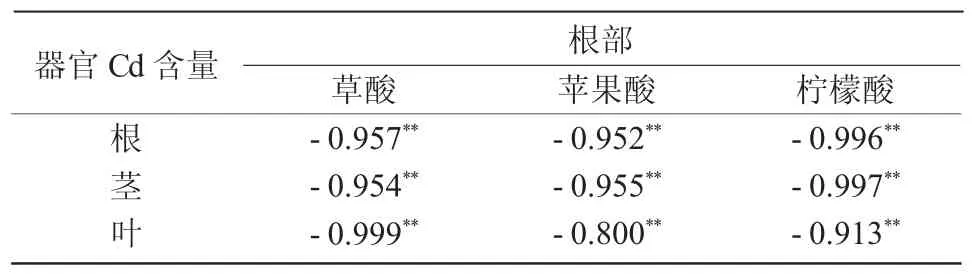
表5 Cd 质量分数≥100 mg/kg 时蓖麻体内Cd 含量与根部有机酸含量的相关性
蓖麻根、茎、叶Cd 含量与叶片有机酸含量的相关性如表6、7 所示。当Cd 质量分数<100 mg/kg 时,草酸、苹果酸与柠檬酸的含量与根、茎、叶中Cd 含量为极显著正相关,其中,草酸与苹果酸与根中Cd含量的相关系数最大,为0.999,柠檬酸与茎及叶中Cd 含量的相关系数最大,分别为0.990、0.992(表6);当 Cd 质量分数≥ 100 mg/kg 时,叶片中草酸、柠檬酸及苹果酸含量与根、茎、叶中Cd 含量均呈显著负相关(表 7)。
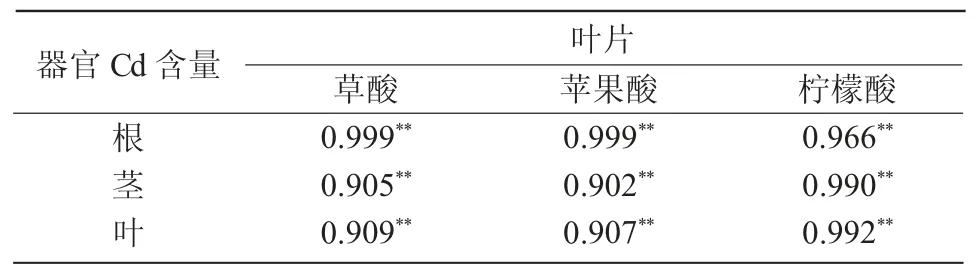
表6 Cd 质量分数<100 mg/kg 时蓖麻体内Cd 含量与叶片有机酸含量的相关性
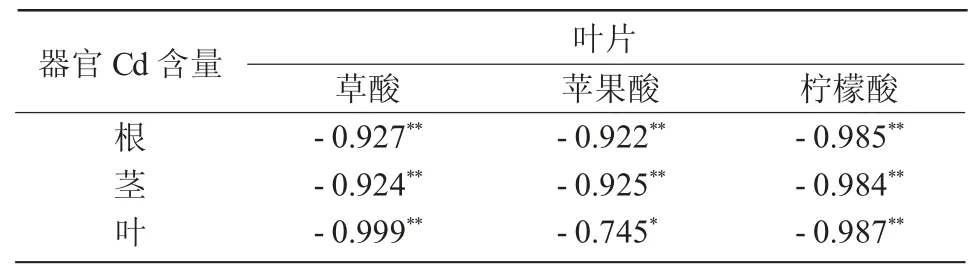
表7 Cd 质量分数≥100 mg/kg 时蓖麻体内Cd 含量与叶片有机酸含量的相关性
3 结论与讨论
重金属对植物具有强的毒害作用,其中,植物农艺性状、生物量等可作为评价植物对重金属逆境胁迫耐性最直观的指标[13]。景俏丽等[14]研究表明,低浓度Cd 可以促进植物生长,高浓度Cd 会抑制植物生长。本研究发现,蓖麻幼苗在低质量分数(20、50 mg/kg)Cd 胁迫下,植株生长正常,且株高、侧根数、根干质量及地上部分干质量较对照略有增加;随着Cd 质量分数的升高,各指标较对照有所下降,当Cd 质量分数达到300 mg/kg 时,植株各农艺性状较对照显著降低,叶片发黄,根部有黑点,生长受到抑制,但是没有致死,说明蓖麻耐镉能力较强。
富集和转运系数是衡量植物对重金属积累能力的一项重要指标[15]。本研究表明,蓖麻根对不同质量分数Cd 的富集系数均大于1,茎叶对Cd 的富集系数均小于1,转移系数均小于1,说明蓖麻对Cd 由根部向地上部分转运能力较弱,将大部分Cd积累在根部,以此来减少Cd 对蓖麻植株的毒害,这可能是蓖麻对Cd 有很强的耐性的原因之一[16]。
在重金属污染下,进入植物体内的重金属可以与储存在液泡中的有机酸络合,形成低毒的络合物,从而增强植物的耐性,对植物抵抗重金属毒害起重要作用[17-20]。许多研究表明,植物体内及植物根际与重金属螯合的主要有机酸是草酸、苹果酸和柠檬酸[21-22]。本研究对Cd 胁迫下蓖麻叶片及根系中的草酸、苹果酸和柠檬酸的含量进行测定,结果发现,不同胁迫下有机酸含量存在差异,蓖麻叶片中有机酸含量大小为柠檬酸>草酸>苹果酸,随着Cd 质量分数的提高,3 种有机酸的含量呈现出先增加后降低的趋势,在Cd 质量分数为50 mg/kg 时3 种有机酸含量均达最大值,这与孙瑞莲等[11]对Cd 超积累植物龙葵的研究结果相一致;蓖麻根部有机酸含量大小为草酸>柠檬酸>苹果酸,其中,草酸的含量随着Cd 质量分数的升高逐渐降低,苹果酸、柠檬酸含量随着Cd 质量分数的升高呈现出先增加后降低的趋势。虽然Cd 胁迫对蓖麻根内草酸含量有抑制作用,但草酸含量明显高于柠檬酸和苹果酸,蓖麻叶片中柠檬酸含量最高,说明草酸和柠檬酸可能在蓖麻对Cd 富集和抗性中起主要作用。当Cd 质量分数小于100 mg/kg 时,根系含有的苹果酸,叶片含有的草酸、苹果酸和柠檬酸与蓖麻体内Cd 含量呈正相关;大于100 mg/kg 时根及叶片中3 种有机酸与蓖麻体内Cd 含量均呈负相关,说明低剂量Cd 胁迫下,蓖麻根中的苹果酸及叶片中的草酸、苹果酸与柠檬酸的积累增强有助于根、茎叶中镉的富集,而在高质量分数Cd 胁迫下蓖麻体内Cd 抑制了有机酸的合成。本研究仅对Cd 胁迫下蓖麻体内Cd 含量及根、叶的有机酸含量进行了研究,对蓖麻体内积累的草酸、苹果酸及柠檬酸能否通过根系分泌作用活化环境中的镉,并促进Cd 从根部转运到茎部,还有待进一步研究。

