TNF-α、IL-1β、IL-6、IL-10联合检测在儿童传染性单核细胞增多症中的诊断价值
温大科,李天宇
无锡市儿童医院血液科,江苏无锡 214000
传染性单核细胞增多症(IM)患儿的免疫因子表达可能发生异常[1-2]。IM作为以发热起病的感染性疾病,免疫因子并非其特异性诊断因素,容易与其他感染性疾病混淆[3]。肿瘤坏死因子α(TNF-α)由巨噬细胞释放,在感染性疾病中TNF-α水平可能出现异常;白细胞介素(IL)由白细胞释放,在感染性疾病发病过程中起着传递抗原信息的作用[4-6]。本研究旨在进一步明确IM与TNF-α、IL的关系,探讨上述指标联合应用对IM的诊断价值。
1 资料与方法
1.1一般资料 选择2017年12月至2019年12月于本院确诊为IM的患儿47例纳入IM组,另选择同期就诊的非IM发热患儿50例作为非IM发热组。纳入标准:(1)IM组患儿符合《诸福棠实用儿科学(第8版)》中IM的诊断标准,且为首次诊断[1];(2)非IM发热组患儿均明确诊断为上呼吸道感染,符合《急性上呼吸道感染基层诊疗指南2018版》标准[7];(3)腋温≥37.3 ℃;(4)年龄3~12岁;(5)患儿监护人签署知情同意书。排除标准:(1)血液系统恶性疾病;(2)先天性缺陷或发育异常;(3)半月内抗菌药物或免疫抑制剂使用史;(4)器官功能明显异常;(5)热程(发热天数)超过3 d。
1.2方法 所有患儿均行EB病毒抗体(包括CA-IgM、CA-IgG及NA-IgG)检测。
1.2.1TNF-α、IL-1β、IL-6及IL-10水平检测 抽取患儿空腹静脉血后分离上清液,使用上海酶联生物科技有限公司提供的相关酶联免疫吸附测定(ELISA)试剂盒(双抗夹心法)对血清TNF-α、IL-1β、IL-6及IL-10水平进行检测,并采用酶标仪对结果进行定量,具体方法如下。将所有试剂充分混匀,注意轻拿轻放,同时缓慢混匀,避免气泡产生导致取样误差。标本用标本稀释液1∶1稀释后加50 μL于反应孔内建立标本孔,并将等量的稀释液加入其他反应孔作为空白孔。立即加入50 μL的生物素标记的抗体。盖上膜板,轻轻振荡混匀,37 ℃温育1 h。甩去孔内液体,每孔加满洗涤液,振荡30 s,弃去洗涤液,用吸水纸拍干。重复此操作3次后每孔加入80 μL的亲和链酶素-辣根过氧化物酶(HRP),轻轻振荡混匀,37 ℃温育30 min。而后每孔加入底物A、B各50 μL,轻轻振荡混匀,于37 ℃温育10 min,孵育过程中避免光照。取出酶标板,迅速加入50 μL终止液,使用上海谱原仪器有限公司提供的Alpha1500型分光光度计在450 nm波长处测定各孔的吸光度(A)值。以A值为纵坐标(Y),相应的待测物质标准品浓度为横坐标(X),绘制相应的曲线,样品中待测物质含量可根据其A值由标准曲线换算出。试剂盒性能:(1)敏感度,最小的检测浓度小于1号标准品,样品线性回归与预期浓度相关系数(R)值为0.990。(2)特异度,不与其他细胞因子反应。(3)重复性,板内、板间变异系数均小于10%。
1.2.2临床资料及实验室检查结果收集 收集患儿临床资料,包括年龄、性别、出生体质量、热程、1年内抗菌药物使用次数、临床症状,以及实验室检查结果,包括白细胞计数(WBC)、中性粒细胞计数(Neu)、淋巴细胞计数(Lym)、异型淋巴细胞占比、C反应蛋白、降钙素原。
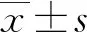
2 结 果
2.1两组患儿临床资料及实验室检查结果比较 IM组患儿肝大及脾大占比、Neu、Lym、异型淋巴细胞占比,以及TNF-α、IL-1β、IL-6、IL-10水平均显著高于非IM发热组,差异均有统计学意义(P<0.05),见表1。
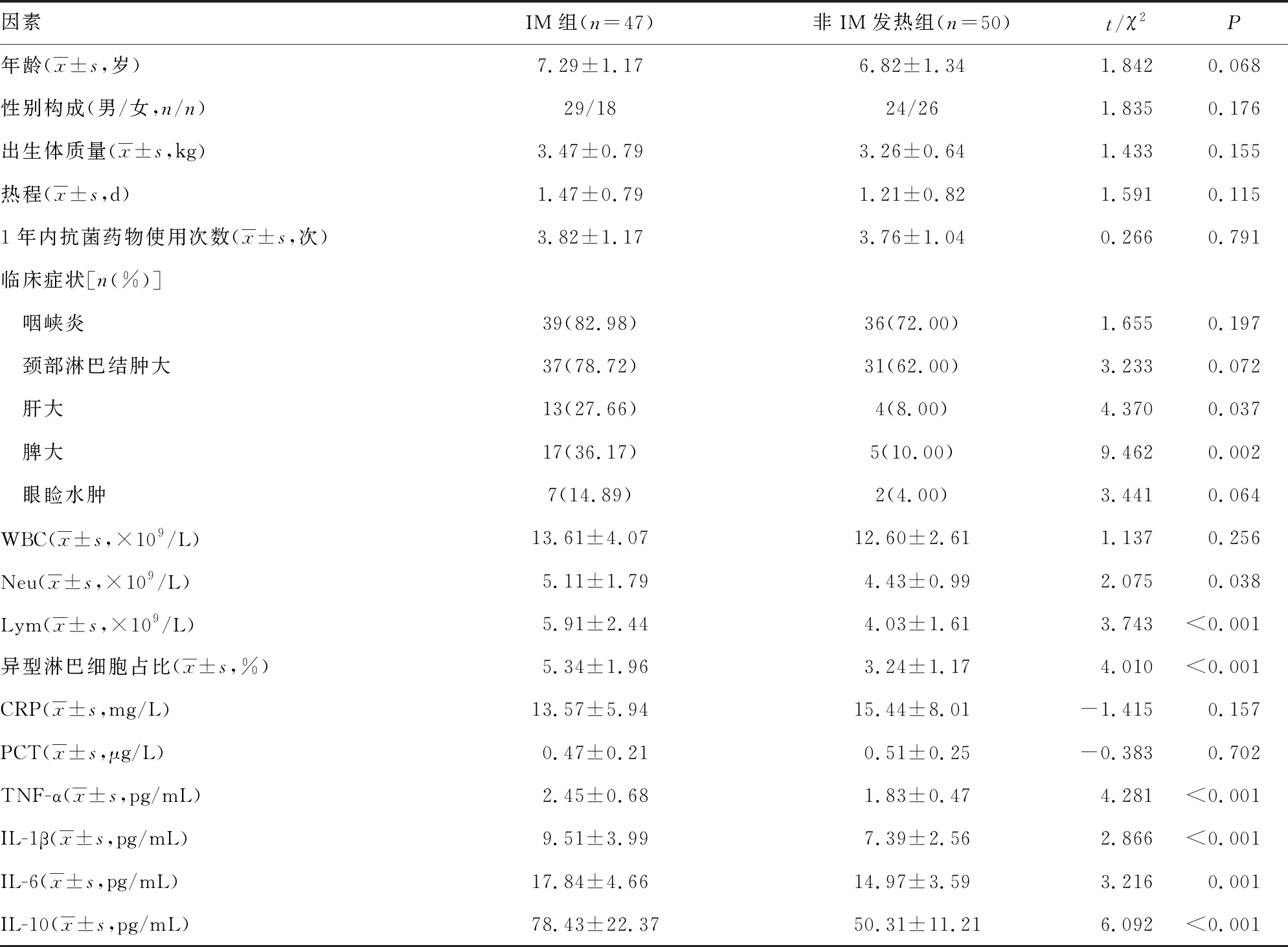
表1 两组患儿临床资料及实验室检查结果比较
2.2IM相关指标的Logistic回归分析 根据单因素分析结果,将IM患病作为因变量(1=是,0=否);将肝大(1=是,0=否)及脾大(1=是,0=否)、Neu(实测值)、Lym(实测值)、异型淋巴细胞占比(实测值)、TNF-α(实测值)、IL-1β(实测值)、IL-6(实测值)及IL-10(实测值)作为自变量进行二元Logistic回归分析,结果显示,肝大(OR=35.128,95%CI:4.467~127.556)、异性淋巴细胞占比(OR=1.277,95%CI:1.021~1.476)、TNF-α(OR=15.991,95%CI:5.476~369.052)、IL-1β(OR=2.015,95%CI:1.095~3.706)、IL-6(OR=2.853,95%CI:1.398~5.822)及IL-10(OR=1.221,95%CI:1.083~1.377)为IM的危险因素(P<0.05),见表2。
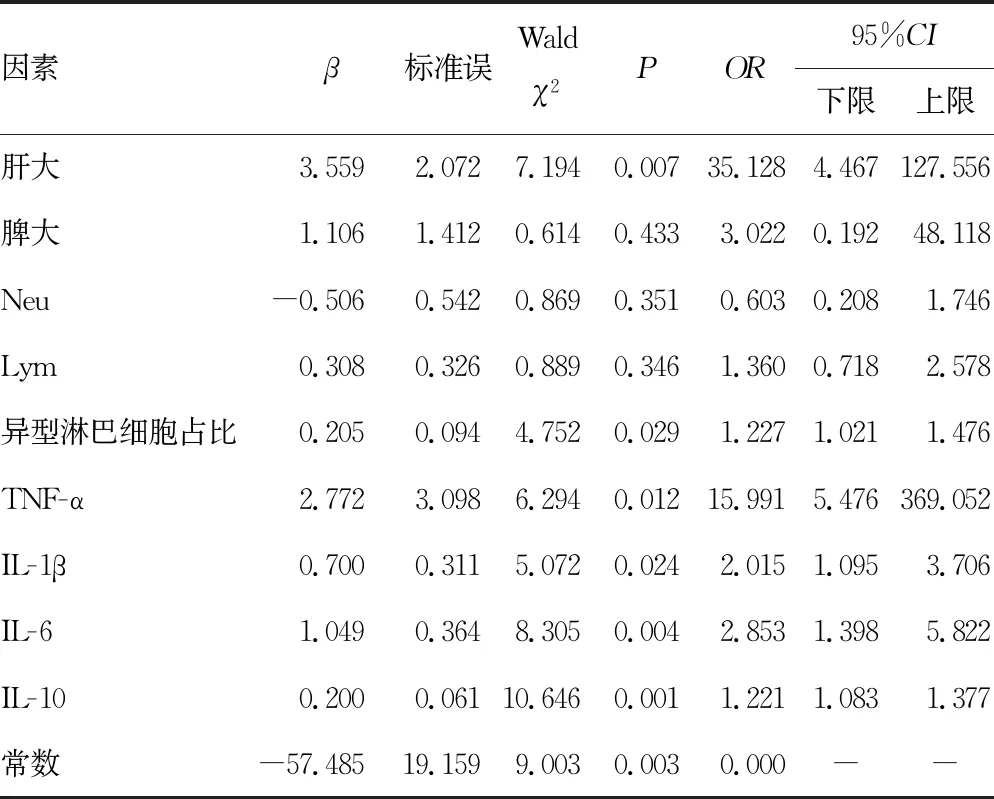
表2 IM相关指标的Logistic回归分析
2.3基于TNF-α、IL-1β、IL-6、IL-10水平的预测模型的构建与验证 根据多因素Logistic分析结果,构建基于TNF-α、IL-1β、IL-6、IL-10水平的预测列线图,见图1。列线图预测IM的C指数为0.922(95%CI:0.871~0.963)。内部验证显示,列线图模型预测IM与实际可能性绝对误差为0.009,一致性良好,见图2。
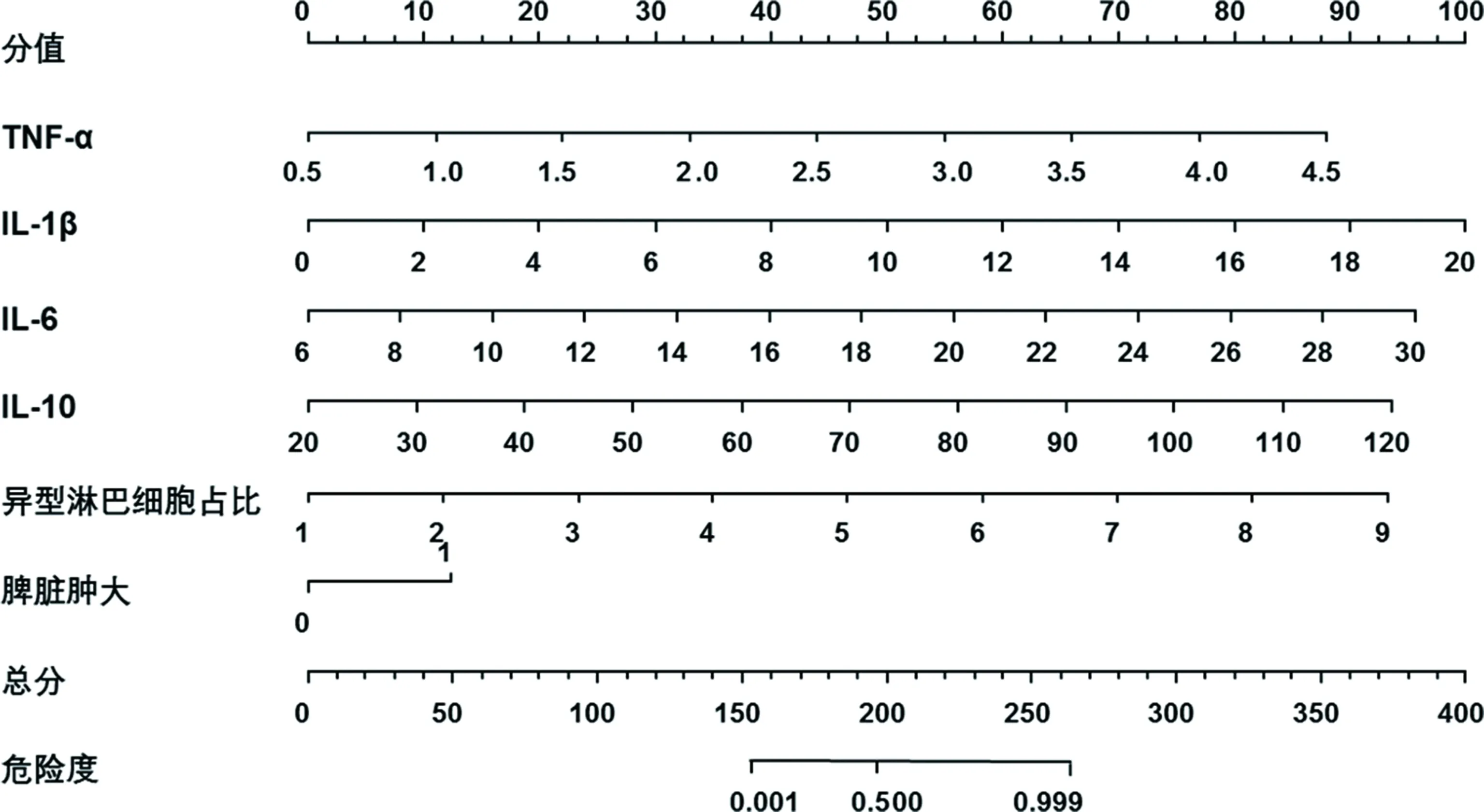
图1 基于TNF-α、IL-1β、IL-6、IL-10水平预测IM的列线图

图2 基于TNF-α、IL-1β、IL-6、IL-10水平预测IM模型的内部验证
3 讨 论
国内IM发病人群主要集中于学龄及学龄前儿童,IM是一类自限性疾病,患儿症状会在一定时间后消失,但在SENJO等[8]的研究中,少部分临床治愈后的患儿淋巴组织内仍有少量EB病毒残留,而此类残留病毒会诱发小儿恶性肿瘤疾病。通过早期确诊并采取积极的治疗手段能尽可能地在病毒复制早期进行遏制,并减少治愈后的病毒残留量。目前,根据《诸福棠儿科学(第八版)》中的描述,通过症状及相关抗原的检测能对IM进行有效诊断,但大部分发热患儿首诊的乡村卫生院及社区医院等基层医疗机构开展相关抗原检测的难度大。本课题组在前期的研究中,针对EB病毒所致的IM诱发的单核-巨噬细胞系统增生的特点,结合国内外多个研究[9-10],筛选出了TNF-α、IL-1β、IL-6及IL-10对IM进行联合诊断,效果显著。
本研究中,单因素分析结果显示,IM组患儿较非IM发热组患儿肝大、脾大占比,以及Neu、Lym、异型淋巴细胞占比升高明显。IM患儿的诊断标准中肝大是其中重要的一项标准,而刘立飞等[11]的研究中,IM患儿肝大、脾大占比高达62.1%及80.6%,显著高于本次研究中的27.6%及78.7%,原因在于本研究主要针对早期发热的IM患儿,纳入患儿热程均<3 d,而该研究中患儿热程在7~10 d,由于此时间段内肝、脾二器官受到病毒感染的影响时间长,其所致的免疫功能异常亢进更严重,故肝大、脾大更明显。而咽峡炎及颈部淋巴结肿大在细菌或其他病毒所致的上呼吸道感染中也属较为常见的症状,并非IM患儿的特异性表现,故这些症状仅为IM诊断参考标准中的一项。IM患儿的Neu、Lym及异型淋巴细胞占比明显升高则是由于EB病毒引起的单核-巨噬细胞系统异常激活所致,这点也已经在国内外多个研究中得到证实[12-13]。TNF-α是由巨噬细胞释放的肿瘤细胞杀伤因子,IM患者由于EB病毒感染导致巨噬细胞增生,故TNF-α水平亦会明显增加。在肖楠阳等[14]的研究中,EB病毒感染患儿外周血单个核细胞(PBMC)内多个Toll受体蛋白及TNF-α mRNA均呈高表达状态,而该研究还指出Toll受体蛋白是前炎性细胞因子基因激活的重要影响因素,说明EB病毒可导致PBMC内TRL激活,从而诱导TNF-α大量释放,本研究中IM患儿的血清TNF-α水平显著上升,与该研究结论一致。IL-1β、IL-6及IL-10均为IL家族成员,既往研究显示,上述3种因子由T淋巴细胞释放,IL-1β、IL-6具有促炎作用,而IL-10则具有抗炎作用,当EB病毒进入体内后,通常由巨噬细胞吞噬并将抗原信号呈递至T细胞,从而诱导免疫反应的发生[15-16]。在GERBER-MORA等[17]的研究中,EB病毒感染后患儿体内CD4+CD8+调节性T细胞(Tr细胞)比例显著上升,从而导致该细胞分泌的IL-10及IL-6水平显著增加。同时文献[14]报道,EB病毒激活TRL受体后亦会导致PBMC内的IL-1β mRNA水平显著增加,从而导致体内上述因子水平增加,本研究也得到了类似结果。
回归分析结果显示,脾大、Neu、Lym与IM发病无相关性,笔者认为有以下几点原因:(1)大规模流行病学调查结果显示,近年来小儿上呼吸道感染中病毒感染的占比显著增加,而巨细胞病毒、甲型流感病毒在某些特定条件下亦会诱发脾大,故脾大非EB病毒感染的特异性症状[18];(2)在文献[11]的研究中,患儿症状与年龄相关,部分年龄较小的患儿症状不典型;(3)发热患儿多伴有病原体感染,而此类患儿Neu及Lym通常情况下会上升,加之病程较短,故上述2个指标差异不显著;(4)本次研究为单中心小样本量研究,结果可能存在偏倚。
列线图是一种图形工具模型,最初设计用于无需计算机或计算器即可快速地进行近似复杂的计算,通过将不同指标按其权重形成量化的预测分值,列线图在提高单项指标诊断准确性的基础上,具有简便的界面和实用性,目前已被广泛应用于疾病诊断及预后预测中[19-21]。本研究对基于TNF-α、IL-1β、IL-6及IL-10水平的列线图分析结果显示,C指数为0.922,提示该模型对于IM的预测价值较好。
综上所述,TNF-α、IL-1β、IL-6及IL-10联合检测可以有效提升IM患儿的诊断效能,且ELISA检测上述指标的可行性较好,可以应用于基层医院发热患儿IM的早期诊断中。

