生育期干旱-复水对夏玉米生化指标的影响
赵 龙,蔡焕杰,曹玉鑫
(1.西北农林科技大学水利与建筑工程学院,陕西杨凌712100;2.西北农林科技大学中国旱区农业节水研究院,陕西杨凌712100;3.西北农林科技大学旱区农业水土工程教育部重点实验室,陕西杨凌712100)
0 引言
全球变暖加剧了目前干旱发生的频率和程度,粮食生产已经受到了严重威胁[1]。已有研究表明,水分胁迫会抑制作物的生长,降低作物产量[2]。玉米是需水量大、对水分胁迫敏感的粮食作物,然而干旱导致玉米每年减产20%~30%[3,4]。中国西北部地处内陆,气候干燥,有大面积的干旱和半干旱地区[5]。玉米是我国西北地区的主要粮食作物之一,该地区玉米产量也一直受限于水资源匮乏问题[4,6,7]。因此,培育高抗性玉米品种是应对干旱胁迫最有效,也是最重要的途径[8]。所以了解玉米对干旱胁迫的生理响应机制是抗旱育种的重要前提[9-11]。
干旱胁迫对作物的生成会产生一定的危害,然而干旱后恢复至正常水平灌溉后会使植物产生补偿甚至超补偿效应,并且大量研究证明,适度的干旱胁迫后复水作物所产生的补偿效应可以使作物的产量或品质得以提高[12]。干旱胁迫打破了植物体内活性氧产生和清除之间的平衡[13],为了清除因外界胁迫大量累积的活性氧,植物体内的抗氧化酶活性增加,抗氧化物质合成增多[14],从而减轻胁迫对细胞膜造成的伤害,起到对植物的保护作用[15]。这种保护可以有效减小细胞的氧化损伤,使得恢复正常灌溉水平后植物能够迅速得以恢复[16]。
已有对作物干旱-复水这一过程的研究主要集中于不同灌溉水平对作物产量和水分利用效率的影响,本研究对夏玉米苗期和拔节期进行不同灌水水平和不同胁迫时长的干旱-复水处理,通过5 个生化指标[丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)]的变化响应进行研究分析,探究夏玉米保护酶系统对干旱-复水处理的响应机制,从而找出对夏玉米产量较有利的干旱胁迫方案,以期对夏玉米的高效节水灌溉提供理论支持。
1 材料与方法
1.1 材 料
试验对象为夏玉米,所用品种“吉祥1号”是当地农民普遍使用的品种,该品种根系发达,叶片多且上举。本次试验玉米生长期为2019年6月16日至2019年9月22日,共计98 d。桶栽种植玉米用土的土壤类型为中壤土,沙和黏粒含量占比大致相同,具有一定可塑性,土壤偏弱碱性。田间持水量为24%(重量含水率),土壤干容重为1.33 g/cm3。按200 kg/hm2的施氮量、100 kg/hm2的施磷量,换算出每桶施基肥尿素2.37 g,磷酸二铵4.75 g[17],于2019年8月4日追肥尿素3 g。试验用桶栽的方式种植玉米,采用30 cm×30 cm×40 cm(0.036 m3)的试验方桶。
1.2 试验区概况
试验地点地处东经108°04',北纬34°18',海拔521 m 的西北农林科技大学中国旱区节水农业研究院,所有试验方桶均放置于遮雨棚下。
1.3 指标测定
丙二醛含量用硫代巴比妥酸反应比色法测定;NBT 光化学还原法测定超氧化物歧化酶活性;愈创木酚法测定过氧化物酶活性;紫外分光光度法测定过氧化氢酶活性和还原性谷胱甘肽含量。
1.4 试验方法
本试验研究将桶栽夏玉米的其中2个生长阶段进行试验处理,分别是夏玉米的苗期(M)和拔节期(B)。设有3个水分处理,其中,对照组(CK):75%~85%θf(θf表示为田间持水量);轻度干旱胁迫(W1):65%~75%θf;中度干旱胁迫(W2):55%~65%θf;重度干旱胁迫(W3):45%~55%θf。并设置3 个胁迫时长处理,分别是5 d(T1)、10 d(T2)、15 d(T3),具体处理方案见表1。控水方法为称重法。共计16 个处理,CK 对照处理组设置5 个重复,苗期处理设置4 个重复,拔节期处理设置3 个重复,共计种植夏玉米59 桶。由于CK 对照组在整个试验期间均需取样,苗期夏玉米的叶片数量较少,故多设置了试验重复桶。试验期间于胁迫期间每5 d 取3 次样,复水后10 d 内再取3 次样,均在浇水前取样;其余生育期灌水制度均与CK 对照处理相同。试验处理期间每天称一次桶重,称重后进行浇水,时间为每天下午6∶00。
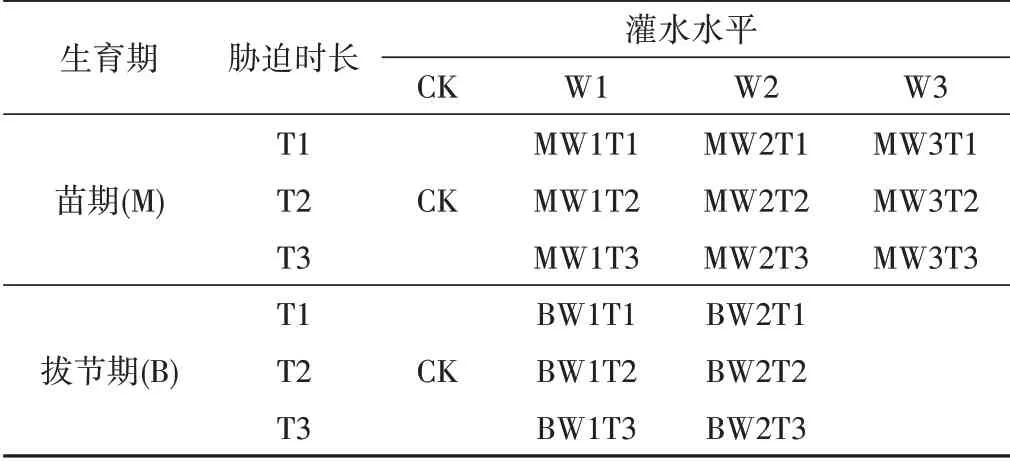
表1 试验设计Tab.1 Experimental design
1.5 数据统计
采用Origin 进行绘图,采用SPSS 26.0 对试验数据进行统计分析。
2 结果与分析
2.1 干旱胁迫-复水对夏玉米丙二醛(MDA)含量的影响
植物在受到外界环境胁迫时,抵抗胁迫的过程中会生成丙二醛(MDA),植物细胞膜系统在经受胁迫时会有过氧化反应,而MDA 含量的高低可以判断过氧化的程度,因此它可以反应植物在胁迫条件下损伤的程度[18]。由图1 可知,在夏玉米苗期期间,各试验组在进行胁迫处理期间,随着胁迫时长的增长,干旱程度由轻度到重度的加剧,MDA 累积量逐渐增多,每组试验均在胁迫的最后一天均达到峰值。MW1T1、MW2T1和MW3T1 处理在胁迫第5 天MDA 含量分别为CK 对照处理的1.54 倍、1.58 倍、1.66 倍[见图1(a)];MW1T2、MW2T2 和MW3T2 处理在胁迫第10 天MDA 含量分别为CK 对照处理的1.67 倍、1.69 倍和1.71 倍[见图1(b)];MW1T3、MW2T3 和MW3T3 处理在胁迫第15 天MDA 含量分别为CK 对照处理的2.12 倍、2.20 倍和2.43 倍[见图1(c)]。在进行复水后,胁迫程度得到缓解,MDA 含量立即降低趋向于CK 对照处理水平,MW1T1、MW2T1和MW3T1处理在复水后第7天出现明显补偿效应,MDA 含量分别为CK 对照处理的0.60 倍、0.71 倍和0.76倍;MW1T2 和MW2T2 处理在复水第2 天出现了补偿效应,MDA 含量分别为CK 对照处理的0.73 倍和0.88 倍,MW3T2 处理复水2 d 后出现了补偿效应,复水第10 天补偿效应最为明显,MDA含量为CK对照处理的0.68倍;胁迫时长为15 d的处理组复水后未出现明显补偿效应。在水分胁迫处理期间,各试验组的MDA 含量随胁迫时长增长均呈递增趋势,中度水分胁迫和重度水分胁迫的MDA 含量峰值相近且均高于轻度水分胁迫,说明干旱胁迫程度的不断加重,夏玉米苗期细胞内的活性氧含量也随之增大,细胞膜过氧化作用加强,MDA 累积量也随之增多。
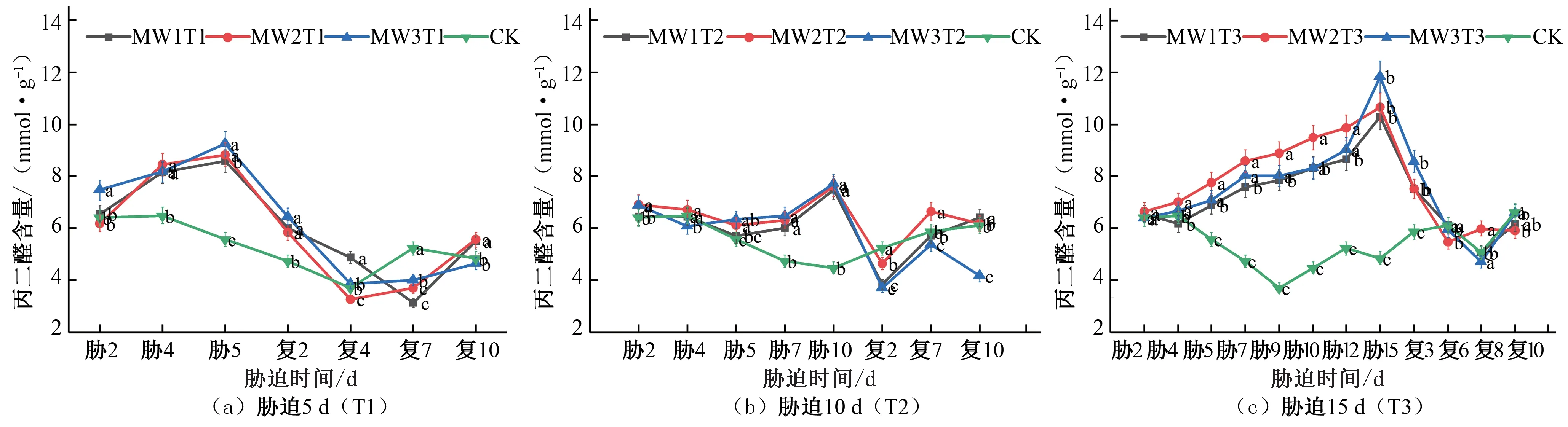
图1 夏玉米苗期丙二醛(MDA)含量于干旱胁迫-复水处理下的变化Fig.1 Changes of MDA content in summer maize seedlings under drought stress and rehydration treatment
拔节期的MDA 变化趋势与苗期相同,均随着胁迫持续时间的延长,干旱胁迫程度的加剧,MDA 累积量变大,每组试验均在胁迫的最后一天均达到峰值。BW1T1 和BW2T1 处理在胁迫末期MDA 含量分别为CK 对照处理的1.98 倍和2.09 倍[见图2(a)];BW1T2 和BW2T2 处理在胁迫末期MDA 含量分别为CK 对照处理的2.15 倍和2.34 倍[见图2(b)];BW1T3 和BW2T3处理在胁迫末期MDA 含量分别为CK对照处理的2.25倍和2.50倍[见图2(c)]。在不同的水分胁迫处理下,中度水分胁迫处理相较于轻度胁迫处理,其MDA 积累量更大,细胞膜的过氧化程度更为明显。在进行了复水处理之后,各试验组MDA 含量随着胁迫程度缓解降低,趋向于CK 对照处理水平。BW1T1处理在复水后未出现明显补偿效应,BW2T1 处理在复水后第5天出现了明显的补偿效应,MDA 含量为CK 对照处理的0.73倍;BW1T2 和BW2T2 处理在复水后第7 天时出现补偿效应,MDA 含量分别为CK 对照处理的0.70 倍和0.82 倍;BW1T3 处理在复水后第10 天出现了明显的补偿效应,MDA 含量为CK对照处理的0.81 倍,BW2T3 处理在复水后未出现明显补偿效应。
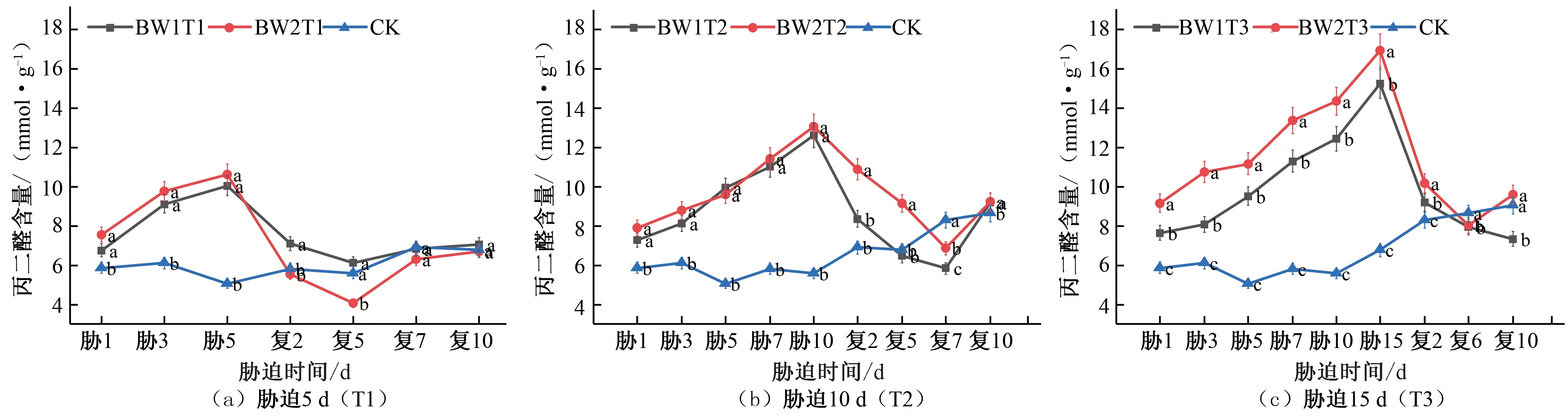
图2 夏玉米拔节期丙二醛(MDA)含量于干旱胁迫-复水处理下的变化Fig.2 Changes of MDA content in summer maize at jointing stage under drought stress and rehydration treatment
综合夏玉米苗期和拔节期不同灌溉水平下MDA 含量的变化,结果表明作物在受到水分胁迫时,由于累积大量活性氧自由基不能及时被清除,细胞膜的结构受到了损伤,MDA 含量也随之升高,重度水分胁迫处理的MDA 含量与中度水分胁迫相近,中度水分胁迫处理的MDA 含量高于轻度水分胁迫;随着胁迫持续时间越长,各试验组MDA 含量越高。这与郭效龙等人的研究结论相一致[19,20]。在夏玉米苗期MDA 的最高含量达到11.82 mmol/g,拔节期MDA 的最高含量达到16.96 mmol/g,所以夏玉米拔节期的抗旱能力高于苗期的抗旱能力。复水后胁迫缓解,所有处理组的MDA含量均逐渐恢复至CK对照处理。
2.2 干旱胁迫-复水对夏玉米超氧化物歧化酶(SOD)活性的影响
植物抗氧化系统中,超氧化物歧化酶(SOD)作为第1 道防线,它的功能是加速超氧物阴离子自由基进行氧化还原反应,产生过氧化氢以及氧气[21]。由图3 可知,在夏玉米苗期,胁迫期间所有试验组的SOD 活性的变化趋势均为先增大后减小,胁迫5 d的处理组在胁迫第4天时达到峰值,相较于CK对照处理MW1T1、MW2T1、MW3T1 的SOD 活性分别提高76.87%、49.58%、46.62%[见图3(a)];胁迫10 d 的处理组在胁迫第5 天达到峰值,相较于CK 对照MW1T2、MW2T2、MW3T2 的SOD活性处理分别提高13.19%、26.33%、48.45%[见图3(b)];胁迫15 d 的处理组在胁迫第7 天达到峰值,相较于CK 对照处理MW1T3、MW2T3、MW3T3 的SOD 活性分别提高25.50%、30.95%、33.96%[见图3(c)]。各试验组均在胁迫处理的末期SOD 活性降到最低点,复水处理后,SOD 活性先增大后减小,各试验组均出现了一定的补偿效应,胁迫5 d 的试验组均于复水第2 天SOD 活性达到峰值,相较于CK 对照处理MW1T1、MW2T1、MW3T1 的SOD 活性分别提高7.38%、14.87%、26.25%[见图3(a)];胁迫10 d 的试验组均于复水第4 天SOD 活性达到峰值,相较于CK 对照MW1T2、MW2T2、MW3T2 的SOD 活性处理分别提高63.06%、41.02%、39.51%[见图3(b)];胁迫15 d 的试验组MW1T3 于复水第3 天达到峰值,MW2T3 于复水第6天达到峰值,MW3T3于复水第8天达到峰值,相较于CK 对照处理MW1T3、MW2T3、MW3T3 的SOD 活性分别提高52.71%、29.70%、19.44%[见图3(c)]。达到峰值后各试验处理组SOD 活性呈下降趋势,最终变化趋势趋向于CK 对照处理水平。综合3个不同胁迫时长处理的结果,可以看出胁迫时长为10 d 的处理组在复水后SOD 活性相较于CK 对照处理增大得最多,出现的补偿效应最为明显。
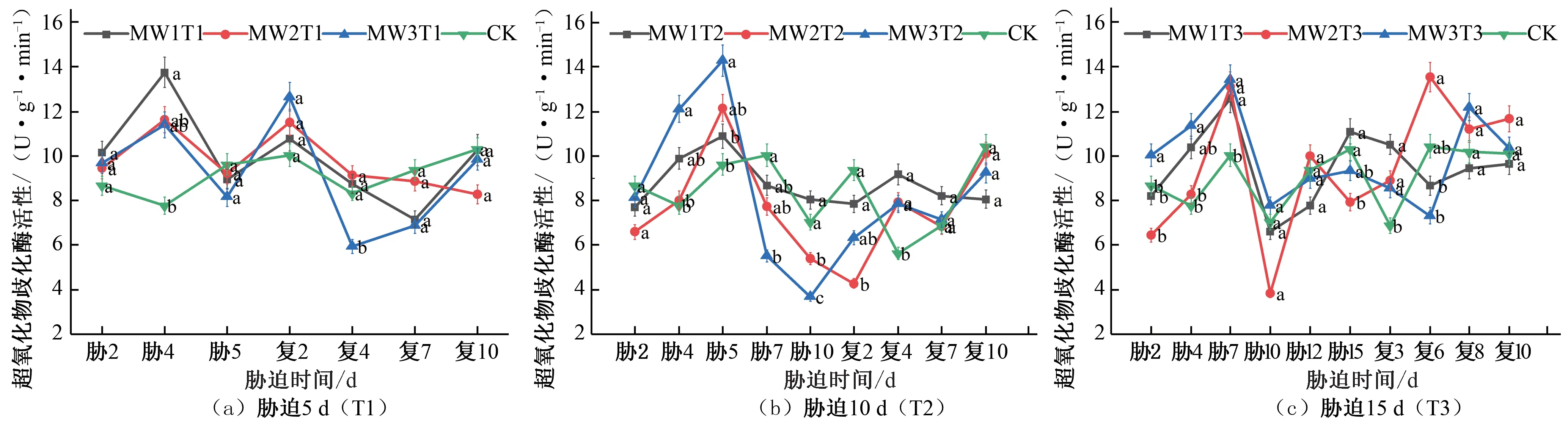
图3 夏玉米苗期超氧化物歧化酶(SOD)活性于干旱胁迫-复水处理下的变化Fig.3 Changes of SOD activity in summer maize seedlings under drought stress and rehydration treatment
夏玉米拔节期期间,胁迫5 d 处理组的夏玉米,在胁迫期间SOD 活性均呈现增大的趋势,BW1T1 在胁迫第5 天SOD 活性达到最高点,BW2T1 于胁迫第3 天达到峰值,相较于CK 对照处理分别提高了5.91%和14.36%;复水后,试验组SOD 活性均呈下降趋势[见图4(a)]。胁迫10 d 处理组的夏玉米,在胁迫期间BW1T2 的SOD 活性呈现先增大后减小的趋势,于胁迫第5 天达到峰值,相较于CK 对照处理提高了34.87%,BW2T2的SOD 活性始终低于CK 对照处理水平;复水后胁迫程度缓解,复水第2 天SOD 活性降至最低,之后BW1T2 的SOD 活性先增大后减小,在复水第5 天SOD 活性达到最高点,相较于CK对照处理提高了51.98%,出现明显补偿效应,BW2T2的则逐渐增加恢复至CK 水平[见图4(b)]。胁迫15 d 处理组的夏玉米,在胁迫期间SOD 活性均呈现先增大后减小的趋势,于胁迫第5天达到峰值,BW1T3和BW2T3的SOD活性相较于CK对照处理分别提高了22.92% 和18.57%;复水后BW1T3 变化趋势与CK 对照处理组相一致,BW2T3 在复水后第2 天SOD 活性相较于CK 对照处理提高了54.67%,之后降低至CK 水平[见图4(c)]。在夏玉米拔节期,所有处理均在胁迫第5 天达到峰值,说明在拔节期胁迫第5天时,作物所遭受的胁迫状态相同。复水后,胁迫时长为10 d(T2)处理组补偿效应较为明显,其SOD活性明显高于胁迫时长为5 d(T1)和15 d(T3)的处理组。

图4 夏玉米拔节期超氧化物歧化酶(SOD)活性于干旱胁迫-复水处理下的变化Fig.4 Changes of SOD activity in summer maize at jointing stage under drought stress and rehydration treatment
综合夏玉米苗期和拔节期在干旱胁迫-复水过程中SOD 活性的变化响应,相较于CK 对照处理,复水后SOD 活性呈现先增大后减小的趋势,这与庄克章的研究结论相一致[22]。胁迫时长为10 d 的处理组复水后补偿效应最明显,不同胁迫程度的处理组的对比中可以看出中度胁迫处理的SOD 活性复水后高于轻度和重度胁迫处理。
2.3 干旱胁迫-复水对过氧化物酶(POD)活性的影响
过氧化物酶(POD)是植物体细胞内普遍存在的,植物的代谢和抗逆性都与其有着紧密的关系[23],它的主要作用是还原过氧化氢,将其转变成水分子,通过这个过程来清除过氧化氢。在夏玉米苗期,胁迫时长为5 d 的试验组MW1T1 和MW2T1 在胁迫期间POD活性不断增大,并在胁迫第5天达到峰值,分别相对于CK 对照组增加了24.88%和55.28%,MW3T1 的POD 活性先减小后增大,胁迫期间低于CK 对照处理组水平;复水处理后,各试验组均在复水第4天达到峰值,MW1T1、MW2T1、MW3T1 的POD 活性分别相对于CK 对照组增加了32.97%、16.53%、29.70%,出现了一定补偿效应,之后降低至CK 对照处理水平[见图5(a)]。胁迫时长为10 d 的试验组MW2T2 和MW3T2 分别在胁迫第5 天和第9 天POD 的活性达到峰值,分别相对于CK 对照组增加了37.66%和94.94%,MW1T2 的试验组在胁迫期间POD 活性始终低于CK 对照处理水平;复水处理后,各处理的POD 活性不断增加,MW1T2 和MW2T2 的POD活性复水后始终低于CK 对照处理水平,MW3T2 的POD 活性在复水第7 天后高于CK 对照处理,出现一定补偿效应[见图5(b)]。胁迫时长为15 d 的试验组POD 活性均呈现先增大后减小的趋势,MW1T3 和MW3T3 在胁迫第5 天的POD 活性达到峰值,分别相对于CK 对照组增加了31.01%和28.22%,MW2T3在胁迫第9 天的POD 活性达到峰值,相对于CK 对照组增加了18.02%;复水后POD 活性有所增加,但均未出现明显补偿效应[见图5(c)]。
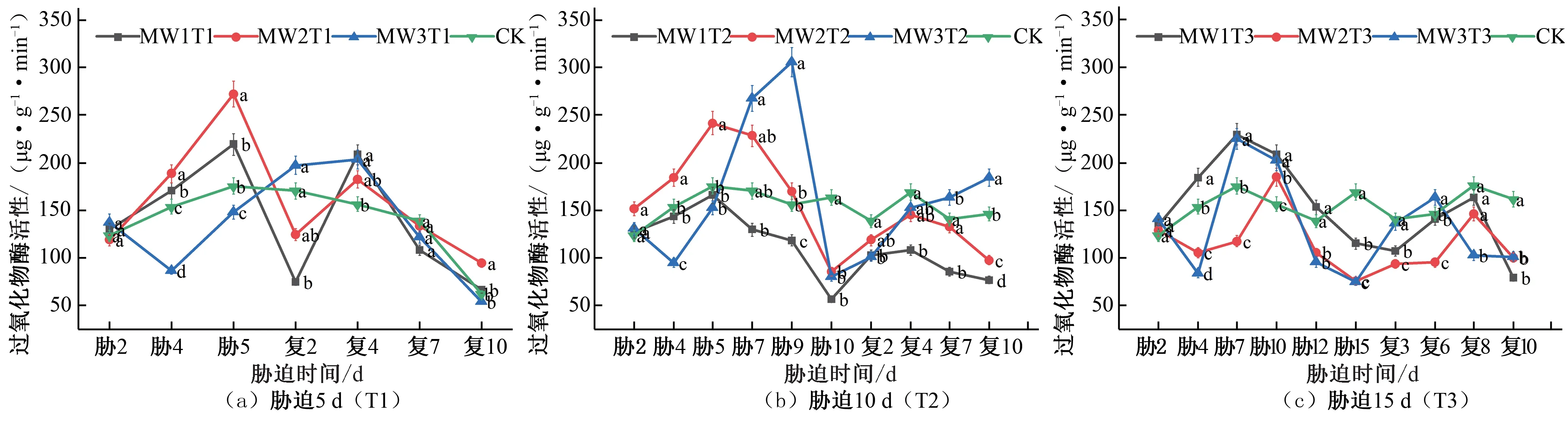
图5 夏玉米苗期过氧化物酶(POD)活性于干旱胁迫-复水处理下的变化Fig.5 Changes of POD activity in summer maize seedlings under drought stress and rehydration treatment
在夏玉米拔节期,胁迫5 d的试验组POD 活性在胁迫期间BW1T1 持续增大,于胁迫第5 天达到峰值,相较于CK 对照组提升了46.14%,复水后先减小后增大,逐渐增大至CK 对照水平;BW2T1的POD活性在夏玉米拔节期始终低于CK对照水平[见图6(a)]。胁迫10 d 的处理组在胁迫期间BW1T2 在胁迫第10天出现峰值,相较于CK 对照组提升了39.44%,BW2T2 胁迫期间POD活性始终低于CK对照水平,复水后两组处理POD活性均显著增加,均在复水后第7天POD活性达到峰值,出现补偿效应,分别相较于CK对照组提升了55.19%、13.85%,之后降低至CK对照水平[见图6(b)]。胁迫15 d的处理组在胁迫期间POD 活性均低于CK 对照水平,复水后虽然有所增加,但始终低于对照组水平[见图6(c)]。
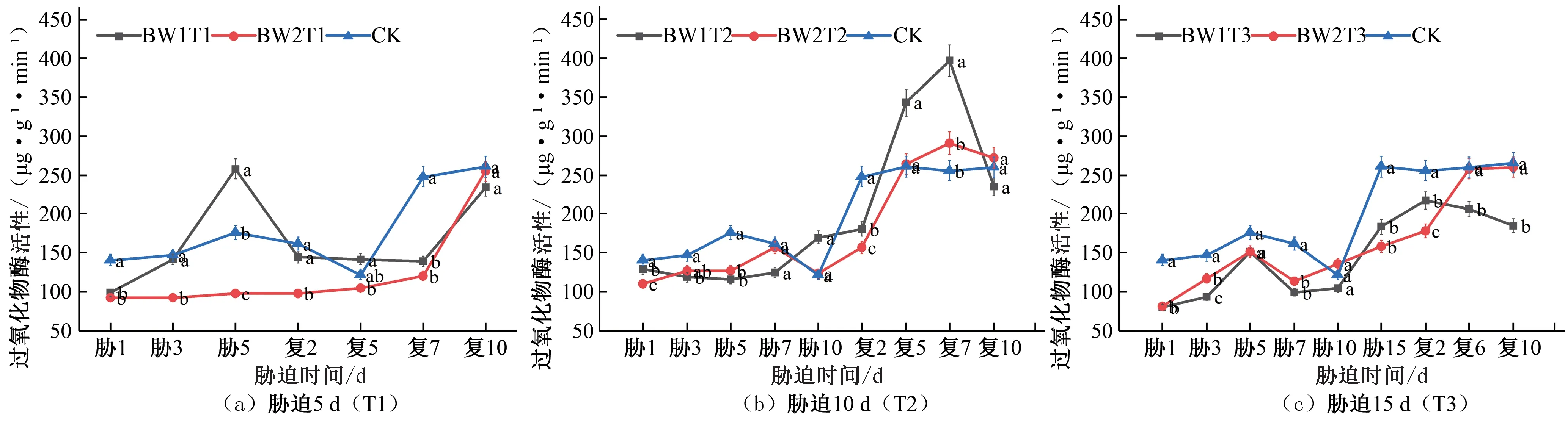
图6 夏玉米拔节期过氧化物酶(POD)活性于干旱胁迫-复水处理下的变化Fig.6 Changes of POD activity in summer maize at jointing stage under drought stress and rehydration treatment
综合对比夏玉米苗期和拔节期在干旱胁迫-复水过程中POD 活性的变化响应,随着胁迫时长的增长,POD 活性相较于CK 对照处理增大幅度逐渐降低,说明由于干旱胁迫程度不断加剧,植物体内抗氧化系统的工作出现了失调。恢复正常水平灌水后各处理的POD 活性均有所增加,这与黄旭光研究朱槿幼苗的POD 活性变化规律一致[24]。拔节期的POD 活性明显高于苗期,说明夏玉米拔节期清除过氧化氢的能力强于苗期。
2.4 干旱胁迫-复水对夏玉米过氧化氢酶(CAT)活性的影响
过氧化氢酶(CAT)以过氧化氢为底物,通过催化一对电子的转移而最终将其分解为水和氧气[25],避免了过氧化氢在体内的积累,从而可维持体内正常的活性氧水平[26]。由图7 可知,在夏玉米苗期期间,胁迫5 d 的处理组在胁迫期间CAT 活性先增大后减小,在胁迫第4 天达到峰值,MW1T1、MW2T1 和MW3T1 的CAT 活性相较于CK 对照组分别提升了64.49%、104.23%、52.18%,而第5 天减小至最小值;复水后所有试验组CAT 活性先升高后降低,MW1T1 水平于复水第2 天达到峰值,MW2T1 和MW3T1 于复水第4 天达到峰值,相较于CK 对照组分别提升了11.19%、79.37%、32.53%,最终3 个水分胁迫处理组的CAT活性均降低至CK对照处理水平[见图7(a)]。胁迫10 d 的3 组不同的水分处理胁迫期间均在胁迫第4 天CAT 活性达到峰值,MW1T2、MW2T2 和MW3T2 的CAT 活性相较于CK 对照组分别提升了31.16%、55.07%、36.73%,而第5 天减小至最小值,在胁迫末期均低于CK 对照处理水平;复水后,MW1T2 和MW2T2 均先增大后减小,MW1T2 的CAT 活性在复水后第2 天达到峰值,MW2T2 的CAT 活性在复水后第4 天达到峰值,分别相较于CK 对照组分别提升了5.23%、32.43%,出现补偿效应并最终降低至CK水平,MW3T2复水后呈现先减小后增大的趋势,在复水第7 天出现补偿效应[见图7(b)]。胁迫15 d的处理组,在胁迫期间均于胁迫第4天CAT活性达到峰值,MW1T3、MW2T3 和MW3T3 的CAT 活性相较于CK 对照组分别提升了56.38%、31.84%、26.50%,在胁迫末期CAT 活性和CK 对照处理水平一致,在复水期间3 个试验组的CAT 活性均先增大后减小,出现补偿效应,MW1T3和MW2T3在复水第3 天达到峰值,相较于CK 对照组分别提升了18.58%、27.07%,MW3T3在复水第8天达到峰值,相较于CK 对照组提升了40.28%,之后均降低至CK水平[见图7(c)]。

图7 夏玉米苗期过氧化氢酶(CAT)活性于干旱胁迫-复水处理下的变化Fig.7 Changes of CAT activity in summer maize seedlings under drought stress and rehydration treatment
在夏玉米拔节期期间,胁迫5 d 的处理组,BW1T1 的CAT活性在胁迫期间先增大后减小,在胁迫第3天达到峰值,相较于CK 对照组提升了52.94%,复水后也呈现先增加后减小的趋势,于复水第5 天达到峰值,相较于CK 对照组提升了53.31%;BW2T2 的CAT 活性在胁迫期间持续增加至胁迫第5天达到峰值,相较于CK 对照组提升了32.55%,复水后先减小后增加,于复水后第7 天达到峰值,相较于CK 对照组提升了38.13%,2个不同水分水平的处理均出现补偿效应且于复水后第10天恢复至CK 水平[见图8(a)]。胁迫10 d的2个水分处理组CAT 活性均在胁迫期间先升高后降低,胁迫第5 天达到峰值,BW1T2 和BW2T2 相较于CK 对照组分别提升了74.23%、38.54%;复水后各试验组也均呈现先增大后减小的趋势,并于复水后第2 天达到峰值,CAT 活性相较于CK 对照组分别提升了5.93%、38.07%,出现补偿效应,之后CAT 活性开始减小,复水后第7 天降低至CK 水平[见图8(b)]。胁迫15 d 的2 个处理组在胁迫期间先升高后降低,在胁迫第3天的时候达到峰值,BW1T3 和BW2T3 的CAT 活性相较于CK 对照组分别提升了33.44%、16.15%;复水后CAT 活性持续增加,BW1T3 和BW2T3 出现明显补偿效应,其CAT 活性分别于复水后第10 天和复水后第6 天达到峰值,相较于CK 对照组分别提升了35.37%、29.96%[见图8(c)]。
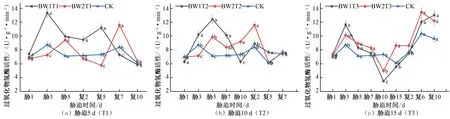
图8 夏玉米拔节期过氧化氢酶(CAT)活性于干旱胁迫-复水处理下的变化Fig.8 Changes of CAT activity in summer maize at jointing stage under drought stress and rehydration treatment
综合比较夏玉米苗期和拔节期在干旱胁迫-复水过程中CAT 活性的变化响应,在夏玉米苗期胁迫期间,CAT 活性均于胁迫第4 天达到峰值,这与刘承[27]利用PEG-6000 模拟水分胁迫的研究得出的结论一致;复水后轻度和中度水分胁迫处理均在复水4 天内达到峰值,而重度水分胁迫处理均在复水4天后达到峰值,说明随着胁迫程度增加,复水后CAT 响应时间增长。夏玉米拔节期的CAT 活性均高于相同胁迫程度的苗期处理,说明作物拔节期抵抗胁迫危害的能力强于苗期。
2.5 干旱胁迫-复水对夏玉米还原型谷胱甘肽(GSH)含量的影响
植物对于外界环境胁迫的耐受性与植物体内谷胱甘肽含量密切相关,在植物受到干旱胁迫时,植物细胞自身代谢过程中会生成部分过氧化物,还原型谷胱甘肽(GSH)可以非常高效地清除这些过氧化物[28]。GSH可以由植物体细胞内的氧化型谷胱甘肽(GSSG)转化而来,GSH 含量增高后植物抗逆能力也随之变强[29]。在夏玉米苗期,胁迫5 d 的处理组MW1T1 和MW2T1 的GSH 含量呈现先减小后增大的趋势,在胁迫第5 天达到峰值,分别是CK 对照处理组的1.35 倍、1.23 倍,MW3T1的GSH 含量胁迫期间持续降低;复水后,各试验组GSH 含量均在复水第2 天达到峰值,分别是CK 对照处理组的1.31 倍、1.16 倍、1.82 倍,出现明显补偿效应,之后降低至CK 对照处理水平[见图9(a)]。胁迫10 d 的处理组MW1T2 和MW2T2 的GSH 含量在胁迫第7 天达到峰值,分别是CK 对照处理组的1.22 倍和1.33 倍,MW3T2 的GSH 含量胁迫期间持续降低;复水后,MW1T2 和MW2T2 分别于复水后第4 天和复水后第2 天GSH 含量达到峰值,分别为对照组的1.69 倍和1.95 倍,出现明显补偿效应,MW3T2 复水后未出现补偿效应[见图9(b)]。胁迫15 d 的处理组MW1T3 的GSH 含量先减少后增加再下降,于胁迫第7 天达到峰值,是CK 对照处理组的1.73 倍,MW2T3 和MW3T3的GSH 含量均先增加再减少,于胁迫第4天达到峰值,分别是CK 对照处理组的1.73 倍和1.96 倍;在复水后3 组不同水分胁迫处理GSH 含量均有所增加,MW1T3 和MW2T3 分别于复水后第8 天和第6 天达到峰值,相较于CK 对照组GSH 含量分别是其1.21 倍和1.26 倍,出现了补偿效应,MW3T3 复水后GSH含量逐渐增大,但未出现补偿效应[见图9(c)]。

图9 夏玉米苗期还原型谷胱甘肽(GSH)含量于干旱胁迫-复水处理下的变化Fig.9 Changes of GSH content in summer maize seedlings under drought stress and rehydration treatment
在夏玉米拔节期,胁迫时长为5 d的处理GSH 含量均呈增加趋势,在胁迫末期达到峰值,BW1T1 和BW2T1 分别为CK对照组的1.22 倍和0.96 倍,复水后逐渐降低,未出现补偿效应[见图10(a)]。胁迫时长为10 d的处理胁迫期间的GSH含量呈先增加后减少的趋势,BW1T2 的GSH 含量于胁迫第3 天达到峰值,是CK 对照组的1.23 倍,BW2T2 的GSH 含量未超过CK对照组;复水后2组处理GSH含量均逐渐增加,但未出现补偿效应[见图10(b)]。胁迫时长为15 d的处理,GSH 含量先增加后减少,BW1T3 的GSH 含量始终低于CK 对照组,BW2T3 的GSH 含量于胁迫第5 天达到峰值,是CK 对照组的1.06 倍,复水后2组处理均始终低于CK对照水平[见图10(c)]。
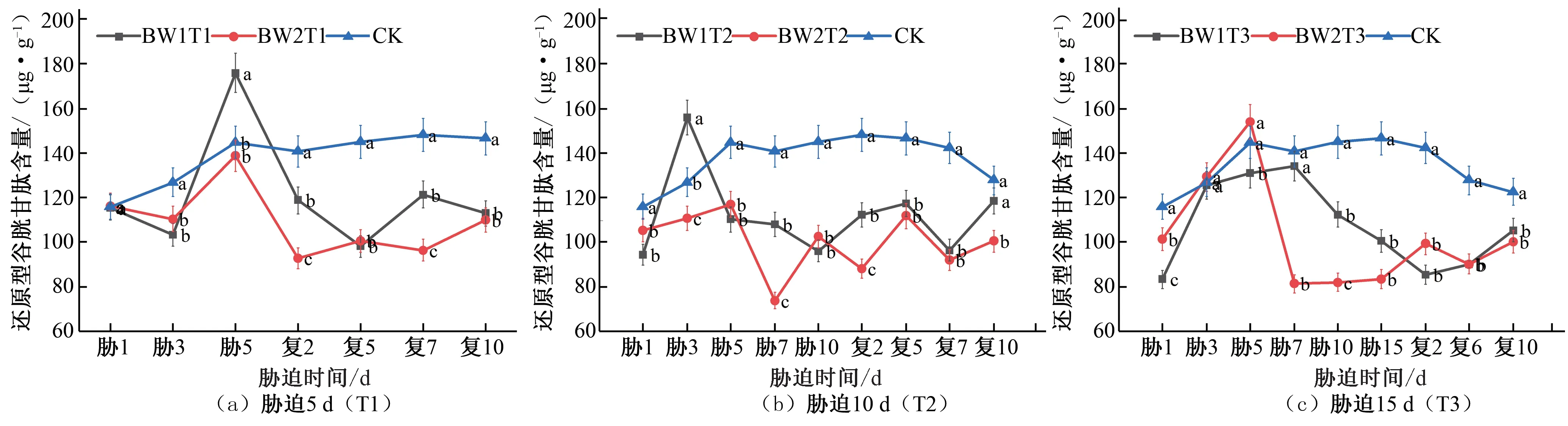
图10 夏玉米拔节期还原型谷胱甘肽(GSH)含量于干旱胁迫-复水处理下的变化Fig.10 Changes of GSH content in summer maize at jointing stage under drought stress and rehydration treatment
综合对比夏玉米苗期和拔节期在干旱胁迫-复水过程中GSH 含量的变化响应,胁迫处理期间,在胁迫时长为5 d 时,轻度胁迫处理的GSH 含量高于中度和重度胁迫处理,胁迫时长10 d 和15 d 的处理组,中度胁迫的GSH 含量则是最高的,植物体内GSH 含量随干旱胁迫程度加重而减小,这与王娟的研究结论一致[30]。复水后苗期的重度胁迫处理在胁迫10 d 和15 d 的处理组GSH 含量小于CK 对照处理,说明随着胁迫时长和胁迫程度的增大,作物胞内代谢过程也受到了一定程度的破坏。
3 结论
综合比较夏玉米苗期和拔节期的MDA、SOD、POD、CAT与GSH 的变化趋势,SOD、POD、CAT、GSH 在夏玉米的苗期均呈现出先增大后减小的趋势,在胁迫第4 天左右达到峰值。在拔节期,夏玉米的SOD、POD、CAT、GSH 呈现先增大后减小的趋势,均在胁迫5~10 d 达到峰值。拔节期的各指标峰值的活性(含量)均高于对应的苗期峰值。由此表明,夏玉米拔节期各个生化指标的调节能力均强于苗期,因此拔节期抗旱性要优于苗期。肖钢在对夏玉米的研究中也得出了类似结论[17]。夏玉米的MDA 在胁迫期间均随胁迫时长和胁迫程度的增加不断积累,在胁迫末期达到峰值,复水后随着胁迫缓解出现一定补偿效应,最终逐渐恢复至CK对照水平。通过MDA含量的变化能初步判断细胞膜过氧化的程度和夏玉米对逆境条件的反应强弱,也可以验证玉米抗氧化保护酶系统的响应机制。
通过探究夏玉米生化指标对干旱-复水的响应变化,表明在对夏玉米进行节水灌溉时,从夏玉米各生化指标变化响应来看,夏玉米苗期的抗旱能力不强,不宜开展持续时间较久或干旱程度较重的亏水灌溉方案;夏玉米拔节期的抗旱能力强于苗期,可以采用持续10 d 灌水量为55%~65%土壤田间持水量的胁迫处理方案进行灌溉,使得夏玉米受到的胁迫伤害在作物自身可调节范围内,继而复水后出现补偿效应,以期对夏玉米的高效节水灌溉提供理论支持。

