慢性高尿酸血症肾损害大鼠模型的建立
刘冬恋,郭秋鸿,夏阳淼,周叶,李佳
(1.成都医学院四川养老与老年健康协同创新中心,成都 610500;2.三六三医院病案与统计科,成都 610041)
随着人们饮食结构的改变和生活方式的变化,高尿酸血症的发生率逐年增高,其对健康的影响也越来越受到人们的重视。高尿酸血症与心血管疾病、肾病、糖尿病、高血压等疾病密切相关[1-2]。导致尿酸升高的原因主要是尿酸生成过多或尿酸排泄减少,90%的高尿酸血症与肾尿酸排泄减少有关[3]。高尿酸血症也是慢性肾疾病发生发展的独立危险因素[4]。因此,建立稳固的慢性高尿酸血症肾损害动物模型,对发现有助于延缓慢性高尿酸血症肾损害进展的新方法,具有重要的临床意义。
人类由于缺乏尿酸酶,所以尿酸是嘌呤代谢的最终产物,但是其它大多数哺乳动物体内的尿酸酶可将尿酸降解为尿囊素而随尿液排出,故而大多数动物体内血尿酸值较低,建立高尿酸血症的动物模型非常困难[5]。同时,目前国内外尚无公认的慢性高尿酸血症肾损害的动物模型。本研究参考了文献报道的四种制造慢性高尿酸血症肾损害动物模型的方法,通过每周眼眶取血的方式,动态的观察大鼠体重、血清中的尿酸、肌酐、尿素氮等生化指标,然后对肾进行形态学观察,考察和评价建立持续稳定的慢性高尿酸血症肾损害动物模型的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物
40只5~6周龄SPF级雄性SD大鼠,体重(220±10)g,成都达硕实验动物有限公司提供【SCXK(川)2020-030】。饲养于成都医学院科研实验中心【SYXK(川)2020-196】。每只大鼠分笼饲养,饲养环境为室温(22±2)℃、湿度50~60%、12 h光照/12 h黑暗交替。饲喂期间普通大鼠饲料(批号:20200901),购自成都达硕实验动物有限公司。所有操作均符合成都医学院实验动物伦理学要求(编号:2020007)。
1.1.2 主要试剂与仪器
氧嗪酸钾(批号:H2017151)、酵母浸膏(批号:K1914028)、腺嘌呤磷酸盐(批号:D1402001)均购自上海阿拉丁生化科技股份有限公司;羧甲基纤维素钠(批号:20190626)购自成都金山化学试剂有限公司;肌酐试剂盒(批号:20200907)、尿素氮试剂盒(批号:20200904)、尿酸试剂盒(批号:20200907)均购自南京建成生物工程研究所。HE染色试剂盒(批号:20200829)、尿酸盐染色试剂盒(Gomori六胺银法)(批号:20201202)、中性树胶(批号:330A023)均购自北京索莱宝科技有限公司。
Centrifuge 5415D小型台式高速离心机(德国eppendorf公司),CP225D精密分析天平(德国sartorious公司),Varioskan Flash酶标仪(美国Thermo公司),BX63正置荧光显微镜显微镜(日本Olympus公司),Leica RM 2016超薄切片机(美国feica公司),Specord 50 Plus紫外分光光度计(德国耶拿分析仪器股份公司)。
1.2 方法
1.2.1 动物分组及造模方法
将40只大鼠随机分为5组(每组8只),分别为正常组、A、B、C、D组,具体分组及造模情况见表1。所有动物适应生活环境,自由进食和饮水,1周后开始实验。每周眼眶取血1次,各组造模时间为5周。
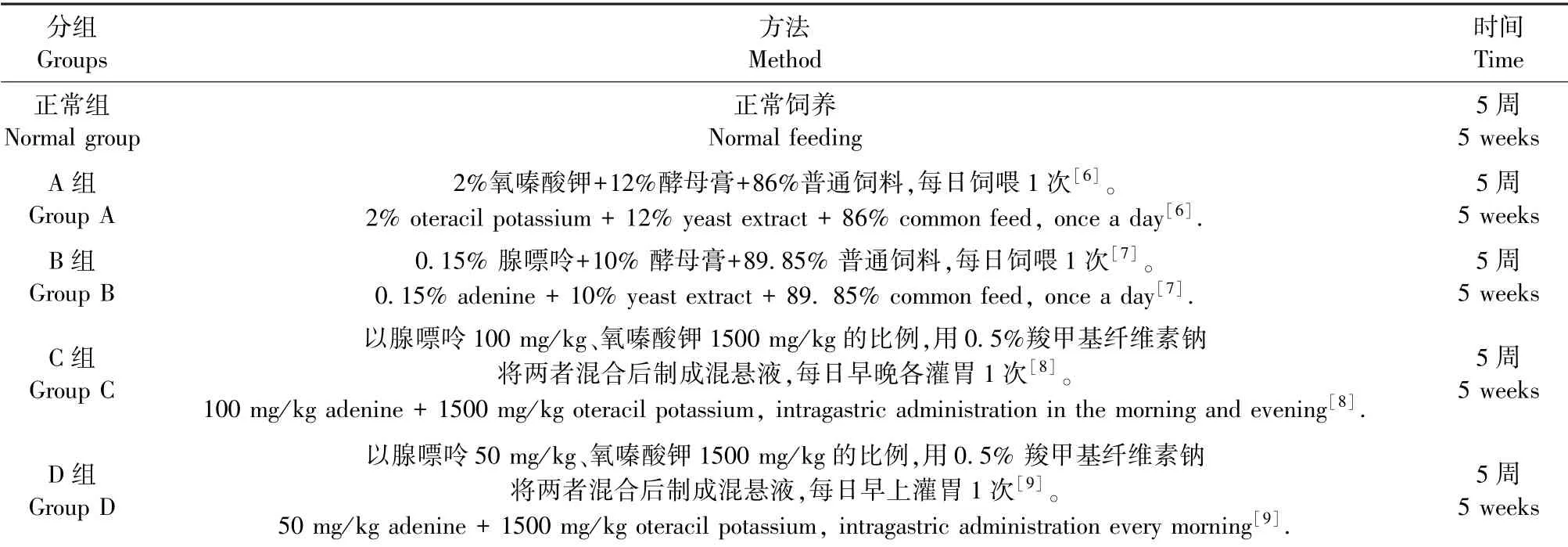
表1 动物分组及造模方法统计表Table 1 Statistical table of animal grouping and modeling methods
1.2.2 检测指标及处理
采血前12 h禁食不禁水,每周用眼眶取血方法,每只取血0.5 mL,然后37℃水浴30 min,3000 r/min离心15 min,取血清100μL。按照尿酸、肌酐和尿素氮试剂盒的说明书,采用紫外分光光度计和酶标仪测定大鼠血清中尿酸、肌酐和尿素氮的水平。
1.2.3 大鼠肾的病理组织学检查
大鼠处死后,取全肾,称重,计算肾体比。右肾用生理盐水清洗后,浸泡在10%中性甲醛溶液中固定,然后进行常规脱水,石蜡包埋,HE染色。左肾浸泡在无水乙醇中固定,按照尿酸盐染色方式进行染色,然后在400倍物镜视野下,随机选择l0个无肾小球只有肾小管的视野,按照冯学轩等[10]的尿酸盐结晶评分标准对肾小管尿酸盐结晶情况进行半定量测定。利用BX63正置荧光显微镜拍照。
1.3 统计学分析
2 结果
2.1 各组大鼠不同时间点体重变化
除C、D两组外,其余各组大鼠的体重随饲喂时间增加均呈缓慢增加的趋势。与正常组相比,在第3周时,A和C组大鼠体重明显降低(P<0.05,P<0.01);在第4周时,A和C组大鼠体重较正常组均极显著降低(P<0.01);在第5周时,C和D组大鼠体重较正常组均极显著降低(P<0.01),说明在不同时间点,A、C和D三种方法制造慢性高尿酸血症肾损害模型均会降低大鼠的体重,而C种方法能稳定的降低大鼠的体重(见表2)。

表2 各组大鼠不同时间点体重的变化(g)Table 2 Changes of body weight of rats in each group at different time points(g)
2.2 各组大鼠双肾重与体重的比值
单从双肾重量比较,C组大鼠与其余各组并无区别,但C组大鼠双肾重与体重的比值与正常组相比极显著升高(P<0.01),其原因是由于C组大鼠体重降低引起的(见图1)。
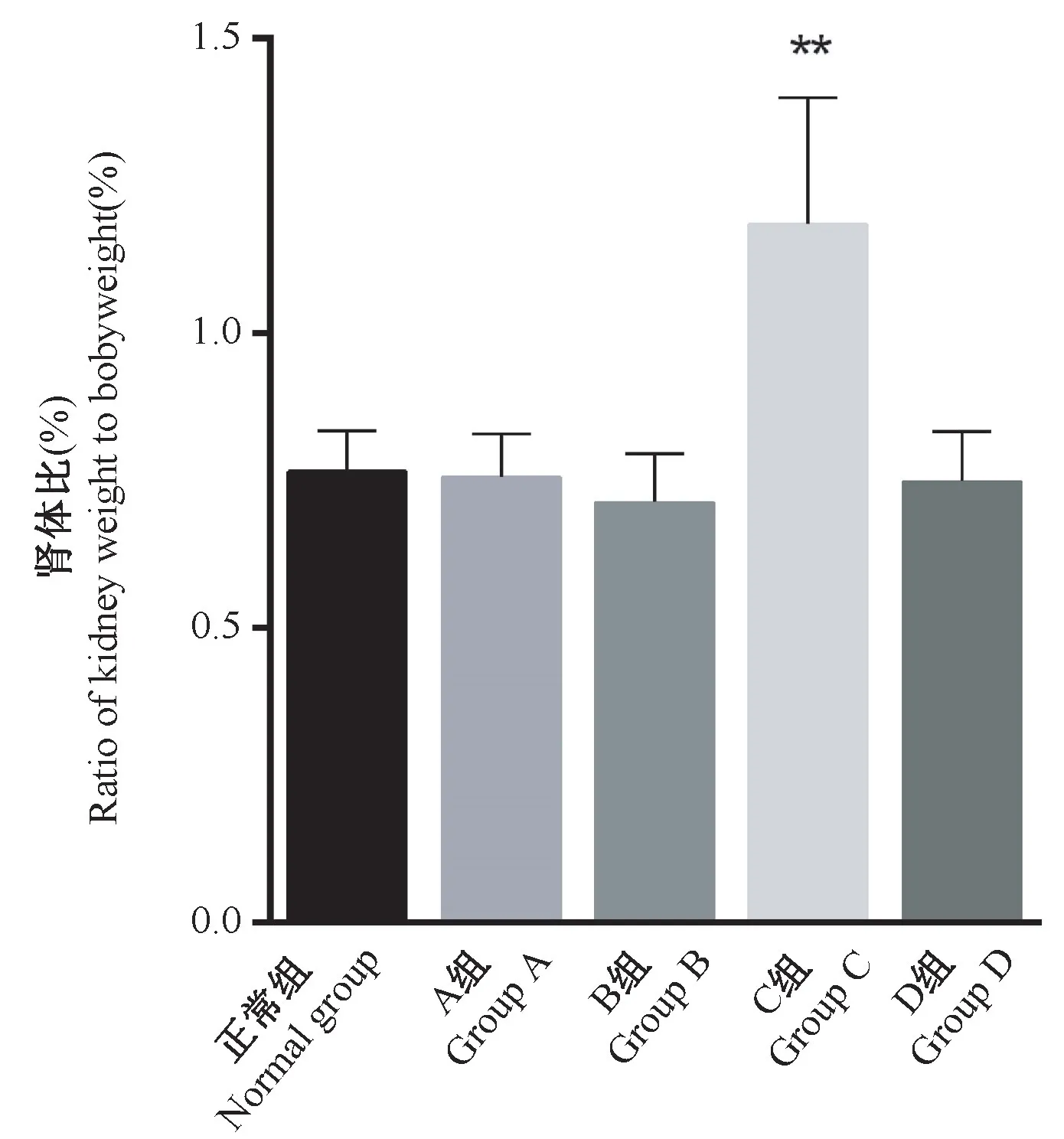
图1 各组大鼠双肾重与体重的比值Figure 1 Ratio of kidney weight to body weight of rats in each group
2.3 各组大鼠不同时间点血清中尿酸水平的变化
结果见表3。除正常组外,模型组各组大鼠的血清中尿酸水平随饲喂时间增加均呈先上升后下降的趋势。与正常组相比,在第1和2周时,A、B、C和D组大鼠血清中尿酸水平显著升高(分别为P<0.05,P<0.01);在第3周时,C和D组大鼠血清中尿酸水平较正常组显著升高(分别为P<0.05,P<0.01);在第4周时,C组大鼠血清中尿酸水平较正常组极显著升高(P<0.01),在第5周时,C组大鼠血清中尿酸水平较正常组显著升高(P<0.05)。说明在前1~2周时,模型组各组大鼠能显著升高血清中尿酸水平,但随着时间的延长,模型组各组大鼠血清中尿酸水平均会降低,只有C组在第5周时,仍和正常组具有统计学意义。

表3 各组大鼠不同时间点血清中尿酸水平的变化(μmol/L)Table 3 Changes of serum uric acid level in rats of each group at different time points(μmol/L)
2.4 各组大鼠不同时间点血清中尿素氮水平的变化
结果见表4。与正常组相比,在第1周和第2周时,C组大鼠血清中尿素氮水平显著升高(P<0.05);在第3周时,B、C和D组大鼠血清中尿素氮水平较正常组极显著升高(P<0.05);在第4和5周时,C组大鼠血清中尿素氮水平较正常组极显著升高(P<0.05),说明C种方法制造的慢性高尿酸血症肾损害模型会升高大鼠血清中的尿素氮水平,并随着时间的延长保持稳定。
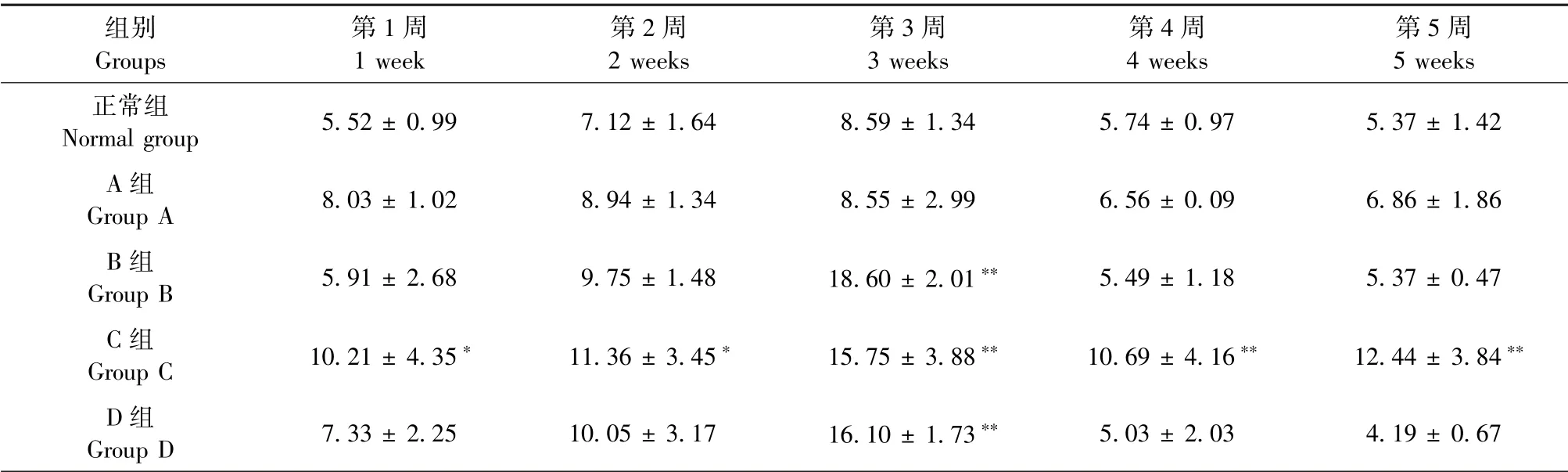
表4 各组大鼠不同时间点血清中尿素氮水平的变化(mmol/L)Table 4 Changes of serum urea nitrogen level in rats of each group at different time points(mmol/L)
2.5 各组大鼠不同时间点血清中肌酐水平的变化
结果见表5。与正常组相比,在第2周时,A和C组大鼠血清中肌酐水平显著升高(分别为P<0.05,P<0.01);在第3周时,B和C组大鼠血清中肌酐水平较正常组极显著升高(P<0.01);在第4和5周时,C和D组大鼠血清中肌酐水平较正常组极显著升高(P<0.01),说明C和D种方法制造的慢性高尿酸血症肾损害模型会升高大鼠血清中的肌酐水平,并随着时间的延长保持稳定。

表5 各组大鼠不同时间点血清中肌酐水平的变化(μmol/L)Table 5 Changes of serum creatinine level in rats of each group at different time points(μmol/L)
2.6 各组大鼠形态观察
结果见图2。正常组大鼠肾颜色呈暗红色,表面光滑,模型组各组大鼠肾颜色均发黄,以C和D组尤为明显,且B、C和D组肾外观表面呈细颗粒状。对肾进行剖面观察,发现正常组肾皮质呈红褐色,肾髓质呈淡红色,A组肾皮质呈淡红色,肾髓质颜色较正常组更深;C组肾皮质呈淡黄色,肾髓质呈纤维状。
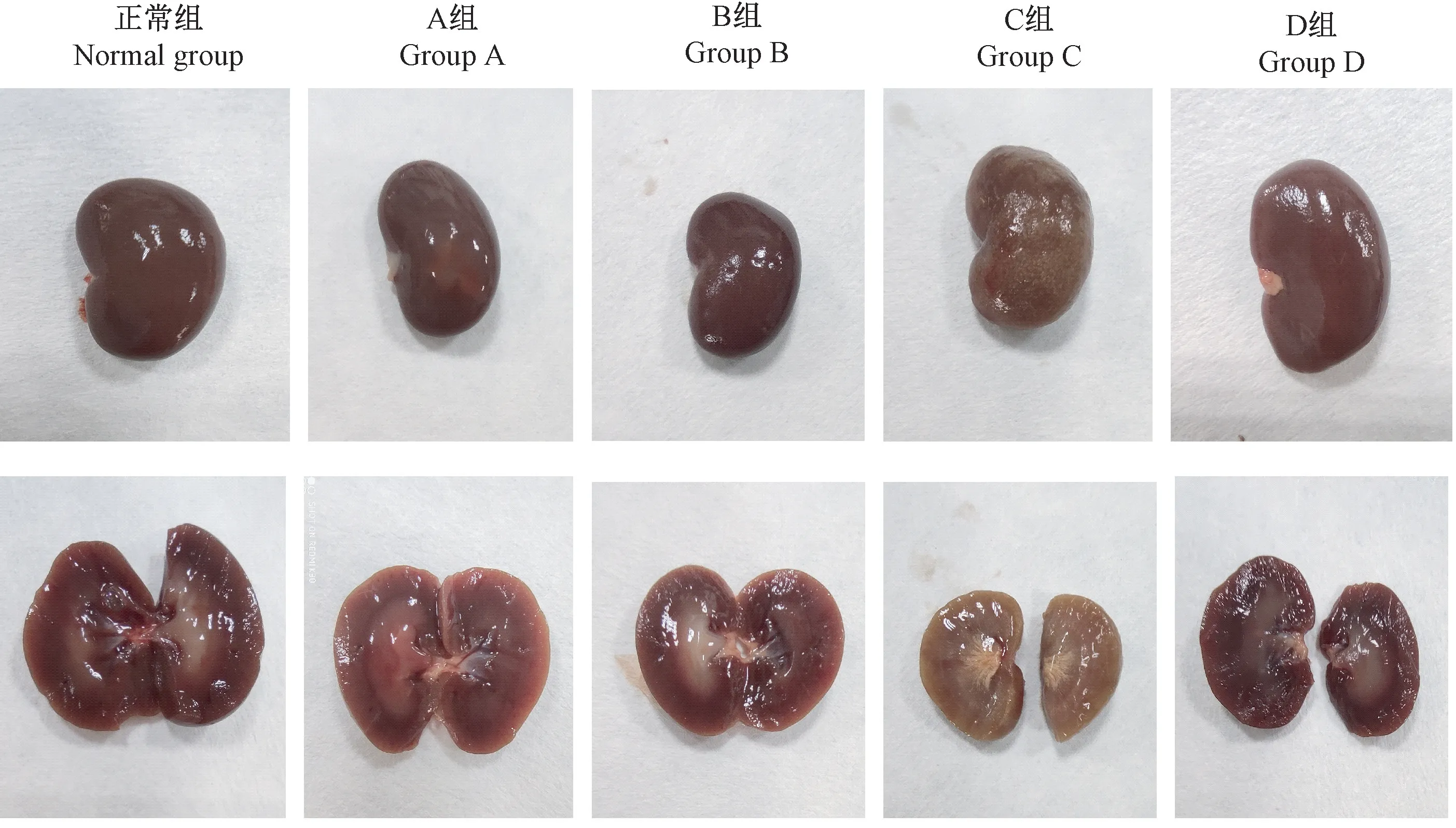
图2 各组大鼠肾及剖面形态Figure 2 Kidney and sectional morphology of rats in each group
2.7 各组大鼠组织病理学结果
结果见图3。正常组大鼠肾小球大小正常,肾小管结构完整清晰。各模型组大鼠均可见肾损伤,表现为肾小管变性、扩张,部分肾小管有炎细胞浸润,肾小球系膜增生。其中B和D组肾小管炎细胞浸润较为严重,C组肾小管有炎细胞浸润,肾小管普遍变性扩张。

图3 各组大鼠肾HE染色病理切片Note.Black arrow.Renal tubular dilatation.Blue arrow.Inflammatory cell infiltration.Figure 3 Pathological sections of kidney in each group
2.8 各组大鼠肾小管尿酸盐结晶情况
正常组和A组肾小管内未见尿酸盐结晶沉积,B、C和D模型组均可见尿酸盐结晶沉积。与正常组相比,B、C和D组的尿酸盐结晶评分均极显著升高(P<0.01)(见图4)。
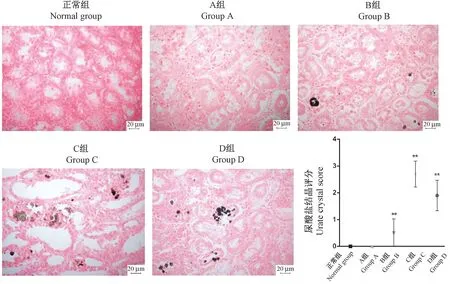
图4 各组大鼠肾小管尿酸盐结晶沉积情况Figure 4 Urate crystal deposition in renal tubules of rats in each group
3 讨论
尿酸是嘌呤代谢的产物,在肾近端小管中受过滤、重吸收和分泌的影响。高尿酸对肾小球的损害机制是使肾小球静水压升高,进而导致肾小球肥大和硬化[11]。高尿酸所致肾小管损伤的机制之一是Na+-K+-ATP酶信号传导的损伤,进而引发炎症、自噬和线粒体功能障碍,导致肾小管细胞损伤[12]。同时,高尿酸可促进巨噬细胞产生活性氧(reactive oxygen species,ROS),上调雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、激活Caspase-1和促进白细胞介素-1β(interleukin-1β,IL-1β)成熟或者分泌,从而导致肾小管上皮细胞脱离、肾小管间质炎症和纤维化[13]。高血清尿酸水平使患者易于形成尿酸盐结晶,而尿酸盐结晶通过激活肾NF-κB和MAPK等信号通路触发炎症反应,诱导多种促纤维化和促炎性趋化因子的产生和释放,导致氧化应激和肾近端小管细胞受损[14]。损伤后的近端小管细胞,在细胞周期的G2/M阶段发生阻滞,促进促纤维化细胞因子的分泌,最终导致肾纤维化[15]。总之,高尿酸血症会导致肾小球和肾小管细胞损伤,最终导致肾纤维化。
在本实验4种造模方案中,涉及了3种药品,氧嗪酸钾是尿酸酶抑制剂,能抑制啮齿类动物的尿酸酶活性[16]。腺嘌呤是一种尿酸的前体,能转化为黄嘌呤沉积在肾小管,同时导致自由基氧化和脂质的过度产生,进而导致肾损伤[17]。酵母浸膏增加大鼠的嘌呤摄入。因此,3种药品可以通过增加尿酸来源,抑制尿酸酶活性来建立慢性高尿酸血症肾损害模型。在本实验的4种造模方案中,A和B两种方法是通过饲喂制造慢性高尿酸血症肾损害模型,此2种方法能短暂时间内升高大鼠血清尿酸、肌酐和尿素氮水平,但不能保持稳定。D种方法能升高造模后大鼠血清尿酸水平,并维持到第3周,同时升高大鼠血清肌酐水平(4~5周),但并不能使大鼠血清尿素氮水平的持续升高,病理切片和尿酸盐结晶半定量分析显示其肾的损伤也不如C组。综合来说,通过饲喂的方式不如灌胃制造慢性高尿酸血症肾损害模型的效果好,其原因可能是饲喂的方式并不能保证所有的饲料被大鼠吃掉,有可能啃食过程中造成浪费。
同样用灌胃方法,还有文献报道用150 mg/kg腺嘌呤联合250 mg/kg乙胺丁醇持续21 d制造慢性高尿酸血症模型,此模型中血清尿酸、肌酐、尿素氮均明显升高,且出现肾尿酸盐结晶沉积,大量肾小管变性、坏死,炎性细胞浸润等病理改变,其肾的病理改变与本模型的结果类似[10]。但是乙胺丁醇会竞争性抑制肾小管分泌尿酸,导致肾受损,因此采用乙胺丁醇造模不符合高尿酸血症肾损害的临床发病机制[18]。
综上所述,本实验利用以100 mg/kg腺嘌呤联合1500 mg/kg氧嗪酸钾,早晚各灌胃1次的方式制造慢性高尿酸血症肾损害模型,成模后大鼠体重减轻,双肾重与体重的比值升高,血清尿酸、肌酐和尿素氮均持续升高,肾皮质呈淡黄色,肾髓质呈纤维化,病理检测发现肾有一定程度的损伤。此方法无论从血生化还是病理组织学方面进行评价均有较好的成模型,该模型的建立为研究慢性高尿酸血症肾损害的药物筛选和开发有着极其重要的意义。

