实时荧光PCR法检测动物源性成分的定性方法验证
徐美鑫 张澜 相茂花
(日照市场监管检验检测中心 山东日照276800)
1 前言
实验室引入标准方法前,应对其能否正确运用这些方法的能力进行验证,并保存验证记录。验证不仅需要识别相应的人员、设施、环境、设备等条件是否满足要求,还应通过试验证明该方法可以满足标准的要求。因此,实验室在将方法引入检测之前,应从“人”“机”“料”“法”“环”等方面验证其是否有能力按照标准方法开展检测活动。例如,人员是否经过有效培训并具备相关知识和能力;仪器设备是否满足标准要求,并处于检定或校准的有效期内;标准物质和关键试剂是否符合标准要求;设施和环境条件是否满足标准要求;检验原始记录是否规范、适用等,且应当附有证明记录。在满足上述条件之后,还应通过试验证明结果的准确性和可靠性。
因此,一份合格的方法验证报告不仅是实验室具备开展检测资质能力的证明,同时也能够证明检测结果的可靠性和准确性。本文按照RB/T《基因扩增检测方法确认与验证指南》要求,以鸡源性成分为例研究了GB/T 38164-2019《常见畜禽动物源性成分检测方法 实时荧光PCR法》方法验证的具体执行方式及各参数的评价方法,有助于实验室技术人员更好地理解方法验证,并给予基因扩增检测领域的方法验证工作的一些参考。
2 材料
2.1 试验样品
现杀整鸡、鸡胸肉、鸡腿、卤鸡爪、烤翅中、炸鸡叉骨、卤鸡肝、鸡肉火腿肠、阳光玉米肠、加钙火腿肠、鸭肉、鹅肉、鸽子肉、猪肉、牛肉、羊肉、马肉、玉米、大豆、花生均为超市购买。
2.2 主要试剂
动物源性植物饲料基因组DNA提取试剂盒(DP323-02)(天根生化)。
鸡种特异性基因测定试剂盒(荧光PCR法)(上海之江)。
2.3 主要仪器
高速冷冻离心机(赛默飞Micro17R);超微量紫外分光光度计(mettler UV5Nano);荧光定量PCR仪(lightCycler 96);微量移液器:10μL、100μL、1 000 μL(eppendorf)。
3 方法
3.1 方法验证参数
按照RB/T 032-2020《基因扩增检测方法确认与验证指南》要求,并参考RB/T 004-2019《转基因检测方法验证指南》[2],以鸡源性成分为例研究GB 38164-2019《常见畜禽动物源性成分》方法验证,验证了该方法的DNA提取效果评价、重复性、检出限和基质效应。
3.2 DNA提取质量
使用DNA提取试剂盒对现杀整鸡进行DNA提取,PCR体系配制及反应参数按照鸡种特异性基因测定试剂盒进行操作。
以鸡的DNA提取物为起始工作液,并将此工作液进行4倍系列稀释(1∶4、1∶16、1∶64、1∶256),获得4份稀释液。将这5份DNA样品溶液进行扩增分析,每个浓度做2个PCR平行试验,以稀释因子的对数值为横坐标(即-lg1/4、-lg1/16、-lg 1/64、-lg1/256),对应的平均Ct值为纵坐标,得出斜率、线性相关系数、ΔCt值(起始工作液测量Ct值与通过标准曲线外推法获得的定量循环数的差值)。
3.3 重复性
对于基因扩增反应来说,方法的重复性的评估采用同一实验室检测相同样品,获得相同结果的比率表征。在同一实验室由同一操作者,检测条件和日常检测一致,对同一样品(现杀整鸡)进行DNA提取,平行提取2次;以鸡的DNA提取物为起始工作液进行系列稀释至10%、1%、0.5%、0.2%、0.1%(含有接近检出限水平),将每个稀释液进行4个平行PCR扩增;重复试验1次,每个稀释液得到16个独立测量的结果。
3.4 检出限
使用终点稀释法,对鸡的DNA提取物进行系列稀释至10%、1%、0.5%、0.2%、0.1%,进行PCR扩增,5%以上样品检测不到目标物的稀释浓度就是该方法的检出限。
3.5 基质效应
对于定性方法,采用了未加工过、初加工的和深加工过的鸡制品等10份作为阳性样本,用其他禽类、畜类和植物类等10份为阴性样本,进行PCR扩增。
4 结果与分析
4.1 DNA提取效果评价
抑制PCR反应的物质可以通过与DNA模板反应、干扰DNA聚合酶活性或降低聚合酶辅助因子(Mg2+)的效率而影响目标DNA扩增的效率。DNA提取步骤可以在很大程度上消除或降低PCR抑制物的量,因此DNA提取效果可以用检测DNA提取物中抑制剂的方式进行评价。
RB/T 032-2020《基因扩增检测方法确认与验证指南》要求,以稀释因子的对数值为横坐标(即-lg1/4、-lg1/16、-lg1/64、-lg1/256),对应的平均Ct值为纵坐标,绘制的标准曲线斜率在-3.6到-3.1之间,线性相关系数大于0.98;工作液推导Ct值与测量Ct之差ΔCt值小于0.5;即说明DNA提取物中无抑制剂影响。
如图1和表1所示,曲线斜率为-3.3461,相关系数R2为0.99,工作液推导Ct值与测量Ct之差ΔCt为0.11小于0.5,满足RB/T 032-2020的要求[1]。证明天根生化的动物源性植物饲料基因组DNA提取试剂盒提取的产物不含抑制剂,提取效果合格,可以用于PCR扩增反应。

表1 DNA提取物中抑制剂检测
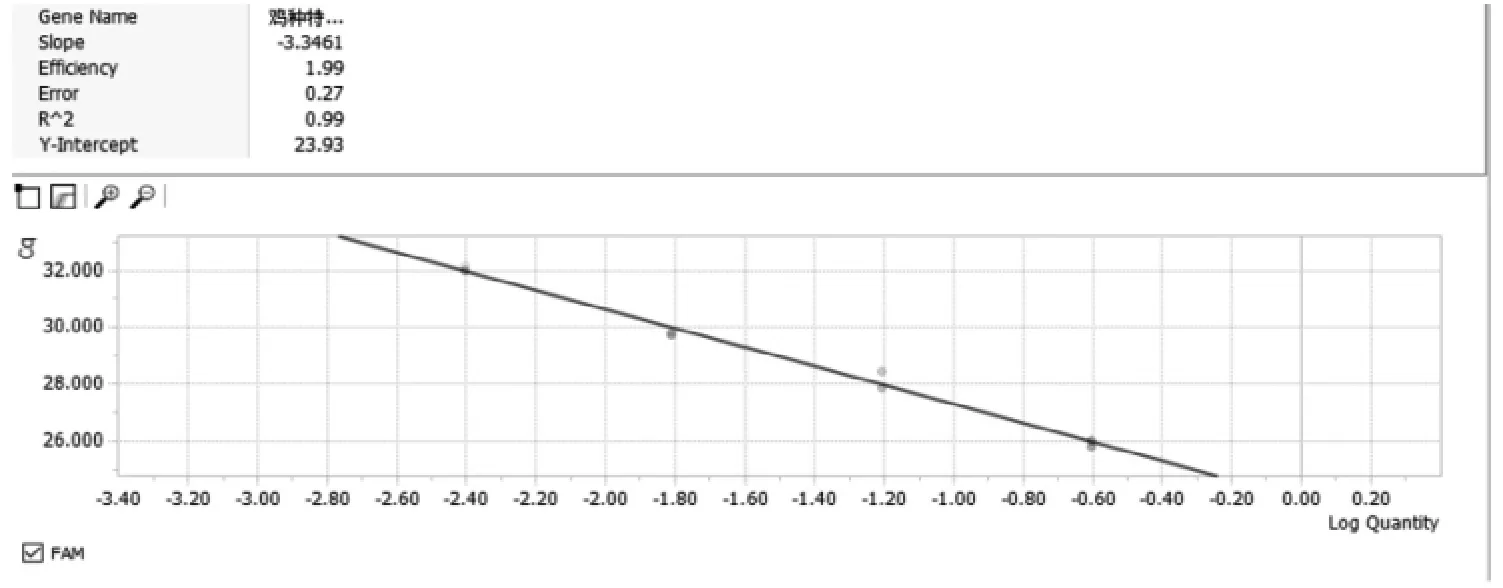
图1 4个系列稀释的标准曲线
4.2 重复性
重复性是指实验室内精密度,即同一实验室在相同条件下获得一系列结果的一致性程度。采用相对重复性标准偏差(RSDr)来衡量精密度工具,当RSD≤25%时证明重复性较好。
如表2所示,含量为0.1%和0.01%鸡种DNA样品未能全部测出Ct值,其余4个浓度均能测出,且相对重复性标准偏差RSDr值分别为1.35%、1.32%、1.63%、1.58%,均<25%,证明其重复性较好。

表2 重复性试验结果
4.3 检出限
通过量化样品中核酸的最小检测量来评估检出限,如通过已知浓度的被分析物标准品进行有限稀释获得。当缺乏已知浓度的标准品时,可使用终点稀释法,对目标分析物进行系列稀释,直到该稀释度中5%以上样品检测不到目标物,此时的稀释浓度就是方法检出限。
不同含量的鸡种DNA样品16个检测结果见表2。结果显示:含量为0.01%的样品绝大多数未检出且扩增曲线不明显;含量为0.1%的鸡种DNA样品有1个未检出目的基因,占整个样品的6.25%;故0.1%为该方法的检出限,满足GB/T 38164-2019《常见畜禽动物源性成分检测方法 实时荧光PCR法》中鸡源性成分的检出限1%的要求。
4.4 基质效应
对于定性方法,采用了未加工过的现杀整鸡、鸡胸肉、鸡腿;初加工的卤鸡爪、烤翅中、炸鸡叉骨、卤鸡肝;深加工过的鸡肉火腿肠、阳光玉米肠和加钙火腿肠等10份作为阳性样本,用近缘的禽类鸭肉、鹅肉、鸽子肉;畜类猪肉、牛肉、羊肉、马肉;植物类玉米、大豆、花生等10份为阴性样本,进行PCR扩增。
结果见图2,鸡肉及其制品的阳性样本均有明显的扩增曲线,而其他阴性样本则无扩增曲线,与预期相符。使用上海之江的鸡种特异性基因测定试剂盒具有良好的特异性,与上述物种没有交叉反应,可以忽略基质效应对未知样品检测结果的影响。

图2 20种样本的实时荧光PCR扩增图谱
5 结论
本文通过实例阐述了GB/T 38164-2019《常见畜禽动物源性成分检测方法 实时荧光PCR法》的方法验证。验证结果表明:DNA提取效果良好,不存在抑制剂;该方法重复性较好;基质效应无影响;检出限为0.1%,均满足GB/T 38164-2019的要求。证明实验室可以按照GB/T 38164-2019《常见畜禽动物源性成分检测方法 实时荧光PCR法》开展动物源性成分检测[3],同时本文也为相关检测机构进行方法验证提供了参考。

