高效液相色谱串联质谱法检测枣中吡丙醚和氟啶虫酰胺的残留量
张爱娟,卞艳丽,狄春香,冯义志,马新刚,潘金菊,梁林
(1.山东省农药科学研究院/山东省化学农药重点实验室,山东 济南 250033;2.山东省农村经济管理服务总站,山东 济南 250013)
枣原产我国,栽培面积和产量均居世界首位[1]。枣含有蛋白质、维生素C、氨基酸和微量元素等营养物质,具有较高的食用和药用价值。蚜虫是为害枣树的重要虫害之一,严重影响枣的产量和品质。
吡丙醚是一种保幼激素类似物的新型杀虫剂,具有光稳定性好、高效、对作物安全、对生态环境影响小等特点,对同翅目、缨翅目、双翅目、鳞翅目等害虫具有良好的防治效果[2]。氟啶虫酰胺是由日本石原产业公司研制的一种吡啶酰胺类新型昆虫生长调节剂,具有高效、低毒、内吸性强、持效期长等特点,对蚜虫等吮吸害虫有很好的神经作用和快速拒食活性[3]。目前有关吡丙醚和氟啶虫酰胺残留研究涉及的作物主要有番茄[4,5]、柑橘[6]、蓝 莓[7]、桃[8]、苹 果[9,10]、黄 瓜[11]、草莓[12]等,检测方法主要有液相色谱法、气相色谱法、液相色谱串联质谱法、气相色谱串联质谱法等。吡丙醚和氟啶虫酰胺在我国已取得在枣树上登记使用的资格[13],但我国尚未制定其在枣中的最大残留限量,枣中吡丙醚和氟啶虫酰胺的残留分析方法亦未见报道。本研究采用QuEChERS作为前处理、液质联用的方法对枣中吡丙醚和氟啶虫酰胺的残留量进行测定分析,为吡丙醚和氟啶虫酰胺在枣上的合理使用提供技术支持。
1 材料与方法
1.1 试验仪器与试剂
高效液相色谱质谱联用仪(Agilent 1290Ⅱ-6460),美国安捷伦公司;多管漩涡混合仪(MTV-100),杭州奥盛仪器有限公司;台式通风型离心机(Sorvall ST16),Thermo Fisher;电 子 天 平(AL204),梅特勒-托利多仪器(上海)有限公司。
吡丙醚标准品(纯度99.9%)、氟啶虫酰胺标准品(纯度98.7%),德国Dr.Ehrenstorfer GmbH;C18吸附剂、N-丙基乙二胺吸附剂(PSA)和石墨化碳黑(GCB),天津艾杰尔公司;乙腈(色谱纯)、甲酸(色谱纯),Fisher Chemical;氯化钠(分析纯),天津市科密欧化学试剂有限公司;纯净水,广州屈臣氏食品饮料有限公司;有机滤器(0.22 μm),美瑞泰克科技有限公司。
1.2 试验设计及样品采集
按照农业农村部农药检定所发布的《农药登记残留试验区域指南》[14]选择试验地点:辽宁省大连市、山西省晋中市、宁夏回族自治区银川市、陕西省渭南市、河北省保定市、山东省泰安市、河南省商丘市、湖南省长沙市;枣品种分别为:金丝小枣、梨枣、灵武长枣、冬枣、金丝小枣、大脆枣、泗洪大枣、中秋酥脆枣。
按照《农作物中农药残留试验准则》[15]要求设置试验小区。小区内不少于4株枣树,另设对照小区。设计施药剂量:15%吡丙醚·氟啶虫酰胺悬浮剂2 000倍液(有效成分75 mg/kg);施药次数:1次;施药时期:蚜虫发生初盛期。施药后21、28 d采集枣样品,用随机方法在枣树上、中、下的里、外不同部位至少采集12个点,得到不少于2 kg生长正常、无病害的枣果实。
1.3 试验方法
1.3.1 样品处理 将田间采集的枣样本称重,用不锈钢刀具去掉枣核后,再次称重并记录。将枣肉切碎后充分混匀,用四分法缩分样品,分取150 g两份,装入可封口的样品袋中,贴好标签后立即放入-18℃以下的冰柜中保存。在计算枣中吡丙醚和氟啶虫酰胺的残留量时,以全果(含核)质量计。
准确称取切碎枣肉样品5.0 g至50 mL具塞塑料离心管内,加入5 mL水和10 mL乙腈,2 500 r/min涡旋5 min;加入4 g氯化钠,摇晃1 min;4 000 r/min离心5 min,取上清液约1 mL,转移至装有50 mg PSA的2 mL离心管中,2 500 r/min涡旋1 min;静置后取上清液过0.22μm有机滤膜,待检测。
1.3.2 分析条件 色谱柱:Eclipse Plus C18 RRHD(50 mm×2.1 mm,1.8μm);流动相:0.1%甲酸水溶液+乙腈(30:70,V/V);流速:0.3 mL/min;进样体积:2μL;电喷雾离子源(ESI);反应气:N2;毛细管电压:4 kV;干燥气温度:300℃;干燥气流量:11 L/min;雾化气压:103.4 kPa;采集方式:多反应监测模式,在分析过程中,以保留时间和离子对(母离子和2个子离子)信息比较进行定性分析,以母离子和响应最高的子离子进行定量分析(表1)。
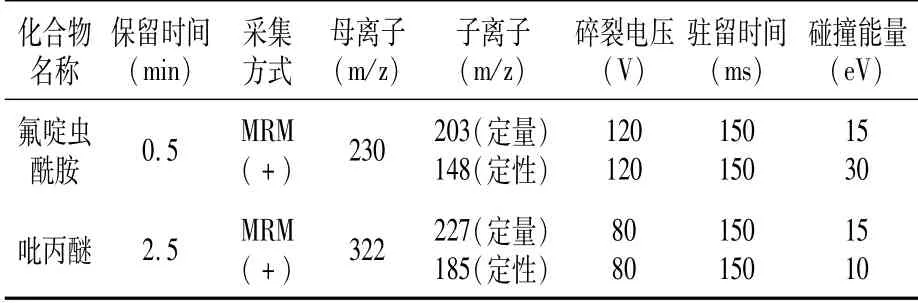
表1 吡丙醚和氟啶虫酰胺质谱信息
1.3.3 标准曲线的绘制 分别准确称取0.0260 g吡丙醚标准品和0.0237 g氟啶虫酰胺标准品至25 mL容量瓶中,分别用乙腈溶解并定容至刻度,配得1 039 mg/L吡丙醚和936 mg/L氟啶虫酰胺的标准储备溶液,置于4℃冰箱中避光保存。将吡丙醚和氟啶虫酰胺标准溶液分别用乙腈和枣空白基质依次稀释配得2.00、1.00、0.50、0.20、0.05、0.01 mg/L溶液,按1.3.2色谱条件进行检测,每个质量浓度重复3次。分别以吡丙醚和氟啶虫酰胺的质量浓度为横坐标、定量离子对峰面积为纵坐标绘制工作曲线。
1.3.4 添加回收试验 在空白枣样品中按照0.02、0.20、1.00 mg/kg添加吡丙醚标准品,按照0.02、0.20、0.90 mg/kg添加氟啶虫酰胺标准品,每个水平5次平行试验。按1.3.1方法进行提取、净化,按1.3.2色谱条件进行检测,测定回收率及相对标准偏差。
2 结果与分析
2.1 方法验证
2.1.1 仪器条件的确立 为获得吡丙醚和氟啶虫酰胺的最佳检测条件,分别用5 mg/L标准溶液,在电喷雾电离ESI(+/-)方式下进行全扫描(100~400 m/z)以选择适当的电离方式和分子离子。结果表明,两种农药在正离子采集模式下的[M+1]峰响应最大,322、230 m/z作为母离子进行产物离子扫描,优化碰撞电压等参数,得出最佳质谱检测参数(表1)。
色谱试验表明,乙腈+0.1%甲酸水溶液作为流动相,体积比为70:30,流速为0.3 mL/min时,氟啶虫酰胺和吡丙醚的保留时间分别为0.5 min和2.5 min,有效成分与杂质得到很好的分离,目标峰峰型对称,基线平稳,无杂质干扰(图1)。分别选用PSA、石墨化炭黑(GCB)和C18作为净化剂,结果表明PSA能较好地去除枣中的糖类和有机酸等干扰杂质,且对目标化合物无干扰,净化效果好。
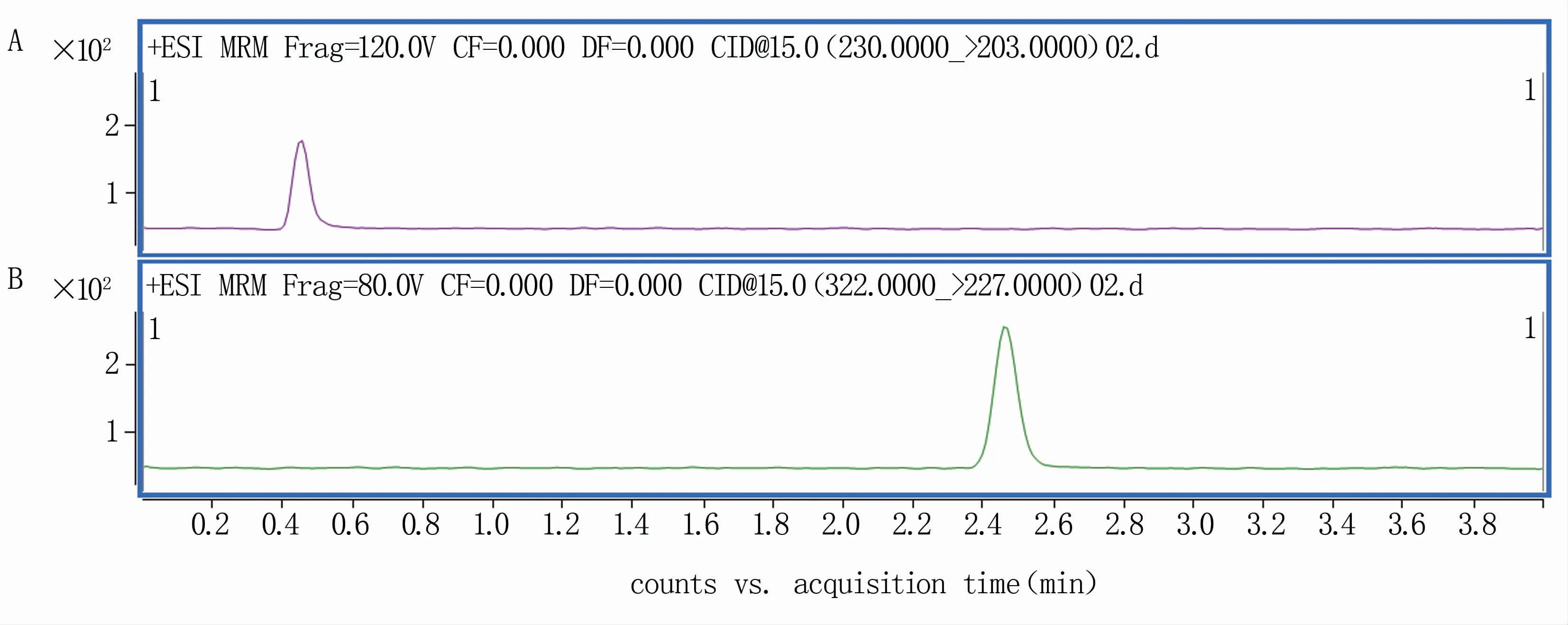
图1 氟啶虫酰胺(A)和吡丙醚(B)定量离子色谱图(均为0.01 mg/L)
2.1.2 线性和基质效应 结果(表2)表明,在0.01~2.00 mg/L范围内,吡丙醚和氟啶虫酰胺在乙腈、枣空白基质溶液中定量离子对峰面积与进样质量浓度间均呈良好的线性关系,相关系数(r)都在0.9981及以上。

表2 吡丙醚和氟啶虫酰胺的线性方程、相关系数、斜率比
本研究采用基质标准曲线斜率和溶剂标准曲线斜率之比(k)来评价基质效应:当k>1.1时为基质增强效应,k<0.9为基质减弱效应,而当k在0.9~1.1之间时为基质效应不明显[16]。结果(表2)表明,吡丙醚在枣中的基质效应不明显,但氟啶虫酰胺在枣中的基质减弱效应非常明显。为保证方法的通用性和适用性,采用基质匹配标准溶液消除基质效应影响。
2.1.3 添加回收试验 本试验通过在枣中添加吡丙醚和氟啶虫酰胺的回收率试验评价方法准确度和精密度。结果(表3)表明:吡丙醚和氟啶虫酰胺在枣中平均回收率分别为100.7%~103.1%和77.3%~96.3%,相对标准偏差分别为1.5%~2.3%和0.8%~4.5%,符合《农作物中农药残留试验准则》(NY/T 788—2018)的要求。吡丙醚和氟啶虫酰胺在枣中的方法定量限均为0.02 mg/kg。
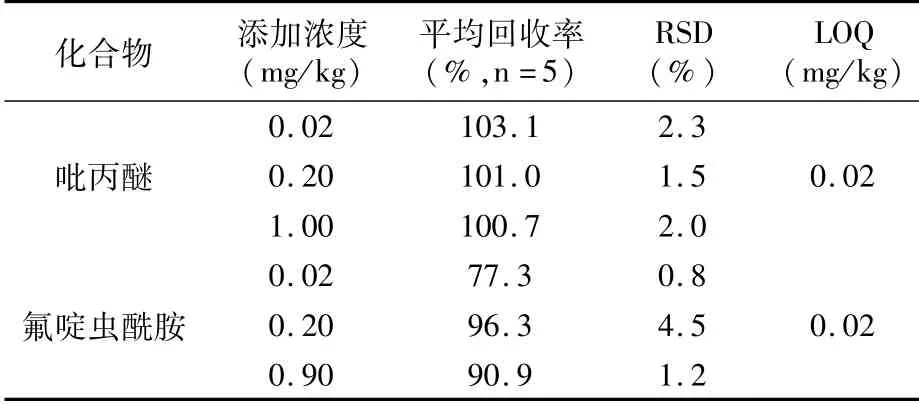
表3 吡丙醚和氟啶虫酰胺在枣中的平均添加回收率、相对标准偏差及方法定量限
2.2 最终残留量
一年八地试验结果表明:15%吡丙醚·氟啶虫酰胺悬浮剂按照75 mg/kg推荐使用剂量在蚜虫发生初盛期喷雾施药1次,施药后间隔21 d和28 d样品中吡丙醚的残留量分别为0.13 mg/kg和0.11 mg/kg;氟啶虫酰胺的残留量分别为0.048 mg/kg和<0.02 mg/kg(表4)。农药在作物中的降解受多种因素影响,降雨、光、热、湿度等物理化学因素都会对农药在植物体内的降解起着重要作用[17,18]。从吡丙醚和氟啶虫酰胺在枣上的最终残留结果来看,枣中吡丙醚和氟啶虫酰胺的残留量总体随采样间隔期的延长而降低。
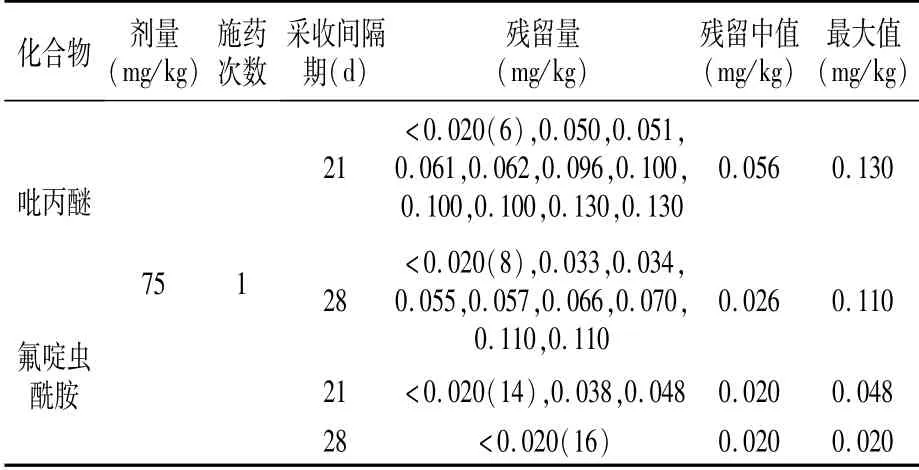
表4 吡丙醚和氟啶虫酰胺在枣中最终残留量
3 讨论与结论
本研究参考QuEChERS前处理方法,建立了HPLC-MS/MS同时检测枣中吡丙醚和氟啶虫酰胺的残留分析方法。结果表明:吡丙醚和氟啶虫酰胺在枣中的平均回收率为77.3%~103.1%,相对标准偏差(RSD)为0.8%~4.5%,在枣中的定量限(LOQ)均为0.02 mg/kg。该方法快速、简单、高效、低成本,可满足农药残留分析要求,适用于大量样品的检测,也可为其他农产品中吡丙醚和氟啶虫酰胺的残留检测提供参考依据。
15%吡丙醚·氟啶虫酰胺悬浮剂按照75 mg/kg推荐使用剂量在蚜虫发生初盛期喷雾施药1次,施药后间隔21 d和28 d采集枣最终样品。结果表明,吡丙醚和氟啶虫酰胺在枣中最大残留量分别为0.13 mg/kg和0.048 mg/kg,明显低于美国规定吡丙醚在核果类水果中的最大残留限量(1 mg/kg)[19]和韩国规定氟啶虫酰胺在枣中的最大残留限量(0.9 mg/kg)[20]。目前,我国尚未制定枣中吡丙醚和氟啶虫酰胺的最大残留限量,本研究结果对制定我国枣中吡丙醚和氟啶虫酰胺的最大残留限量提供了数据参考。

