热量限制对老龄小鼠肝脏铁死亡的抑制作用
张晋毓,田首元,郭志佳
(山西医科大学第一临床医学院麻醉科,太原 030001;*通讯作者,E-mail:chinatsyjj@126.com)
在衰老的诸多机制中,铁死亡是最近研究的一个热点。铁死亡是铁依赖性的新型细胞死亡形式,其实质是铁离子催化作用下代谢发生异常,导致细胞内氧化还原失衡,诱导细胞死亡[1]。热量限制(caloric restriction,CR)是在保证机体功能的前提下,限制每日总热量摄入的一种措施,被证明能减少氧化应激的发生,延缓老龄相关疾病的发生发展[2]。SIRT1是热量限制作用中的一个关键蛋白,通过抑制SIRT1可以影响热量限制的作用效果[3, 4]。目前,国内外尚无铁死亡和热量限制关系的相关报道,本研究主要通过检测铁蛋白、转铁蛋白等来研究热量限制是否对老年小鼠肝脏的铁死亡有作用。
1 材料与方法
1.1 实验动物和分组
18月龄雄性C57BL/6J老龄小鼠24只,体质量(323)g,由山西医科大学实验动物中心提供。小鼠适应2-3 d后,采用数字表法随机将其分为3组(n=8)。自由饮食组(AL组):混合饲料喂养,饮水饲料供应充足,保持垫料干燥;热量限制组(CR组):混合饲料分笼喂养,自由饮食1周,计算平均初始每日食量,以后每2周减少初始食量的10%,6周共减30%,建立热量限制模型[5]。SIRT1抑制剂组(SI组):在热量限制模型的基础上,第7周连续腹腔注射0.3 mg EX-527(SIRT1抑制剂,1652-10,Biovision 公司,美国)1周,1次/d[4]。7周后取肝组织检测指标。
1.2 病理学组织染色
肝脏组织4%多聚甲醛固定24 h,梯度酒精脱水,二甲苯透明,浸蜡,石腊包埋,切片厚5 μm,展片,烤片,二甲苯脱蜡,酒精至水,苏木精-伊红染色,或普鲁士蓝染色25 min,核固红染色10 min,中性树胶封片,显微镜观察肝小叶变化,肝细胞脂肪变情况及肝细胞形态结构变化。400倍镜下随机取40个视野,Image J软件计数铁小粒,取平均值进行统计学分析。
1.3 ROS和GSH含量检测
取0.1 g肝脏组织研磨匀浆,预冷PBS稀释至50倍待用。取100 μl样品稀释液与0.2 μmol/L DCFH-DA荧光染料等体积混合均匀,37 ℃温箱避光孵育15 min。酶标仪激发波长499 nm、发射波长525 nm条件下检测吸光度(A)。用分光光度法检测肝组织ROS、GSH含量。以上操作均按说明书进行。
1.4 FTH、TFR和SIRT1蛋白水平检测
取每只小鼠肝脏组织30 mg,加入400 μl裂解液,离心取上清,BCA法测定蛋白浓度,用裂解液稀释至80 μl,加入20 μl Buffer,95 ℃煮沸5 min。每份样品取5 μl上样量,用SDS-聚丙烯酰胺凝胶电泳,进行湿法转膜,用Western blot检测FTR、TFR、SIRT1的蛋白含量。5%脱脂牛奶室温封闭2 h,分别加入一抗,FTH(1 ∶1 000,YT4302,Immunoway公司,美国)、TFR(1 ∶1 000,UD282772,Invitrogen 公司,美国)、SIRT 1(1 ∶1 000,abx000615,Biovision 公司,美国)、内参甘油醛-3-磷酸脱氢酶单克隆抗体GAPDH(1 ∶1 000,3777R-100, Biovision 公司,美国),4 ℃摇床孵育过夜。TBST洗膜后FTH膜中加入二抗(1 ∶1 000,A21230 Biovision 公司,美国),TFR、SIRT 1、内参甘油醛-3-磷酸脱氢酶单克隆抗体GAPDH膜中加入二抗(A25022,Biovision 公司,美国),室温孵育2 h,洗膜,曝光仪曝光显影。Image J软件测定条带灰度值,通过目的条带与内参灰度值的比值反映相关蛋白的表达。
1.5 统计学处理
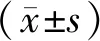
2 结果
2.1 病理学染色观察
HE染色观察到AL组肝小叶结构破坏,肝细胞体积变大,胞浆内可见大量大小不等的脂肪空泡;CR组肝小叶结构基本正常,肝细胞为圆形,细胞核居中,胞浆内少见脂滴,排列方式为条索状且肝窦不狭窄;SI组肝细胞脂滴增多,其病理改变较AL组明显减轻,可见到正常的肝细胞,肝细胞脂肪变性程度较轻(见图1)。普鲁士蓝染色观察铁小粒,与AL组相比,CR组和SI组铁小粒含量显著降低(P<0.05);与CR组相比,SI组铁小粒含量显著增高(P<0.05,见图2,表1)。
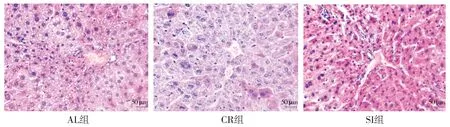
图1 肝脏组织切片HE染色 (×200)Figure 1 HE staining of liver tissue in mice (×200)

图2 肝脏组织切片普鲁士蓝染色 (×400)Figure 2 Prussian blue staining of liver tissue in mice (×400)
2.2 肝组织ROS和GSH含量检测结果
与AL组相比,CR组和SI组ROS含量显著降低(P<0.05),GSH含量显著升高(P<0.05);与CR组相比,SI组ROS含量显著增高(P<0.05),GSH含量显著降低(P<0.05,见表1)。
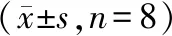
表1 各组小鼠铁小粒、ROS和GSH含量的比较Table 1 Comparison of iron granule,ROS,GSH contents in mice between three
2.3 Western blot分析结果
与AL组相比,CR组和SI组TFR表达量显著减少(P<0.05),FTH表达量显著增多(P<0.05);CR组SIRT1蛋白表达量显著增高(P<0.05),SI组SIRT1蛋白表达量减少(P<0.05)。与CR组相比,SI组TFR表达量显著增多(P<0.05),FTH,SIRT1蛋白显著减少(P<0.05,见图3,表2)。

图3 Western blot检测TRF、FTH、SIRT1和GAPDH蛋白表达Figure 3 The protein expression of TRF, FTH, SIRT1 and GAPDH were detected by Western blot
3 讨论
在衰老的过程中伴随着铁死亡的发生,铁死亡是导致器官衰老的机制之一。热量限制被证明是一个有效的延缓衰老的非药物治疗方法,但热量限制与铁死亡之间是否相关尚无文献报道。本研究发现热量限制通过影响铁代谢相关蛋白及氧化反应而抑制肝脏铁死亡的发生。
铁死亡的特征是铁依赖的脂质过氧化的发生。氧化应激水平是衡量铁死亡程度的主要指标[6]。铁死亡抑制细胞胱氨酸运输蛋白,耗竭胞内GSH;同时,谷胱甘肽过氧化物酶(GPX4)失效[7]造成膜脂活性氧自由基堆积(ROS)。铁死亡过程伴随着FTH含量显著降低[8]和转铁蛋白含量增高[9]。FTH是一种包含24条重链和轻链的多亚基聚合物,通过储存调节细胞铁代谢[10]。TFR则将血中二价铁离子转运至细胞膜,经过TFR受体进入细胞内;干扰TFR表达可降低铁死亡发生。本研究通过检测ROS和GSH含量及FTH、TFR水平,提示热量限制减轻了老年小鼠肝脏铁死亡的程度,可能是通过调节铁代谢途径而实现。
组蛋白去乙酰化酶1(SIRT1)是热量限制的关键蛋白之一,以烟酰胺腺嘌呤二核苷酸(NAD)为辅酶,可通过调控抗氧化酶减少氧化应激的发生,起到延缓衰老的作用[11, 12]。本研究结果发现,使用SIRT1抑制剂EX-527一定程度上促进了铁死亡的发生,验证了热量限制对铁死亡的抑制作用。
综上所述,本研究发现热量限制可以通过调节铁代谢相关蛋白及氧化应激反应显著减轻老龄小鼠肝脏铁死亡水平,SIRT1抑制剂在一定程度上可取消该作用,具体的机制有待进一步研究。

