采用高效液相色谱法测定萘敏维滴眼液中玻璃酸钠的含量
解 钰,许东辉,刘建祯
(山西省食品药品检验所化学药品检测一室,太原 030031)
萘敏维滴眼液是常见的眼用制剂之一,由日本大冢制药公司研发,最早在日本上市,1997年中国大冢制药有限公司获SFDA批准在国内上市(西药第三类),曾用名为“萘扑维滴眼液”。萘敏维滴眼液是由盐酸萘甲唑啉、马来酸氯苯那敏和维生素B12组成的复方制剂[1],临床上主要用于视疲劳综合征、结膜充血以及眼睛发痒、红眼病等[1-5]。
萘敏维滴眼液中含增稠剂玻璃酸钠(sodiun hya-luronate,NaHA),又称透明质酸钠,是广泛存在于动物组织细胞间质中的一种酸性黏多糖,由葡糖醛酸和N-乙酰氨基葡萄糖双糖单位重复连接而成。由于NaHA具有优良的保湿性和润滑性、高度黏弹性以及良好的生物相容性而被广泛应用于临床[6]。NaHA应用于滴眼液制剂中,可以吸收和保持其自身质量上千倍的水分,缓解制剂对眼的刺激,促进眼部创伤的愈合,迅速缓解眼部不适症状,与纤维蛋白结合,促进角膜上皮细胞的修复[7]。
目前NaHA含量测定最常用的方法是改良咔唑法[8]。由于具有己糖醛酸结构的化合物均可与咔唑试剂发生显色反应,从而干扰NaHA的测定,所以改良咔唑法专属性差。查阅文献[9]发现,使用特异性玻璃酸酶对NaHA原料进行酶解,采用高效液相色谱法检测酶解产生的不饱和双糖,可计算得到NaHA的含量,但是该方法溶液稳定性差,酶解反应时间较长(4 h),且未有将该方法应用到检测制剂中NaHA含量的实例。因此,本研究采用高效液相色谱法考察不同溶剂配制对照品溶液的稳定性,考察玻璃酸酶加入量与反应时间的关系,考察制剂中其他组分对NaHA含量测定的干扰,从而探讨将NaHA原料含量测定方法应用到检测制剂中NaHA含量的可靠性。
1 材料与方法
1.1 试剂与仪器
NaHA对照品(Lot:3-BLH-189-1,含量:95.0%)购自加拿大Toronto Research Chemicals Inc;玻璃酸酶(批号:2004171,50 000 IU/ml)购自华熙生物科技股份有限公司;磷酸二氢钠、磷酸为分析纯,购自国药集团化学试剂有限公司;水为实验室自制超纯水。高效液相色谱仪(型号:Agilent 1200)购自美国安捷伦公司;高效液相色谱仪(型号:Ultimate 3000)购自美国戴安公司;电子天平(型号:XS-105 DU)购自瑞士梅特勒-托利多公司;pH计(型号:S40K)购自瑞士梅特勒-托利多公司。
共收集萘敏维滴眼液186批次,涉及17家生产企业;7家生产企业处方中添加了NaHA,涉及69批次样品。
1.2 溶液的制备
1.2.1 对照品溶液 取NaHA对照品,精密称定,加水溶解并稀释制成每1 ml中含NaHA 1 mg的溶液,精密量取1.25 ml,置50 ml量瓶中,加0.3 mol/L醋酸钠溶液(用磷酸调节pH值至6.0)5 ml,加玻璃酸酶750 IU,混匀,置37 ℃水浴中放置1 h,放冷,用流动相稀释至刻度。
1.2.2 供试品溶液 精密量取萘敏维滴眼液适量(约相当于含NaHA 1.25 mg),置50 ml量瓶中,加0.3 mol/L醋酸钠溶液(用磷酸调节pH值至6.0)5 ml,加玻璃酸酶750 IU,混匀,置37 ℃水浴中放置1 h,放冷,用流动相稀释至刻度。
1.2.3 对照品贮备液 取NaHA对照品约0.25 g,精密称定,置50 ml量瓶中,加水溶解并稀释至刻度,摇匀;再精密量取5 ml,置50 ml量瓶中,加0.3 mol/L醋酸钠溶液(用磷酸调节pH值至6.0)25 ml,加玻璃酸酶3 750 IU,混匀,置37 ℃水浴中放置1 h,放冷,用流动相稀释至刻度。
1.2.4 空白溶液 按照在调研过程中从生产企业获得的处方,精密称取维生素B12、盐酸萘甲唑啉、马来酸氯苯那敏等主成分适量,再精密称取甘油、枸橼酸钠、枸橼酸、依地酸二钠、聚山梨酯80、甲基纤维素、薄荷脑、苯扎溴铵、三氯叔丁醇、羟苯乙酯、苯扎氯铵等辅料各适量,按处方量配制不含NaHA的空白溶液。
2 方法与结果
2.1 方法学考察
2.1.1 色谱条件与系统适用性试验 采用Dikma Platisil NH2(4.6 mm×250 mm,5 μm);以0.4 mol/L磷酸二氢钠溶液(取磷酸二氢钠62.4 g,加水溶解并稀释至1 000 ml)为流动相;流速为0.6 ml/min;柱温为35 ℃;检测波长为232 nm;进样量20 μl。理论板数按NaHA的酶解产物不饱和双糖峰计算不低于2 000,不饱和双糖峰与相邻杂质峰的分离度不小于1.5。
2.1.2 专属性试验 精密量取“1.2.4”项下的空白溶液适量,置50 ml量瓶中,加0.3 mol/L醋酸钠溶液(用磷酸调节pH值至6.0)5 ml,加玻璃酸酶750 IU,混匀,置37 ℃水浴中放置1 h,放冷,用流动相稀释至刻度。按照“2.1.1”项下的色谱条件测定,记录色谱图。对照品溶液与供试品溶液出现了相同的不饱和双糖(unsaturated disaccharides)色谱峰,主峰与其他色谱峰分离度良好,空白溶液在相同的保留时间没有出现色谱峰(见图1),说明萘敏维滴眼液中主成分及其他辅料不干扰NaHA的测定。

图1 NaHA的专属性试验Figure 1 Specific test of NaHA
2.1.3 线性关系考察 精密量取“1.2.3”项下对照品贮备液,加流动相稀释成每1 ml中约含NaHA 0.005,0.015,0.025,0.050,0.100 mg的溶液,按照“2.1.1”项下的色谱条件测定,以样品峰面积为纵坐标,样品质量浓度(ρ)为横坐标,进行线性回归,回归方程为Y=21 020ρ+13.432,相关系数r=0.999 1(n=5)。结果表明,NaHA在0.005-0.100 mg/ml内线性关系良好。
2.1.4 精密度试验 精密量取“1.2.1”项下对照品溶液,按照“2.1.1”项下的色谱条件测定,平行进样6次,记录峰面积,分别为599.03,599.01,598.93,598.93,599.00,599.61,RSD为0.4%,小于2%,表明该方法的精密度良好。
2.1.5 稳定性试验 取“1.2.2”项下供试品溶液在室温下放置,分别于0,2,4,6,8,10 h取样,按照“2.1.1”项下的色谱条件测定,记录峰面积,分别为599.03,598.93,599.00,599.18,599.64,600.05,RSD为0.1%,表明供试品溶液在10 h内基本稳定。
2.1.6 重复性试验 取萘敏维滴眼液(山东福瑞达生物医药有限公司,批号:20191114),按照“1.2.2”项下规定的方法平行配制供试品溶液6份,按照“2.1.1”项下的色谱条件进行测定,记录峰面积,计算供试品含量分别为97.90%,98.84%,99.09%,99.87%,98.55%,98.44%,平均值为98.8%,RSD为0.7%,表明该方法的重复性良好。
2.1.7 回收率试验 精密量取“1.2.3”项下对照品贮备液,按处方量加入相应辅料,加流动相稀释成每1 ml中约含NaHA 0.020,0.025,0.030 mg的溶液,按照“2.1.1”项下的色谱条件测定,记录峰面积,计算回收率为99.0%,RSD为0.2%(见表1)。

表1 NaHA回收率试验结果Table 1 The recovery test of NaHA
2.1.8 定量限测定 精密量取“1.2.1”项下对照品溶液逐步稀释,当浓度稀释至测得的NaHA峰高与基线噪音的信噪比为10 ∶1时,计算可得NaHA的定量限为4.0 μg/ml。
2.1.9 耐用性试验 取萘敏维滴眼液(山东福瑞达生物医药有限公司,批号:20191114),按照“1.2.2”项下规定的方法配制供试品溶液,按照“2.1.1”项下的色谱条件测定,采用不同品牌高效液相色谱仪及不同品牌色谱柱进行试验,理论塔板数及分离度良好(见表2),表明该方法耐用性良好。

表2 NaHA耐用性试验结果Table 2 The serviceability test of NaHA
2.2 萘敏维滴眼液中NaHA含量的测定
2.2.1 玻璃酸酶加入量考察 参考文献[9]中的方法考察玻璃酸酶的加入量,取NaHA 5 mg,加玻璃酸酶150 IU,加0.3 mol/L醋酸钠溶液(pH6.0)5 ml,加流动相稀释至100 ml,置37 ℃水浴中放置,每隔1 h取样,测定NaHA的峰面积,绘制酶解反应曲线。结果显示,NaHA酶解液的峰面积在3 h时达到最大值,4 h后峰面积不再增加,表明NaHA已完全降解为不饱和双糖。但在实际工作中,4 h反应时间略长,经考察,将玻璃酸酶增加为原加入量的10倍,同法操作,绘制酶解反应曲线,结果显示,NaHA在1 h时即可反应完全(见图2),改良后的溶液制备方法有效缩短了反应时间,提高了检验效率。

图2 玻璃酸酶对玻璃酸钠的酶解反应曲线Figure 2 The enzymolysis curves of sodium hyaluronate by hyaluronidase from Streptococcus zooepidemicus
2.2.2 NaHA含量测定结果 取7家企业的69批次样品,按“1.2.2”项下的方法制备供试品溶液,按照“2.1.1”项下的色谱条件测定,以外标法计算NaHA的含量,并将测定值与处方量进行比较。结果显示:A、B企业样品中NaHA的实测值与处方量存在较大差异(见表3)。
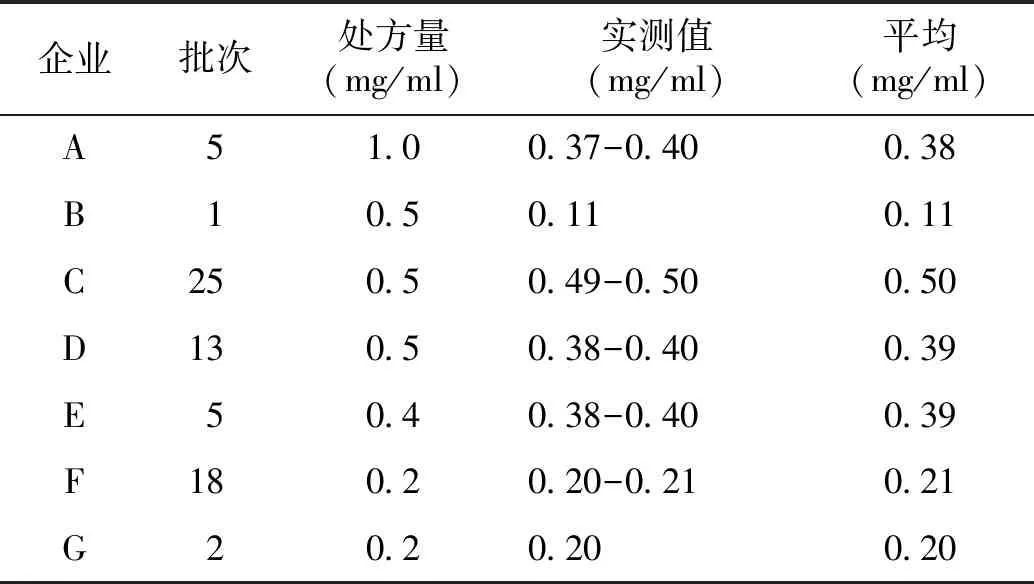
表3 NaHA含量测定结果Table 3 The contents of NaHA in samples from different manufacturers
7家企业中,A企业的NaHA原料购自原料企业H,B企业及其余5家企业的NaHA原料购自原料企业I。采用“2.1.1”项下的色谱条件测定两家企业生产的原料,结果显示,企业H的含量为62.7%,企业I的含量为92.0%。
若A、B企业在生产时误将NaHA原料的实际纯度当作理论纯度100%进行投料,折算其理论加入量,见表4。

表4 NaHA原料理论加入量 (mg/ml)Table 4 The theoretical added amount of NaHA raw materials (mg/ml)
结果显示,样品实测值仍低于折算后的理论加入量,表明A、B企业涉嫌未按药品注册时的处方工艺进行投料与生产。
3 讨论
与动物组织提取的玻璃酸酶不同,Streptococcus zooepidemicus产生的玻璃酸酶可以把NaHA降解为不饱和双糖[10,11]。按照参考文献选用反应介质0.3 mol/L醋酸钠溶液(pH6.0)作为溶剂配制对照品溶液时,考察10 h内NaHA的峰面积降低,溶液稳定性较差[9]。本试验改用水作为溶剂,考察10 h内NaHA的峰面积未见明显变化,该溶液稳定性良好。
分别采用本实验方法和咔唑法测定原料企业H和I的NaHA原料,结果显示两种方法测得的企业H原料含量偏差高达30.1%。分析其原因,可能是产品中混入其他可发生咔唑反应的化合物如硫酸软骨素等,导致咔唑法测定结果偏高。本实验所用的玻璃酸酶只有特异性酶解NaHA,通过检测酶解产生的不饱和双糖计算NaHA的含量,因此具有很高的专属性,测定结果不被样品中其他成分影响,可更准确地控制NaHA原料的质量。
改良后的新方法操作简便、结果准确、专属性强,可用于萘敏维滴眼液中NaHA的含量测定。对7家企业生产的69批次萘敏维滴眼液进行检测,结果有2家企业样品中NaHA含量偏低,表明生产企业涉嫌未按药品注册处方进行投料。本试验对规范企业生产行为,加强药品市场监管起到有效作用。

