UPLC-TOF-MS与网络药理学联合探讨人参改善胰岛素抵抗的作用机制*
殷怡帆,罗朵生**,郭 姣
(1.广东药科大学广东省代谢病中西医结合研究中心 广州 510006;2.广东药科大学广东省代谢性疾病中医药防治重点实验室 广州 510006)
胰岛素抵抗(Insulin resistance,IR)是指胰岛素促进葡萄糖摄取的作用降低而胰岛素的补偿性分泌增加的状态,与非酒精性脂肪性肝病、2型糖尿病、代谢综合征等代谢性疾病密切相关[1]。人参是五加科植物人参PanaxginsengC.A.Mey.的干燥根及根茎,中药人参制剂对胰岛素抵抗干预效应的Meta分析发现,联合使用中药人参制剂能显著改善胰岛素抵抗和血糖水平[2],但其具体机制尚不明确。因此,进一步阐明人参改善胰岛素抵抗作用的药效成分及作用机制对扩大人参应用范围、开发防治胰岛素抵抗药物具有重要意义。但人参成分复杂,作用靶点较多,如何阐明其多成分、多靶点、多环节的作用特点是目前面临的瓶颈问题之一。
利用计算机科学、分子生物学、药学等学科的成果,网络药理学可以全面阐明中药多成分、多靶点、多环节的功能特点。本研究采用UPLC-TOF-MS分析人参化学成分,结合网络药理学方法,解析人参改善IR的潜在活性成分、作用靶点及机制,以期为非酒精性脂肪性肝病、2型糖尿病、代谢综合征等代谢性疾病临床干预治疗提供新的思路。
1 仪器与材料
超高效液相色谱分析系统(Agilent公司,美国),高分辨四级杆与飞行时间串联质谱仪(Agilent公司,美国)、C18色谱柱(ACQUITY UPLC CSH,2.1 mm×100 mm,1.7μm),超声波清洗器(DL-360A,50 Hz,400 W,上海之信仪器有限公司),低温高速离心机(FRESCO17,Thermo公司,美国),甲醇,乙腈(Merck公司,德国),超纯水(屈臣氏),人参(购自长白工坊科贸有限公司)[3]。
2 方法
2.1 化学成分分析
称取人参药材粉末0.3 g,加入50 mL 60%甲醇溶液,超声提取1 h,离心5 min(转速12000 rpm,温度20℃),取上清液待测。进样量:5μL;流速:0.3 mL·min-1;柱温:40℃;二元梯度洗脱,流动相A为水,B为乙腈;梯度洗脱条件如下(表1)。质谱条件参考文献报道[4],质谱条件:电喷雾离子源正离子模式(ESI+):毛细管电压(capillary):2800 V,锥孔电压(samplecone):20 V,离子源 温(source temperature):100℃,脱 溶 剂 温 度(desolvation temperature):350℃,脱溶剂N2体积流量为500 L/h,锥孔反吹N2体积流量为50 L/h,脱溶剂气为N2,碰撞气体为Ar。

表1 超高效液相梯度洗脱分析人参的条件
根据质谱所得,结合文献报道,通过分析化合物的准确分子量,筛选出人参的主要化学成分。
2.2 活性成分靶点预测
具体预测流程参考本团队的报道[3],概述如下:将上述获得成分上传至PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)中查询SMILES号。将获得的SMILES号上传至Swiss Target Prediction数据库(http://www.swisstargetprediction.ch),点击预测成分作用靶点即可进行分析,输出化合物靶点信息。把靶点导入Uniprot数据库(https://www.uniprot.org/uploadlists)中,进行批量标准化审核(物种选择 “Homo Sapiens” )。将审核得到的人参主要活性成分的靶点与CTD数据库(http://ctdbase.org)、GeneCards(https://www.genecards.org)中胰岛素抵抗有关的作用靶点进行对比,筛选潜在靶点。
2.3 疾病靶点关系网络构建
将靶点导入String数据库(https://string-db.org),选择多种蛋白质进行分析,物种选择为 “Homo Sapiens” ,得到蛋白相互作用关系;将相关数据导入到Cytoscape软件中,根据分值和节点度值设置节点和边缘的大小、颜色和粗细,得到目标蛋白互作网络图。
2.4 生物学功能和通路分析
将筛选出的人参改善胰岛素抵抗作用潜在靶点输入DAVID数据库进行生物学过程和通路分析。将来源于数据库DAVID的富集分析结果导入数据库imageGP,然后使用插件 “MCODE” 对分析结果的生物过程进行聚类分析。
2.5 人参活性成分靶点通路关系网络构建
将上述获得人参活性成分、疾病靶点、作用通路数据导入Cytoscape 3.6.1软件中构建人参活性成分靶点通路关系网络图。
2.6 分子对接验证
具体对接验证流程参考本团队的报道[3],概述如下:选择人参活性成分靶点通路关系网络图中节点度值排行前4的疾病靶点,从RSCB PDB数据库(https://www.rcsb.org/)下载3D结构,并用AutoDock软件移除水分子和配体后保存为PDBQT文件。从PubChem数据库下载人参成分2D结构,利用PyRx软件最小化其能量后也保存为PDBQT文件,运用Vina对接,配体与受体可自发结合时其结合能小于0。
3 结果
3.1 人参化学成分
超高效液相色谱四极杆飞行时间混合质谱(Ultra performance liquid chromatography quadrupole-time-offlight hybrid mass spectrometry,UPLC-Q-TOF-MS)是一种高分辨率的选择性灵敏技术,适用于复杂药物活性成分分析。本文采用UPLC-Q-TOP-MS分析人参的化学成分,结果显示主要有52个色谱峰(图1),通过化合物m/z信息,并结合文献对比,得到41个已知化合物(表2)。

表2 人参化学成分表

图1 人参化学成分分析总离子流图
3.2 人参活性成分靶点信息
将潜在活性成分的SMILES信息上传到Swiss Target Prediction数据库,得到4350个靶点,经过筛选去重后得到667个靶点。将靶点导入Uniprot数据库中进行批量标准化,下载审核过的614个靶点。在疾病数据库搜索与IR相关的靶点,对比得到26个改善IR的潜在作用靶点,主要包括AKT1、AKT2、ALB、BCL2、CASP3等(表3)。

表3 化学成分潜在靶点
3.3 疾病靶点关系网络构建
通过String数据库得到疾病靶点关系网络图(图2)。该网络图中包含有26个靶点、198条边,度值越大,节点颜色大小越显著,而综合得分数值越大,边颜色越深、越粗。图中节点度值较大的蛋白质为AKT1、MAPK3、MAPK1、PPARG、VEGFA,表明人参改善IR可能通过多个靶点联合共同发挥作用。

图2 疾病靶点关系网络图
3.4 生物学功能注释
人参改善IR潜在靶点GO生物学功能分析表明,GO分析有3个分支,为生物过程、细胞组分和分子功能。在气泡图右侧用圆形、三角形和正方形分别表示生物过程、细胞组分和分子功能。Qvalue值表示富集的显著性,颜色由绿到红显示,富集程度越高,颜色越红,Qvalue值越大。气泡的大小则显示富集到此生物学功能的基因数量,富集的基因数量越多,气泡越大。结果显示(图3),人参在改善胰岛素抵抗的生物过程中主要富集到积极调控细胞迁移,对内源性刺激的反应,对激素刺激的反应,对有机物质的反应,高分子代谢过程的正调控等;细胞组分富集到细胞外空间、胞质溶胶、微粒体、囊泡分数等;分子功能中富集到胰岛素受体底物结合、类固醇激素受体活性胰岛素样生长因子结合、配体依赖性核受体活性等生物学过程。

图3 GO富集图
生物分子主要通过相互作用模块组成的分子网络工作[22],因此有必要对GO生物过程进行模块分析,根据MCODE聚类分析算法筛选出9个K-Core≥2的聚类模块(图4),其中生物过程越重要,连接节点的边就越多,节点越大。依次是脂质代谢过程、离子稳态、生物种间相互作用、免疫系统过程、多细胞生物繁殖、核膜组织、分子功能的正调控/转录因子活性的调节、细胞内蛋白运输的调节、脂肪酸代谢过程等生物过程。

图4 潜在靶点GO生物过程模块分析子簇图
3.5 靶点通路注释分析
有20条通路被富集,主要涉及内分泌系统与免疫系统:胰岛素信号通路(Insulin signaling pathway)、Toll样受体信号通路(Toll-like receptor signaling pathway)、T细胞受体信号通路(Tcell receptor signalingpathway)、B细胞受体信号通路(Bcell receptor signalingpathway)、FcεRI信号通路(Fc epsilon RIsignaling pathway);物质代谢:mTOR信号通路(mTOR signaling pathway);神经系统:神经营养蛋白信号通路(Neurotrophin signaling pathway);II型糖尿病、癌症等(图5)。表明人参改善胰岛素抵抗的靶点分布在多条通路中,从而协调发挥作用。

图5 靶点通路富集分析
3.6 人参活性成分靶点通路关系网络图
构建的成分靶点通路关系网络图中有87个节点,包括41种成分、26个靶点、20条通路和361条边(图6)。节点度值越大,说明与其相连的节点数越多,产生作用越大。其中人参二醇、人参皂苷Rg1、人参皂苷Rk1、人参皂苷Rh7和人参二酮等节点度值较大,表明其作用靶点多。图中MAPK1、VEGFA、PIK3R1、NR3C1、JUN等靶点节点较大,可能成为药物作用的靶点。癌症、FcεRI信号通路、II型糖尿病等通路的节点较大,表明人参改善胰岛素抵抗与上述相关通路有关。
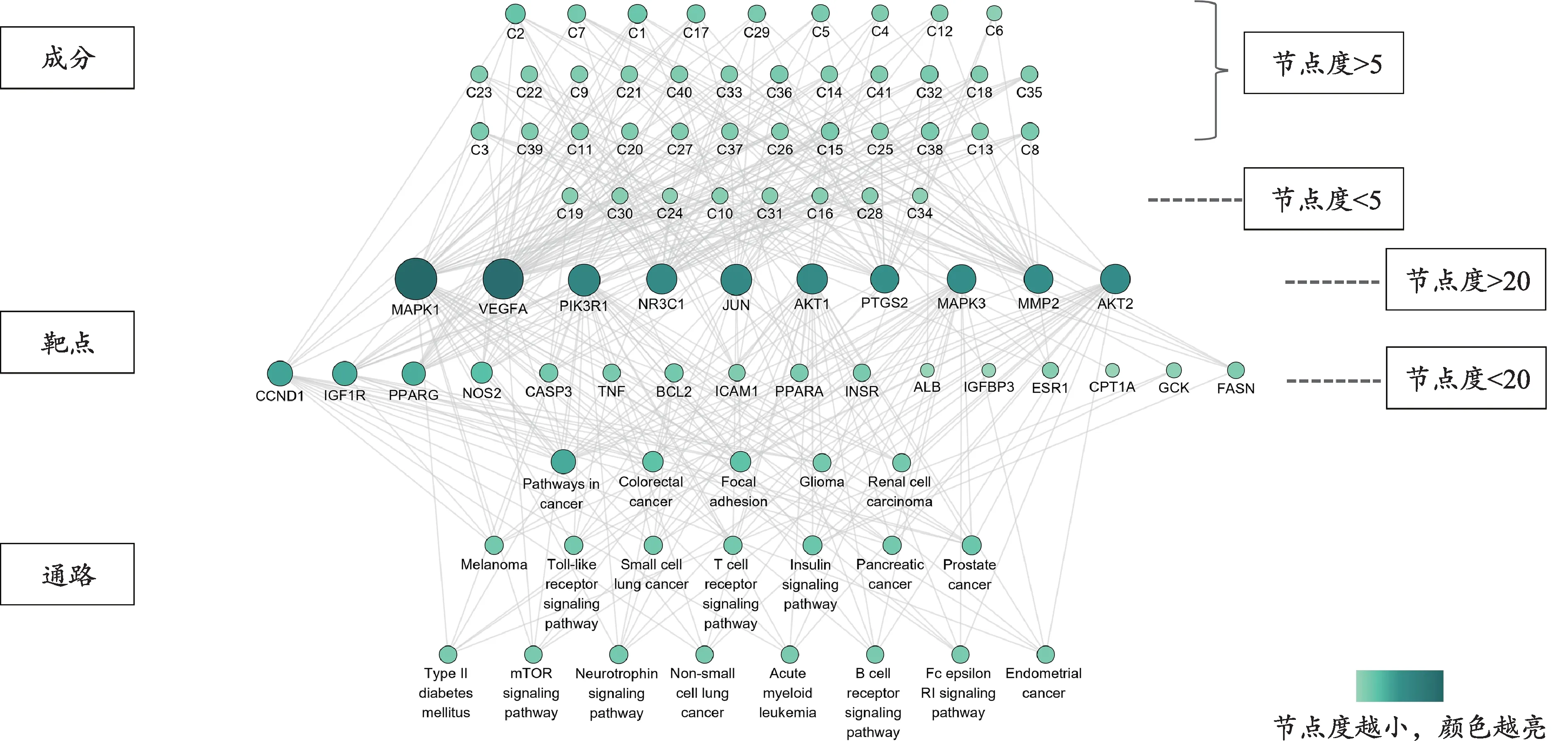
图6 人参活性成分靶点通路关系网络图
3.7 分子对接
选择图6中度值排名前4的靶点MAPK1(PDBID:6SLG)、VEGFA(PDB ID:5DN2)、PIK3R1(PDB ID:5GJI)、NR3C1(PDBID:5E69)与度值较大的19种成分进行对接(表4)。分子对接的结合能越小,说明活性成分与靶点的结合活性越高。结果显示,与MAPK1结合能最低的化合物为25-羟基原人参二醇(结合能为-7.9 kJ·mol-1),与VEGFA结合能最低的化合物为人参皂苷Rd(结合能为-9.5 kJ·mol-1),与PIK3R1结合能最低的化合物为人参皂苷Rg1(结合能为-7.7 kJ·mol-1),与NR3C1结合能最低的化合物为人参二酮(结合能为-8.1 kJ·mol-1)。以结合能≤-5.0 kJ·mol-1为筛选标准,人参中主要化学成分与主要靶点MAPK1、VEGFA、PIK3R1、NR3C1的结合能均小于-5.0 kJ·mol-1。由此可见,人参的主要化学成分与胰岛素抵抗疾病蛋白形成构象能量低,结构稳定,结合活性较高。

表4 分子对接结果
4 讨论
以 “人参” 为关键词,通过CNKI检索2009年-2019年发表的文献共计有5627篇,可见人参是研究热点。以往对人参药效学及作用机制的研究多集中在免疫调节、心脑血管病等领域,如抗疲劳、心肌缺血、动脉粥样硬化等,对人参改善胰岛素抵抗的网络药理学研究尚未见报道。胰岛素抵抗是非酒精性脂肪性肝病、2型糖尿病、代谢综合征等代谢性疾病发生的关键环节,而人参可显著改善胰岛素抵抗和血糖水平,但其具体机制尚不明确,使人参应用于代谢性疾病治疗的作用未得到充分发挥。因此,为推动人参治疗代谢性疾病的药效物质基础和作用机制研究,本研究对实验结果进行探讨。
4.1 人参改善IR活性成分
结合图6,本研究中发现人参二醇、人参二酮、人参皂苷Rg1、人参皂苷Rk1、人参皂苷Rc、人参皂苷RD、人参皂苷Re、人参皂苷Rb1等主要成分参与改善胰岛素抵抗。人参皂苷主要分为人参二醇皂苷和人参三醇皂苷,两者构型不同,但可协同发挥作用[23]。
人参二醇型皂苷主要包括人参皂苷Rb1、Rk1、Rg3、Rg5等。研究发现人参二醇型皂苷可显著降低2型糖尿病大鼠游离脂肪酸水平,改变细胞膜流动性促进胰岛素结合,降低肝糖原分解,从而改善胰岛素抵抗[24]。将50μmol·L-1人参皂苷Rk1和Rg5混合物作用于3T3-L1胰岛素抵抗细胞模型,能有效增加该细胞对葡萄糖的摄取,改善胰岛素抵抗[25]。人参皂苷Rg3糖苷能升高db/db糖尿病大鼠血液中胰岛素含量,降低血糖[26]。人参皂苷Rb1能上调PPARG的表达,增加葡萄糖向细胞内的转运从而改善胰岛素抵抗[27]。
人参三醇型皂苷主要包括人参皂苷Re、Rg1等。人参皂苷Re通过减轻胰岛素刺激引起的GLUT4易位损伤,迅速改善高脂饮食大鼠肌肉的胰岛素抵抗[28]。人参皂苷Rg1能降低糖尿病大鼠肝组织TLR4蛋白阳性细胞百分比,抑制氧化应激反应,降低血糖水平[29]。
因此,本研究将UPLC-TOF-MS与网络药理学联合,能够间接预测人参改善胰岛素抵抗的活性成分,为其有效成分筛选提供参考。
4.2 人参改善IR潜在作用靶点
分析靶点蛋白互作网络图可见,c-Jun氨基末端激酶(JNK)、蛋白激酶B 1(AKT1)、磷脂酰肌醇-3激酶受体1(PIK3R1)、血管内皮生长因子A(VEGFA)、过氧化物酶体增殖因子活化受体γ(PPARG)等靶点是胰岛素抵抗互作网络中主要靶点。JNK的缺失对肥胖引起的胰岛素抵抗产生保护作用,炎症因子TNF-α和FFAs4浓度升高激活JNK,进而磷酸化Ser 307处的IRS-1,这是肥胖引起的胰岛素抵抗的关键因素[30]。激活PI3K-Akt信号通路,活化的AKT调节Fox O1和GSK3等一系列下游分子,增加糖原的生成,调控脂肪酸合成基因及糖异生基因的表达。同时也有研究发现增加GLUT4蛋白表达,有效降低AKT1对胰岛素信号传导的负反馈调节,从而增加葡萄糖的利用率,提高细胞的葡萄糖转运能力,改善胰岛素抵抗[31,32]。VEGFA的转录因子miRNA-93过表达,与GLUT4 3'UTR末端位点结合,抑制GLUT4蛋白的转录翻译和表达,降低胰岛素敏感性[33]。PPARG是脂肪细胞基因表达和胰岛素细胞间信号转导的主要调节者,介导细胞内胰岛素信号转导,参与脂肪细胞分化和糖脂代谢的调节[34]。因此,JNK、AKT1、PIK3R1、VEGFA、PPARG与改善胰岛素抵抗机制密切相关。
本研究发现人参皂苷Rg1、人参皂苷Rb1、原人参三醇和人参皂苷Re等成分可与VEGFA、PIK3R1、JUN、PPARG等靶点互相作用,提示这些成分为人参改善胰岛素抵抗的关键活性成分。本研究通过网络药理学预测出人参改善胰岛素抵抗的潜在作用靶点,为后期进一步研究人参改善IR的作用机制提供启示。
4.3 人参改善IR分子机制
本研究发现人参改善IR作用与mTOR信号传导通路、Toll样受体信号传导通路和胰岛素受体通路等关系密切。
4.3.1 mTOR信号传导通路
mTOR信号通路是PI3K/AKT的重要下游通路,在IR中发挥重要作用。胰岛素与靶细胞的胰岛素受体结合后磷酸化其受体底物的酪氨酸残基,使PI3K/Akt信号通路激活,增加肝脏、肌肉、脂肪等组织对葡萄糖的摄取。当机体糖代谢紊乱时,循环中的高糖毒性会过度激活靶细胞内PI3K/Akt/mTOR信号通路,引起泛素-蛋白酶系统降解IRS1和IRS2,加重胰岛素抵抗[35]。
4.3.2 Toll 4受体信号
Toll样受体(Toll-like receptors,TLR)是一种单跨膜非催化蛋白,能识别突破皮肤、粘膜等身体物理屏障的微生物,并激活身体产生免疫细胞反应。在非特异性免疫和特异性免疫中均发挥重要作用。最新研究表明,TLR4信号通路激活后,可通过MyD88信号通路激活NF-κB通路,启动多种炎症因子的转录和翻译,介导机体的炎症反应,最终导致组织器官损伤[36]。
4.3.3 胰岛素通路
已有文献报道PIK3R1和PPARG与葡萄糖转运、胰岛素敏感性等密切相关。路鑫鑫等[37]研究发现人参皂苷通过增加PI3K的表达,从而上调PI3K信号通路来逆转胰岛素抵抗,而PI3K-AKT通路为胰岛素受体通路的主要下游信号通路。PPARG主要对脂类进行分解代谢,除此以外还与多种疾病如糖尿病、动脉硬化和癌症等相关,人参皂苷Rb1直接激活PPARG,对胰岛素信号传导途径具有直接作用[27]。
综上,本文首先采用UPLC-TOF-MS分析人参主要化学成分,然后运用网络药理学的方法解析其改善IR作用的可能靶点及机制,并通过分子对接技术进一步验证,发现人参的主要活性成分人参皂苷Rg1、人参皂苷Rd、人参二酮和25-羟基原人参二醇等活性成分作用于MAPK1、VEGFA、PIK3R1、NR3C1等多个靶点,参与脂质代谢、离子稳态、免疫系统等生物过程,调节mTOR信号传导通路、Toll样受体信号传导通路和胰岛素受体通路从而发挥改善胰岛素抵抗作用,为进一步开展系统的人参改善胰岛素抵抗作用机制研究和临床开发应用提供理论依据。同时,也为下一创新性研究提供线索和启示。
本研究也存在一些不足。受限于数据库中数据的全面性,获得的靶点可能不够精确,如能对预测的活性成分和靶点进一步验证将更有说服力。

