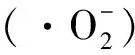稀土卤氧化物Bi2MO4Cl (M=Nd, Eu, Gd)材料的制备及光催化性能
韩 妮,顾 妍,张勤芳*
(1.江苏大学材料科学与工程学院,江苏 镇江 212013;2.盐城工学院材料科学与工程学院,江苏 盐城 224051)
随着工业的快速发展,废水和气体污染物排放量迅速增加,对环境产生了极大影响,并且减少了可利用的淡水资源[1-2]。然而传统的污水处理方案效率低下,成本高昂,同时可能对环境造成二次污染。半导体光催化剂材料因易制备、成本低、环境友好等优点,在污水处理和降解有机染料方面具有不可估量的优势[3]。但传统的光催化剂TiO2由于禁带宽度较大,仅能吸收占太阳光5%的紫外光,并且量子效率较低,制约了其实际应用。同时,有研究表明TiO2对人体有害,如果摄入过量会增大致癌概率[4]。Bi系光催化材料具有良好的可见光光催化活性,因此拥有巨大的研究价值和应用价值[5-6]。Bi 系光催化材料在可见光下响应能力主要取决于其带隙大小。Bi系光催化材料具有层状结构,会形成内建电场,由于电场力的作用,导致电子加速即促进了光生载流子的分离,抑制了复合过程, 有利于提高光催化效率[7-9]。
稀土卤氧化物Bi2MO4Cl (M=Nd,Eu,Gd等)作为一种新型铋基光催化剂,与传统光催化剂相比禁带宽度较窄,可吸收占太阳光43%的可见光部分,量子效率也略有提高,表现出较好的光催化性能。本文通过固相法制备Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl三种光催化剂,采用X射线衍射、场发射扫描电镜和紫外可见分光光度计等对其表征分析。并以亚甲基蓝为目标污染物研究其光催化活性。
1 实验部分
1.1 样品制备
将适量Bi(NO3)3·5H2O溶于乙二醇溶液中,室温下磁力搅拌至完全溶解,记为溶液A;将适量KCl溶于去离子水中,记为溶液B;将溶液B以每秒2~3滴的速度滴加至溶液A中,常温磁力搅拌1 h;将反应后的溶液抽滤和洗涤三次,60 ℃干燥得BiOCl前驱体。将Bi2O3、BiOCl、M2O3(M=Nd,Eu,Gd)按照物质的量比1∶2∶1混合并研磨;混合粉体置于坩埚中,在马弗炉中800 ℃下煅烧4 h。然后进行二次研磨和煅烧,得到Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl光催化剂。
1.2 样品表征
使用X’ Pert3 Powder 型X射线衍射仪分析样品晶体结构和组成,CuKα,2θ=10 ~ 80°。通过Nova Nano SEM 450场发射扫描电子显微镜(FE-SEM)测试样品的形貌和表面结构。紫外-可见漫反射光谱在日本岛津公司UV-2550紫外-可见光谱仪上测试。采用北京中教金源科技有限公司 CEL-HXF300 型氙灯光源,使用滤波片排除入射光中的紫外光,以获得可见光。
1.3 催化剂性能评价
Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl光催化剂性能在300 W氙灯的照射下以亚甲基蓝为目标污染物进行测试。将光催化剂(100 mg) 分别分散到100 mL的MB水溶液中,在暗室中搅拌30 min达到吸附-脱附平衡。然后将悬浮液转移到具有水循环系统的反应器中,移除光的热效应,并在反应器顶部固定300 W的氙灯作为可见光光源。光照每间隔15 min取4 mL溶液,离心后,在紫外-可见光谱仪上测试其浓度变化。
2 结果与讨论
2.1 XRD
图1为不同光催化剂的XRD图。从图1可以看出,各个样品特征峰分别与Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl标准卡片 (ISCD #92399、92401和92402)的特征衍射峰相对应,说明三种目标化合物均已成功合成[10-12]。三种催化剂的特征衍射峰均比较尖锐,说明Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl的结晶度和纯度都较高。

图1 光催化剂Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl的XRD图Figure 1 XRD patterns of the as-prepared Bi2NdO4Cl,Bi2EuO4Cl and Bi2GdO4Cl
2.2 SEM
图2为光催化剂Bi2GdO4Cl的微观形貌照片。从图2可以看出,光催化剂Bi2GdO4Cl主要呈现不规则块状结构,表面粗糙,且尺寸较大,也有一些呈层片状结构,依附于块状结构的表面。这些结果表明,Bi2GdO4Cl具有较高的光催化活性与其呈现出层状结构以及表面较粗糙有关。

图2 样品Bi2GdO4Cl的扫描电镜照片Figure 2 SEM images of the as-prepared Bi2GdO4Cl samples
2.3 光学性能分析
紫外-可见光漫反射光谱可用来揭示光催化剂Bi2GdO4Cl对光的吸收能力。如图3(a)所示,Bi2GdO4Cl样品可以吸收可见光,吸收边缘位于550 nm处,说明光催化剂Bi2GdO4Cl可以吸收的可见光范围较广,并且吸收强度较高,这有利于提高光催化性能。Bi2GdO4Cl的光学带隙能 (Eg)由Tauc公式计算:(αhυ)=A(hυ-Eg)n/2, α, h, ν和A分别代表吸收系数,普朗克常数,光频率和常数[13]。由于Bi2GdO4Cl是间接带隙半导体,因此n等于4[11]。如图3 (b)可知Bi2GdO4Cl的Eg约为2.40 eV。

图3 样品Bi2GdO4Cl的紫外-可见光漫反射光谱 (a)和(αhυ)1/2 与 hυ计算得出的带隙(Eg) (b)Figure 3 UV-vis diffuse reflectance spectra of Bi2GdO4Cl (a) and (αhυ)1/2 vs. hυ calculated band gap (Eg) (b)
2.4 光催化剂性能分析
在可见光照射下,不同光催化剂催化降解亚甲基蓝随时间变化曲线见图4。在光照前,将亚甲基蓝溶液和光催化剂样品分别在暗室中搅拌30 min达到吸附-脱附平衡,此过程对降解效果几乎没有影响。
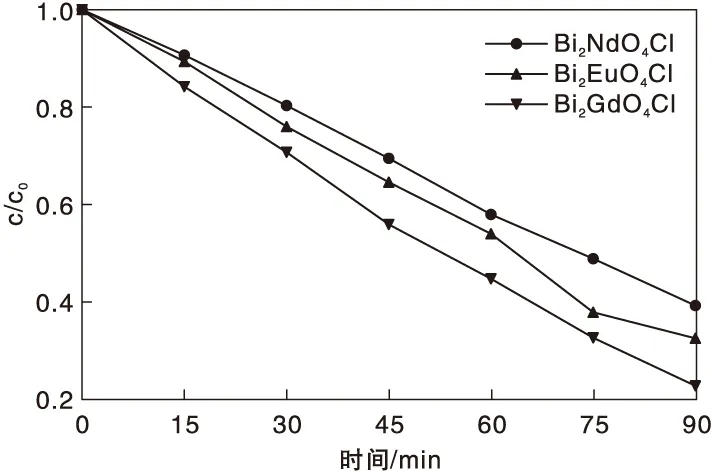
图4 可见光照射下,Bi2NdO4Cl、Bi2EuO4Cl和Bi2GdO4Cl催化降解亚甲基蓝随时间变化曲线Figure 4 The content of methylene blue (MB) catalyzed by Bi2NdO4Cl,Bi2EuO4Cl and Bi2GdO4Cl changed with time under visible light irradiation
从图4可以看出,可见光照射90 min后,亚甲基蓝浓度明显降低。光催化剂Bi2GdO4Cl的催化降解效率高于其他两种光催化剂。这是因为Bi2GdO4Cl的可见光吸收范围较广,吸收强度较高,有利于提高其催化效率。
图5为在可见光照射下,光催化剂Bi2GdO4Cl催化降解亚甲基蓝过程中的紫外-可见吸收光谱。
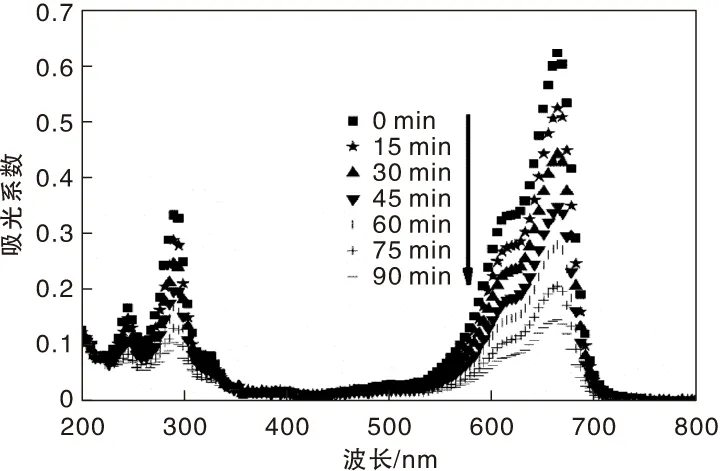
图5 光催化剂Bi2GdO4Cl催化降解亚甲基蓝的紫外-可见吸收光谱Figure 5 UV-vis absorption spectra of MB during the photodegradation reactions over Bi2GdO4Cl
从图5可以看出,随着光照时间的增加,亚甲基蓝在最大吸收波长670 nm处的特征吸收峰逐渐降低。当可见光照射90 min后,亚甲基蓝基本被降解。这间接表明有机污染物亚甲基蓝的环状结构被破坏并完全分解为小的有机和无机分子CO2, H2O等。综上可见,采用固相法制备的 Bi2GdO4Cl拥有较好的光催化性能。
2.5 光催化反应机理分析


图6 Bi2GdO4Cl在不同捕获剂存在下催化降解亚甲基蓝Figure 6 The degradation of MB catalyzed by Bi2GdO4Cl in the presence of different trapping agents
根据以上结果,提出了Bi2GdO4Cl光催化降解亚甲基蓝可能的光催化机理,如图7所示。

图7 在可见光照射下Bi2GdO4Cl的光催化降解机理Figure 7 Photocatalytic degradation mechanism of Bi2GdO4Cl under visible light irradiation
在可见光照射下,光催化剂Bi2GdO4Cl被大于其带隙的太阳光激发。使得光生电子从其价带(VB)跃迁到导带(CB)上,在Bi2GdO4Cl的价带上留下空穴。其价带上积聚的空穴将OH-氧化为·OH。同时,Bi2GdO4Cl导带上过量的电子和价带上过量的空穴分别迁移到其表面。在h+和·OH自由基两种活性物种的共同作用下,降解亚甲基蓝的光催化活性得到了明显提高。这是由图6中的活性物种捕获实验结果所支持的。催化降解过程中如下所示:
Bi2GdO4Cl+hν→ Bi2GdO4Cl (h++e-)
(1)
Bi2GdO4Cl(h+)+H2O/OH-→ Bi2GdO4Cl+·OH
(2)
MB+h+/·OH → CO2+H2O+无机小分子
(3)
3 结 论