玫瑰黄酮的提取及抗氧化活性的研究
王梅霖,张志国
(齐鲁工业大学(山东省科学院)食品科学与工程学院,济南 250353)
玫瑰(RosarugosaThunb.)属蔷薇科蔷薇属落叶灌木,距今已有2000多年历史。受西方人影响,说起玫瑰大多数人最先联想到的是浪漫爱情,但是在中国古代,玫瑰不仅具有观赏价值,更是重要的食材和中药材。我国的食用玫瑰主要包括甘肃的苦水玫瑰、山东平阴的重瓣红玫瑰、北京妙峰山的玫瑰、新疆的和田玫瑰以及陕西渭南一带种植的大马士革玫瑰[1]。其中属山东平阴玫瑰历史最为悠久,平阴县栽培玫瑰有2000多年的历史,种植品种主要包括丰花玫瑰、紫枝玫瑰、重瓣玫瑰[2]。玫瑰花性温味甘,含有300多种化学成分,可行气解郁,止痛活血,是良好的保健食材[3]。其中玫瑰花中的黄酮类物质更是具有抗氧化、抗肿瘤、抗炎抑菌、降血糖、降血脂等多种生理活性[4-5]。黄酮类化合物是一种植物膳食来源的抗氧化剂,具有较高的Trolox抗氧化活性值,近年来在食品保鲜领域也逐渐受到人们的关注[6]。目前用于食品保鲜上的抗氧化剂主要有人工合成抗氧化剂和天然抗氧化剂两大类,但BHT、BHA等合成抗氧化剂属于致癌物质,存在极大的安全隐患,因此寻找安全高效的天然抗氧化剂显得尤为重要。
目前植物黄酮的提取方法主要包括水提法、醇提法、超声提取法、回流提取法和有机溶剂萃取法等[7-9]。考虑到黄酮类物质在有机溶剂萃取的过程中,其活性有可能遭到破坏,本研究主要采用水提醇沉的方法提取玫瑰黄酮,并设计单因素和正交实验,确定玫瑰黄酮的最佳提取参数,并通过总还原力和自由基清除能力等指标探究玫瑰黄酮的抗氧化活性,以期为玫瑰黄酮在食品保鲜方面提供理论依据。
1 材料与方法
1.1 材料与试剂
本研究所选用的干燥玫瑰花冠:均来自山东省平阴县;芦丁标准品:购自上海源叶生物科技有限公司;1,1′-二苯基-2-三硝基苯肼(DPPH)、2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)(ABTS):购自合肥博美生物科技有限公司;其他试剂:均购自国药集团化学试剂有限公司。
1.2 仪器与设备
粉碎机 九阳股份有限公司;真空冷冻干燥箱 辽宁朗科商贸有限公司;低速离心机 安徽嘉文仪器装备有限公司;旋转蒸发器 上海亚荣生化仪器厂;循环水式多用真空泵 临海市永昊真空设备有限公司;通风橱 济南凯欧净化设备有限公司;HH-S4数显恒温水浴锅 上海双捷实验设备有限公司;UV759紫外可见分光光度计、电子天平 上海佑科仪器仪表有限公司。
1.3 实验方法
1.3.1 玫瑰黄酮的提取
称取一定量的干燥玫瑰粉末按照1∶10的料液比加入蒸馏水,在40 ℃条件下水浴浸提2 h,过滤后将滤渣在相同条件下二次浸提。用4层纱布过滤,合并上清液以4000 r/min离心15 min,将上清液浓缩后冷冻干燥24 h,冻干粉末于4 ℃冰箱中保存备用。
以不同体积分数的乙醇溶液对冻干粉在一定温度下进行醇沉。醇沉液浓缩后冻干即为玫瑰黄酮。在醇沉过程中选取不同体积分数的乙醇、温度、时间3个因素进行单因素实验,选取因素的不同水平进行正交实验,以确定最佳提取条件[10]。
1.3.2 总黄酮含量的测定
1.3.2.1 芦丁标准曲线的绘制
准确称取50.00 mg芦丁标准品,用无水乙醇定容至50 mL配制成1 mg/mL的芦丁标准溶液。依次移取0.0,0.2,0.4,0.6,0.8,1.0 mL分别置于10 mL试管中,并加入0.5 mL 5%的亚硝酸钠溶液,混合均匀后在室温反应5 min,再加入0.5 mL 10%的硝酸铝溶液,混匀后继续反应5 min,最后加入2 mL 1 mol/L的氢氧化钠溶液,用蒸馏水补至10 mL,混匀静置15 min,在510 nm波长下测定吸光值,以芦丁浓度为横坐标,以吸光值为纵坐标绘制标准曲线,计算回归方程[11]。
1.3.2.2 样品中黄酮含量的测定
制备一定浓度的玫瑰黄酮样品,各取1 mL按照上述方法测定吸光度,根据标准曲线线性方程计算样品中黄酮含量。
黄酮含量:A=(C×V×W)/M/1000。
式中:C为待测液浓度,mg/mL;W为稀释倍数;V为待测液体积,mL;M为样品质量,g。
1.3.3 还原力的测定
分别配制不同浓度梯度的玫瑰黄酮样品和芦丁标准品,取待测液1 mL,加入2.5 mL 1%铁氰化钾和2.5 mL磷酸缓冲液(pH 7.4),混匀于40 ℃水浴20 min,取出再加入2.5 mL 10%三氯乙酸溶液,于4000 r/min下离心10 min,取上清液加入等体积蒸馏水,再加入1 mL 0.1%的三氯化铁溶液,于波长700 nm处测定吸光值,同时设置对照组与3组平行组,取平均值,吸光值越大说明还原能力越强[12]。
1.3.4 DPPH自由基清除率的测定
分别配制不同浓度梯度的玫瑰黄酮样品和芦丁标准品,取适量待测液加入等体积的0.2 mmol/L的DPPH溶液,混匀反应30 min,以无水乙醇作为参比溶液在波长517 nm处测得吸光值A1,同时测定待测液与等体积无水乙醇混合液的吸光值A2以及DPPH与等体积无水乙醇混合液的吸光值A0,每组样品设置3组平行,取平均值[13]。
DPPH自由基清除率/%=[1-(A1-A2)/A0]×100%。
1.3.5 超氧阴离子自由基清除率的测定
分别配制不同浓度梯度的玫瑰黄酮样品和芦丁标准品,取3 mL待测液加入6.4 mL 0.05 mol/L的Tris-HCl (pH 8.2)缓冲液,再加入0.6 mL 0.045 mol/L的邻苯三酚溶液,以蒸馏水做参比溶液在波长325 nm处测得吸光值A2,准确反映4 min后滴加2滴10 mol/L盐酸终止反应,迅速测定吸光值A1,用蒸馏水代替待测液,其余方法相同,测得吸光值A0。每组样品设置3组平行,取平均值[14]。
超氧阴离子自由基清除率/%=[1-(A1-A2)/A0]×100%。
1.4 数据处理
所有实验数据用Origin 8.5进行分析。
2 结果与讨论
2.1 单因素实验
2.1.1 乙醇体积分数对玫瑰黄酮提取率的影响
称取5份1.00 g的水提玫瑰冻干粉,分别加入体积分数为50%、60%、70%、80%、90%的乙醇溶液10 mL于40 ℃下水浴浸提2 h。离心取上清液,按1.3.2的方法测定其中黄酮的含量。
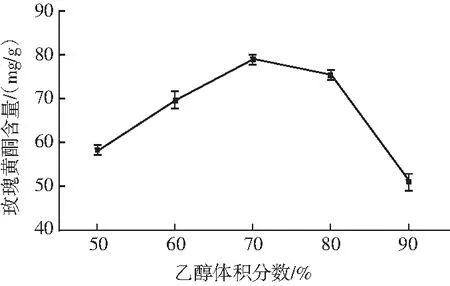
图1 乙醇体积分数对玫瑰黄酮提取率的影响Fig.1 Effect of ethanol volume fraction on the extraction rate of flavonoids from Rosa rugosa Thunb.
由图1可知,当乙醇体积分数从50%上升到70%时,玫瑰黄酮含量呈线性上升;当乙醇体积分数从70%上升到80%时,玫瑰黄酮的含量有所下降;当乙醇体积分数从80%上升到90%时,玫瑰黄酮含量大幅度降低。导致玫瑰黄酮含量下降的原因可能是当乙醇浓度过高时,无法将玫瑰水提物中的杂蛋白及其他成分沉淀下来,导致黄酮含量降低。
2.1.2 温度对玫瑰黄酮提取率的影响
称取5份1.00 g的水提玫瑰冻干粉,分别加入体积分数为75%的乙醇溶液10 mL,分别于30,35,40,45,50 ℃下水浴浸提2 h。离心取上清液,按2.3.2的方法测定其中黄酮的含量。
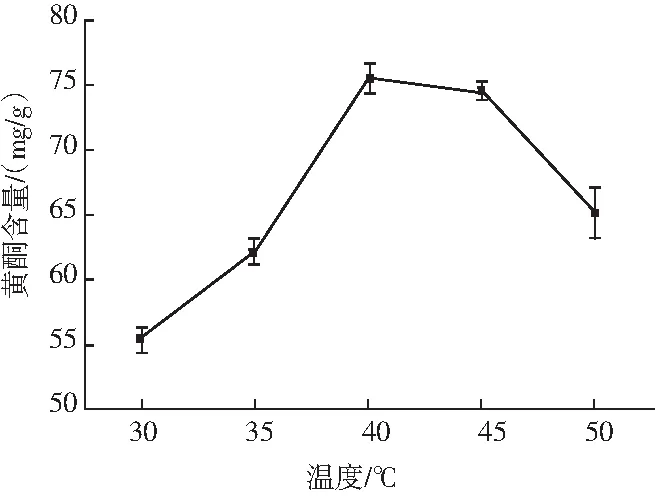
图2 温度对玫瑰黄酮提取率的影响Fig.2 Effect of temperature on the extraction rate of flavonoids from Rosa rugosa Thunb.
由图2可知,当温度从30 ℃上升到40 ℃时,玫瑰黄酮含量急剧升高;当温度从40 ℃上升到45 ℃时,玫瑰黄酮含量较为稳定;当温度继续升高到50 ℃时,玫瑰黄酮含量有所降低。这可能是由于温度较低时玫瑰水提物中的类黄酮物质无法充分溶解于乙醇溶液,或有杂蛋白等其他物质溶于乙醇溶液,而温度过高时,玫瑰黄酮可能被破坏,导致其含量降低。因此40~45 ℃为提取玫瑰黄酮的较适温度。
2.1.3 时间对玫瑰黄酮提取率的影响
称取5份1.00 g的水提玫瑰冻干粉,分别加入体积分数为75%的乙醇溶液10 mL,于45 ℃下分别水浴浸提1,1.5,2,2.5,3 h。离心取上清液,按1.3.2的方法测定其中黄酮的含量。
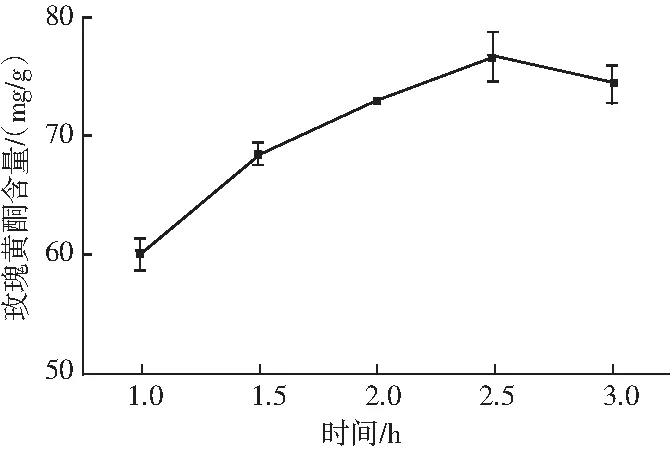
图3 时间对玫瑰黄酮提取率的影响Fig.3 Effect of time on the extraction rate of flavonoids from Rosa rugosa Thunb.
由图3可知,当时间由1 h逐渐延长至2.5 h时,玫瑰黄酮含量逐渐上升,时间超过2.5 h以后,玫瑰黄酮含量开始下降。究其原因可能是时间过长,破坏了玫瑰黄酮的结构,导致其含量降低。
2.2 玫瑰黄酮的最佳提取条件
在单因素水平的基础上,以玫瑰黄酮含量为参考指标,选择不同体积分数的乙醇溶液、浸提温度、浸提时间3个因素按表1设计L9(34)正交实验。

表1 玫瑰黄酮提取正交实验因素水平表Table 1 The factors and levels of orthogonal experiment for flavonoids from Rosa rugosa Thunb.
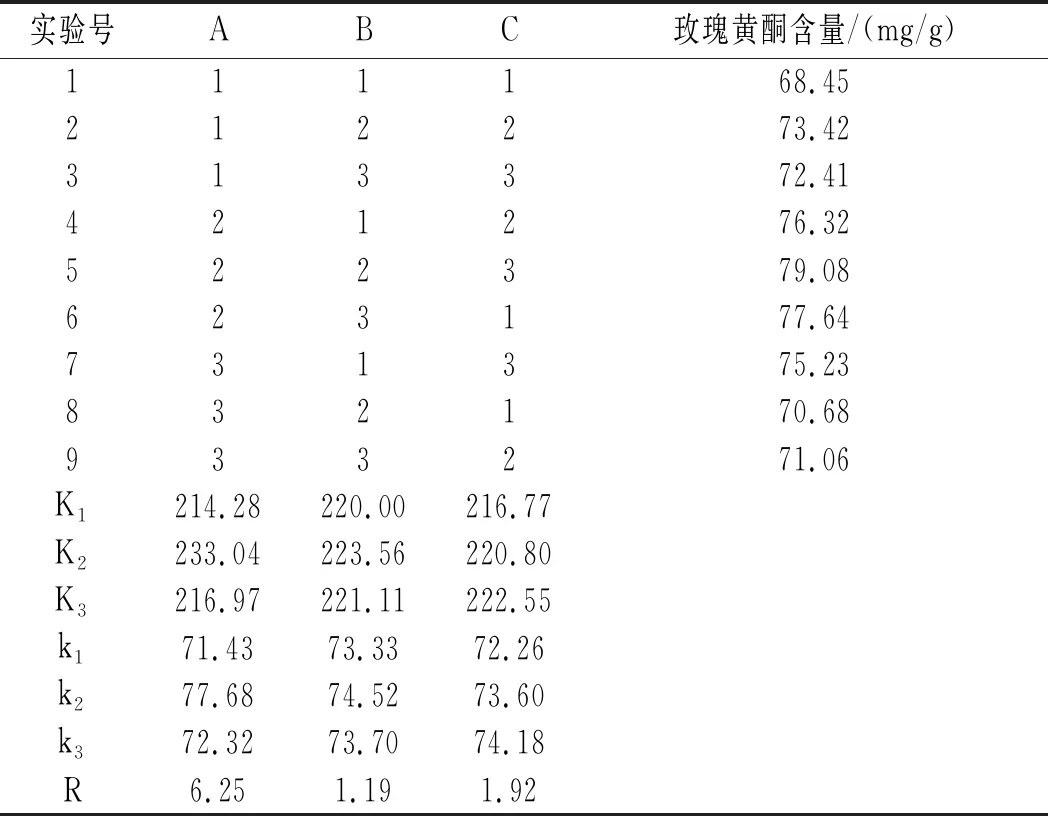
表2 L9(43)正交实验结果Table 2 L9(43)orthogonal experiment design and results
由表2可知,玫瑰黄酮提取率最高的一组是A2B2C3组合,即乙醇体积分数70%,温度40 ℃,浸提3 h。其中对提取效果影响最大的是乙醇体积分数,其次是时间,最后是温度,即乙醇体积分数>时间>温度。在最优参数下进行玫瑰黄酮的提取,其提取率为28.43%。
2.3 总还原力的测定
抗氧化剂通过自身还原作用给出电子以清除自由基,自身的还原性越强,其抗氧化能力越强。本研究利用抗氧化剂可使铁氰化钾的三价铁还原成二价铁测定其总还原力,二价铁继续与三氯化铁反应,生成普鲁士蓝,普鲁士蓝在700 nm波长下具有最大吸光值的原理测得其还原力,吸光值越大说明抗氧化性越高。
选取正交实验中黄酮含量最高的提取条件,即70%的乙醇,40 ℃浸提3 h。测定该条件下玫瑰黄酮的还原能力,结果见图4。

图4 玫瑰黄酮总还原力的测定Fig.4 The determination of total reducing power of flavonoids from Rosa rugosa Thunb.
由图4可知,随着样品浓度的升高,根据分光光度计示数可判断还原能力的大小,吸光值越大,其还原性越好。总体上看,玫瑰黄酮与芦丁均具有较好的还原性,在样品浓度较低时,芦丁与玫瑰黄酮的还原能力与浓度呈线性相关。在浓度达到0.04 mg/mL时芦丁的还原能力趋于稳定,而玫瑰黄酮的还原力则在其浓度达到0.08 mg/mL时趋于稳定。
2.4 DPPH自由基清除能力
DPPH自由基是一种以氮为中心的稳定自由基,本研究利用抗氧化剂可与DPPH自由基的单电子配对,而使DPPH醇溶液的深紫色褪去的原理判断抗氧化剂的DPPH自由基清除能力[15]。

图5 玫瑰黄酮DPPH自由基清除率Fig.5 The scavenging rates of flavonoids from Rosa rugosa Thunb.against DPPH free radicals
由图5可知,随着实验样品浓度的增加,两种抗氧化剂的DPPH自由基清除能力逐渐增强,并在达到一定浓度后逐渐趋于平缓。芦丁对DPPH的清除率在浓度为0.02 mg/mL时开始趋于稳定,在0.06 mg/mL时达到最大值,其最大清除率为95.99%。玫瑰黄酮对DPPH的清除率在0.04 mg/mL时趋于稳定,最大清除率为82.74%。根据其线性回归方程可求出芦丁与玫瑰黄酮的半清除浓度IC50分别为0.012 mg/mL和0.020 mg/mL。综上所述,芦丁对DPPH自由基的清除能力要优于玫瑰黄酮。
2.5 超氧阴离子自由基清除能力
超氧阴离子自由基(O2-·)是分子氧在活体生物体内发生氧化还原反应产生的一种活性中间体,当细胞感受外界刺激或发生病变时会产生过多的(O2-·)自由基,从而导致机体发生病变。本研究利用邻苯三酚自氧化法测定玫瑰黄酮对超氧阴离子自由基的清除率。
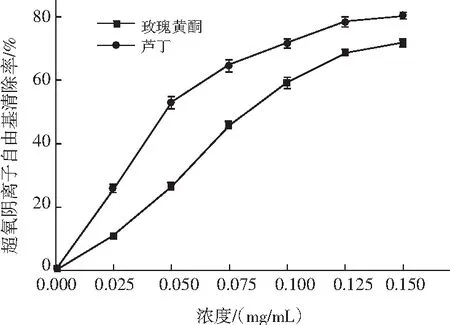
图6 玫瑰黄酮超氧阴离子自由基清除率Fig.6 The scavenging rates of flavonoids from Rosa rugosa Thunb.against superoxide anion free radicals
由图6可知,当样品浓度逐渐增加,超氧阴离子自由基清除率也随之增加时,当浓度达到0.15 mg/mL时,芦丁和玫瑰黄酮的清除率分别为80.22%和71.65%,其IC50分别为0.048 mg/mL和0.088 mg/mL。由此可见,玫瑰黄酮的超氧阴离子自由基清除能力略低于芦丁。
3 结论
本研究通过单因素和正交实验确定了玫瑰黄酮提取的最佳参数为70%的乙醇溶液,40 ℃浸提3 h,可达到最大提取率为28.43%。以芦丁标准溶液作为参比,验证了玫瑰黄酮的总还原力、DPPH自由基清除能力以及超氧阴离子自由基清除能力。结果显示:玫瑰黄酮的抗氧化能力虽不及芦丁标准溶液,但依然有较明显的效果,其对于DPPH与超氧阴离子自由基清除率的IC50分别为0.020,0.088 mg/mL,其最大清除率分别为82.74%与71.65%。
平阴玫瑰香气浓郁,色泽艳丽,花瓣肉质香甜,年产量高,具有丰富的活性物质及营养价值,极具经济效益。其鲜花可泡茶,可制作鲜花饼、鲜花酱、酿酒、提炼精油,在食品、保健品以及化妆品行业都具有极大的开发价值。本研究针对其黄酮类化合物的抗氧化特性进行一系列研究,以期将其抗氧化功效利用在食品保鲜技术上,为天然保鲜剂的开发利用提供理论基础。

