功能性离子液体[A336][Cyanex272]萃取分离宏量钨钼实验研究
曹飞,王威,魏德洲
(1.东北大学资源与土木工程学院,辽宁 沈阳 110819;2.中国地质科学院郑州矿产综合利用研究所,自然资源部多金属矿综合利用评价重点实验室,河南 郑州 450006;3.河南省黄金资源综合利用重点实验室,河南 郑州 450006)
引 言
钨是一种重要的战略性稀有金属,其具有许多独特优异的性能而无可替代,如在所有金属中熔点最高、抗拉强度最高(温度大于1650℃)、膨胀系数最低,并且具有硬度高、密度大以及良好的导热性和导电性等,因而广泛应用于航空航天、机械制造、电子设备、工业催化和医药等领域[1-2]。但是钼杂质的存在严重影响钨制品的性能,因此我国对钨制品中钼的含量有着非常严格的规定,如0 级仲钨酸铵 (APT)产品中Mo含量须小于0.002%[3]。然而,钨与钼常常共伴生[4],并且高钼钨资源已成为我国钨矿开发利用的主流,如湖南柿竹园钨矿、河南栾川三道沟钨矿和行洛坑钨矿等。在钨矿的选矿过程中,钼与钨一起被富集到钨精矿中,并且采用物理工艺无法有效分离。因此,如何实现钨钼的深度分离已成为冶金工业必须解决的关键难题。
近年来,科研工作者提出了许多解决钨钼分离的办法,如沉淀法、离子交换法、溶剂萃取法和吸附法等,并且前三种方法已在工业上成功地应用。但是这些方法对钨中微量钼(m(Mo) :m(WO3) <1/20)的去除效果良好[5],当钼含量较高时(m(Mo) :m(WO3) >1/20)则存在着许多的问题,如沉淀法存在钨沉淀率高、钼产品价值低和沉淀剂消耗量大等缺点,而离子交换法存在分离效率低、药剂消耗量大和废水排放量大等缺点[6],相比而言,溶剂萃取法虽然也存在分离效率低的问题,但通过添加硫化剂、络合剂等可有效改善分离效果[7],并且溶剂萃取法具有处理量大、药剂消耗少以及可连续化操作等优点,因此在处理高钼钨溶液方面更具有前景。在溶剂萃取过程中萃取剂是其中的关键因素。然而,近年来针对钨钼分离的研究仍以传统萃取剂为主,如磷酸三丁酯(TBP)[7]、三烷基氧化膦(TRPO)[7]、氯化甲基三烷基铵(Aliquat 336)[8]和仲烷基伯胺(N1923)[9]等,而新型萃取剂的研究较少[10]。因此,设计开发新型高效的萃取剂极为迫切。
离子液体是指由完全由阳离子和阴离子组成的,在室温下呈液态的有机化合物[11]。与目前常用的萃取剂相比,离子液体具有蒸气压低、不易燃、低挥发性和良好的稳定性等特点,引起了广大科研工作者的兴趣。尤其是功能性离子液体(指包含两个功能基团的离子液体)[12],在湿法冶金领域作为金属萃取剂受到了越来越多的关注。如Guo等[13]利用功能性离子液体[A336][P507]分离稀土元素,Sun等[14]利用功能性离子液体[A336][CA-12]分离钴和镍,Kogelnig等[15]利用功能性离子液体[A336][TS]提取镉,并且都取得了良好的效果。功能性离子液体[A336][Cyanex272]同样展示了良好的萃取性和选择性,可以从含铜、镉、铁和镍混合金属离子溶液中选择性地萃取铜[16],对溶液中Cr(III)和Cr(VI)两种镉离子的去除效果良好[17]。
然而,利用功能性离子液体萃取分离钨钼的研究较少,仅笔者进行了相关研究,证实了功能性离子液体[A336][Cyanex272]可用于微量钨钼的分离[18],但针对实际高钼钨溶液分离的研究尚未见详细的报道。因此,为了进一步证实[A336][Cyanex272]的工业应用潜力,以某实际料液的模拟溶液为研究对象,开展了详细的实验研究。
1 实验药剂、仪器及方法
1.1 实验药剂及仪器
[A336]Cl购买于Sigma-Aldrich公司(美国),分析纯。异丙醇、环己烷、金属Na、Na2WO4·2H2O、Na2MoO4·2H2O、H2SO4、NaHCO3均为分析纯。实验料液中的钨钼含量按照某工业料液[19]中的钨、钼含量(16.27 g/L WO3、9.10 g/L Mo)进行配制,配制用水为去离子水。
实验仪器主要有多管混合器(Advanced Multitube Vortexes,天津恒奥科技发展有限公司)、集热式恒温加热磁力搅拌器(DF-101S,巩义市予华仪器有限责任公司)、精密pH计(SevenCompact,Mettler Toledo, USA)、离心机(TDL-40B、上海安亭科学仪器厂)、核磁共振仪(AV-400 NMR,瑞士Bruker公司)等。
1.2 实验方法
按照实验所需浓度将一定量的[A336][Cyanex272]溶于环己烷中,与一定体积的钨钼溶液置于平衡管中,在多管混合器中振荡20 min,转速为1000 r/min, 然后静置0.5 h,放入离心机中强化分离(转速为4000 r/min),使其充分分相,抽取水相分析其浓度,考察不同工艺条件对钨钼分离的影响。
1.3 [A336][Cyanex272]的制备
[A336][Cyanex272]按照文献[20]中的方法进行合成。首先利用离子液体[A336]Cl制备相应的[A336][OH],然后与酸性萃取剂Cyanex272反应,合成[A336][Cyanex272],制备过程如下:
[A336][OH]:首先将6.39 g(0.278 mol)金属钠加入到200 mL异丙醇中搅拌8 h,然后将112.36 g (0.278 mol)三辛基甲基氯化铵([A336]Cl)溶于400 mL异丙醇中,再加入到异丙醇钠溶液中。在50 ℃下搅拌8 h后静止2 h,然后在4000 r/mim下离心8 min进行固液分离。最后,将上清液与等体积的去离子水在室温下混合搅拌4 h。[A336][OH]即由[A336][OR]水解得到。[A336][OH]浓度由酸碱滴定法测定。
[A336][Cyanex272]: 将400 mL [A336][OH](0.12 mol/L) 和12.65 g二(2 , 4 , 4 -三甲基戊基)次磷酸(Cyanex 272) (摩尔比为1.1:1)混合,在50 ℃下充分搅拌12 h后静止4 h。此时体系分为有机相和水相,利用分液漏斗将二者进行分离,然后有机相在60 ℃、20 mbar下真空干燥2 h以除去水和异丙醇。最终获得的产物为[A336][Cyanex272],产率为80.16%。
核磁数据如下:

2 结果与讨论
2.1 水相初始pH值对钨钼分离的影响
不同的水相pH值影响着钨钼的聚合形态,在弱酸性溶液中,钨优先于钼形成聚合阴离子,从而有利于钨的萃取。因此首先在[A336][Cyanex272]浓度为0.15 mol/L、O/A=2:1的条件下,考察了水相初始pH值对钨钼分离的影响,实验结果见图1。
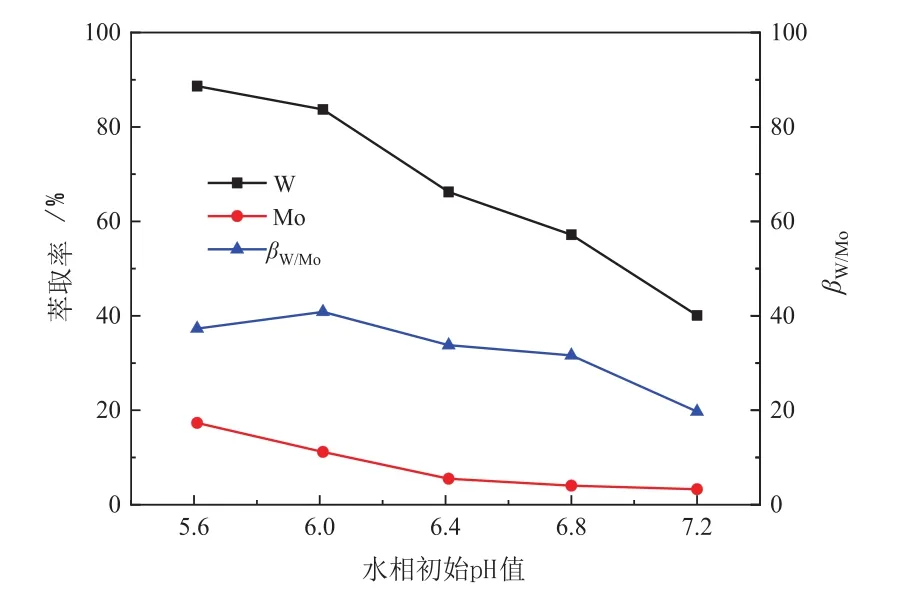
图1 水相初始pH值对钨钼分离的影响Fig.1 Effect of initial pH value of aqueous solution on the separation of W and Mo
从图1可以看出,当初始pH值为5.6时,钨的萃取率接近90%,而钼的萃取率接近20%,随着pH值的增加,钨和钼的萃取率都随着降低,当pH值超过6.0时,钨的萃取率降低的更快,因此导致分离系数(βW/Mo)也随之降低。因此合适的pH值为6.0,此时分离系数最高,为40.84。
2.2 萃取剂浓度对钨钼分离的影响
在水相初始pH值为6.0、O/A=2:1的条件下,考察了萃取剂[A336][Cyanex272]浓度对钨钼分离的影响,为了对比分离效果,同时考察了常用萃取剂[A336]Cl不同浓度对钨钼分离的影响,探索实验表明,[A336]Cl在水相初始pH值为6.8时对钨钼的分离效果较好,因此在水相初始pH值为6.8、O/A=2:1的条件下进行了实验,实验结果见图2。
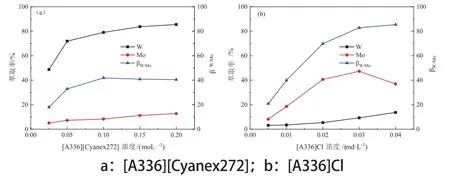
图2 不同萃取浓度对钨钼分离的影响Fig.2 Eあect of the extractant concentration
从图2a可以看出,随着萃取剂[A336][Cyanex272]浓度的增加,钨和钼的萃取率都随着增加,但钨的萃取率增加的更快,因此分离系数也随着增加;当[A336][Cyanex272]浓度增加到0.10 mol/L后,钨的萃取率增加幅度变缓,而钼的萃取率提高加快,导致分离系数反而降低,因此合适的 [A336][Cyanex272]浓度为0.10 mol/L,此时分离系数最高,为41.87。从图2b可以看出,随着萃取剂[A336]Cl浓度的增加,钨和钼的萃取率都随着增加,当[A336]Cl浓度增加到0.03 mol/L时,分离系数较高,为47.32。
由此可以看出,在较佳浓度下,[A336][Cyanex272]的分离系数略低于[A336]Cl,但[A336][Cyanex272]萃取体系不引入任何杂质离子[16],并且经反萃后即可再生,且性能稳定,而[A336]Cl萃取体系不仅引入了杂质氯离子,而且再生较为复杂,经反萃后还需再用盐酸酸化或者其他手段实现再生,因此,[A336][Cyanex272]更具有优势。
2.3 相比O/A对钨钼分离的影响
在水相初始pH值为6.0、[A336][Cyanex272]浓度为0.10 mol/L的条件下,考察了相比O/A对钨钼分离的影响,实验结果见图3。
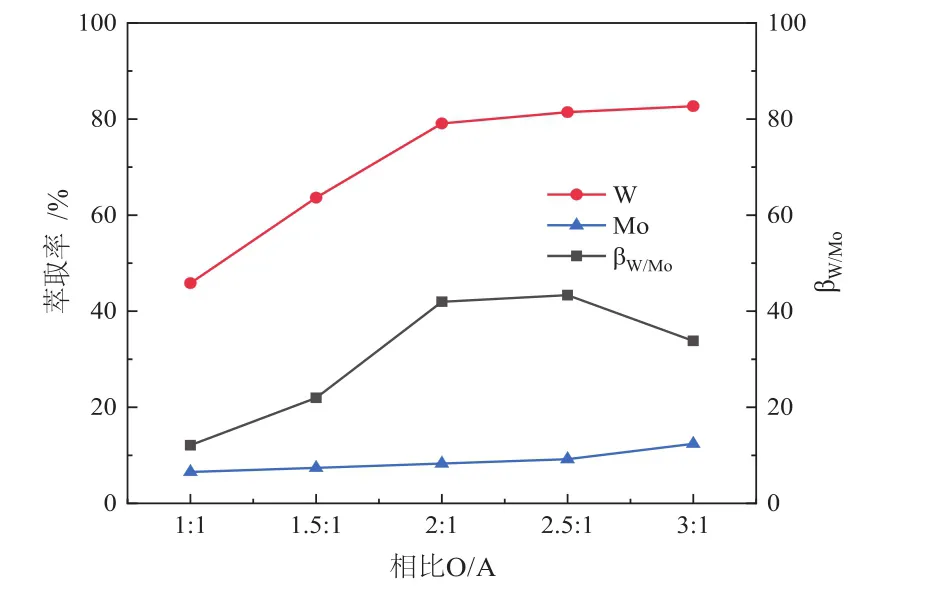
图3 相比O/A对钨钼分离的影响Fig.3 Eあect of the O/A ratio on the separation of W and Mo
从图3中可以看出,随着相比O/A的增加,钨和钼的萃取率都随着增加,但钨的萃取率增加的较快,而钼的萃取率只是缓慢增加,因此分离系数也随之提高;当相比O/A增加到2.5:1后,钨的萃取率增加的非常缓慢,而钼的萃取率开始显著提高,因此导致分离系数降低,因此当相比O/A为2.5:1时,分离效果较佳,因此选择此相比O/A进行后续实验。
2.4 洗涤实验
为了进一步分离纯化负载有机相中的钨,采用低浓度NaHCO3溶液对负载有机相进行洗涤,不同NaHCO3浓度对洗涤效果的影响见图4。

图4 NaHCO3浓度对洗涤效果的影响Fig.4 Eあect of the NaHCO3 concentration on the scrubbing of W and Mo in the loaded organic phase
从图4中可以看出,随着NaHCO3浓度的增加,钼的洗脱率随着增加,但钨的洗脱率也随着增加,但钼的洗脱率增加的较快,当NaHCO3浓度为0.025 mol/L时,两者出现最大差值,为48.66个百分点,负载有机相中的钨进一步富集,WO3/Mo质量比从15.76增加到33.26。
2.5 反萃实验
经过洗涤后,有机相中的钨得到纯化,然后考察了NaHCO3、NH4OH和NaOH三种萃取剂对负载有机相中(含WO312.09 g/L,含Mo 0.37 g/L)钨和钼的反萃效果,实验结果见表1。

表1 反萃剂种类对负载有机相中钨和钼的反萃效果Table 1 Eあect of diあerent agents on the stripping of W and Mo from [A336][Cyanex 272]
从表1中可以看出,三种反萃剂的反萃效果都较好,钨的反萃率都超过80%,而钼的反萃率都超过90%,其中NaOH的反萃效果较佳,其次为NaHCO3,NH4OH的效果最差。但NH4OH的挥发性较强,对皮肤有一定的腐蚀性,而NaOH在空气中易潮解,腐蚀性较强,因此后续选择NaHCO3进行详细的反萃实验,结果见图5。
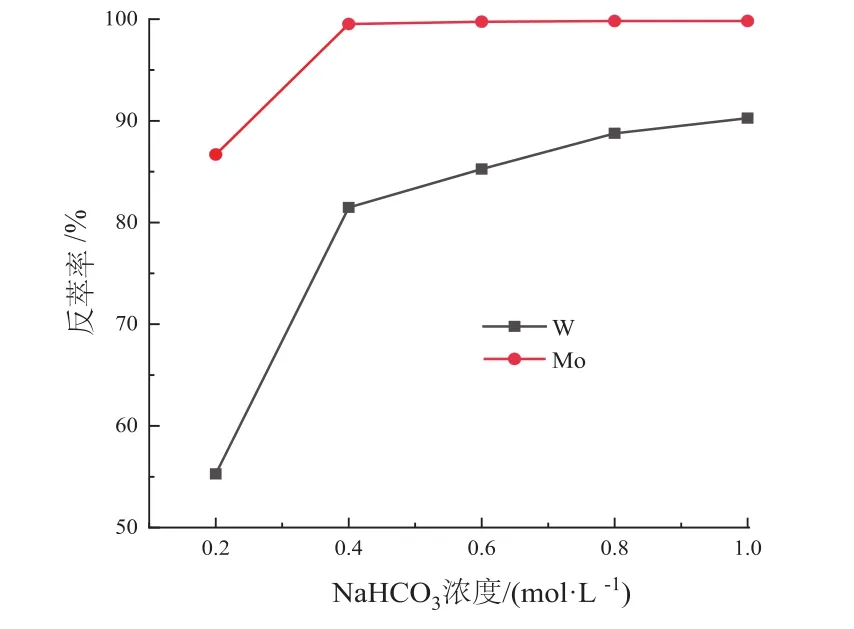
图5 NaHCO3浓度对反萃效果的影响Fig.5 Effect of initial pH value of aqueous solution on the separation of W and Mo
从图5中可以看出,随着NaHCO3浓度的增加,钨和钼的反萃率都显著提高,当NaHCO3浓度为0.4 mol/L时,钼的反萃率接近100%,而钨的反萃率也高于80%,随着NaHCO3浓度的进一步提高,钨的反萃率也随着继续提高,说明[A336][Cyanex272]的反萃性能良好。
3 结 论
高钼钨溶液中钨钼分离一直是湿法冶金中的难题。本研究采用功能性离子液体 [A336][Cyanex272]对高钼钨溶液中的钨钼进行了详细的萃取分离实验,并且取得了良好的效果。在水相初始pH值为6.0、[A336][Cyanex272]浓度为0.10 mol/L、O/A比为2.5:1的条件下,钨的萃取率超过80%,而钼的萃取率小于10%,分离系数高达43.34,并且通过洗涤负载有机相可进一步实现钨的富集,并且反萃性能也较好。虽然[A336][Cyanex272]的分离效果略低于[A336]Cl,但[A336][Cyanex272]萃取体系具有无杂质离子引入、再生容易且稳定性好等优点,因此[A336][Cyanex272]在整体性能上优于[A336]Cl,可作为[A336]Cl的替代萃取剂。该研究结果为功能性离子液体在钨钼萃取分离方面的应用和设计研发高效的钨钼分离萃取剂提供了方向。

