肝脏外生型肿瘤的影像诊断思维
金晓蕾 朱珍 梁宗辉
病例资料患者,女,54 岁,发现胃肿物1 周。1 周前无明显诱因下出现右上腹隐痛,进食后无不适,无夜间痛,无消瘦、乏力,无恶心、呕吐,无畏寒,无皮肤、巩膜黄染。外院上腹部MRI 提示:胃间质瘤可能大。甲胎蛋白:1389.96 ng/ml。体格检查:肝区叩痛(-),肝脾肋下未及。
影像表现:CT 平扫(图1a)可见肝左外叶与胃底旁见卵圆形软组织肿块影,轮廓光整,大小约42 mm×38 mm,CT 值约38 HU;增强CT 动脉期(图1b)病灶轻度强化,CT值约51 HU;增强CT 静脉期(图1c)病灶持续强化,强化略低于肝脏,CT 值约99 HU;延迟期扫描(图1d)病灶强化程度略有降低,CT 值约66 HU;冠状面(图1e)和矢状面重组(图1f)示病灶与肝左外叶似有窄蒂相连,与胃底关系密切,与左侧膈肌局部紧贴,分界不清。病灶强化方式与同层面肝脏、脾脏类似。CT 诊断:胃大弯左侧肿物,胃间质瘤可能大,副脾不完全除外。

图1 a)CT 平扫横断面示肝左外叶、胃底旁卵圆形肿块,轮廓光整,密度略低于肝脏;b)增强CT 动脉期病灶轻度强化,强化均匀,强化程度略高于肝实质;c)增强CT 静脉期病灶强化均匀,强化程度与肝脏、脾脏类似;d)CT 增强延迟期病灶强化略有消退;e)冠状面和f)矢状面重组示病灶与肝左外叶似有窄蒂相连(箭),与胃底关系密切
手术记录:全麻下行肝脏楔形切除术,术中见肿块位于胃及脾脏之间,侵犯膈肌及左肝叶游离边缘,大小约4 cm,术中冰冻提示考虑肝细胞癌可能。完整切除肿瘤。
病理结果:肝细胞癌,3 级。免疫组化:CD34(-),CK8(+),CK18(+),CK19(灶+),Heap-1(+),CK7(散在+),网染(网状纤维减少),Ki67(6%+),P63(-)。(大网膜)未见癌转移,扎线处纤维肉芽组织伴导管扩张、充血、出血(图2)。
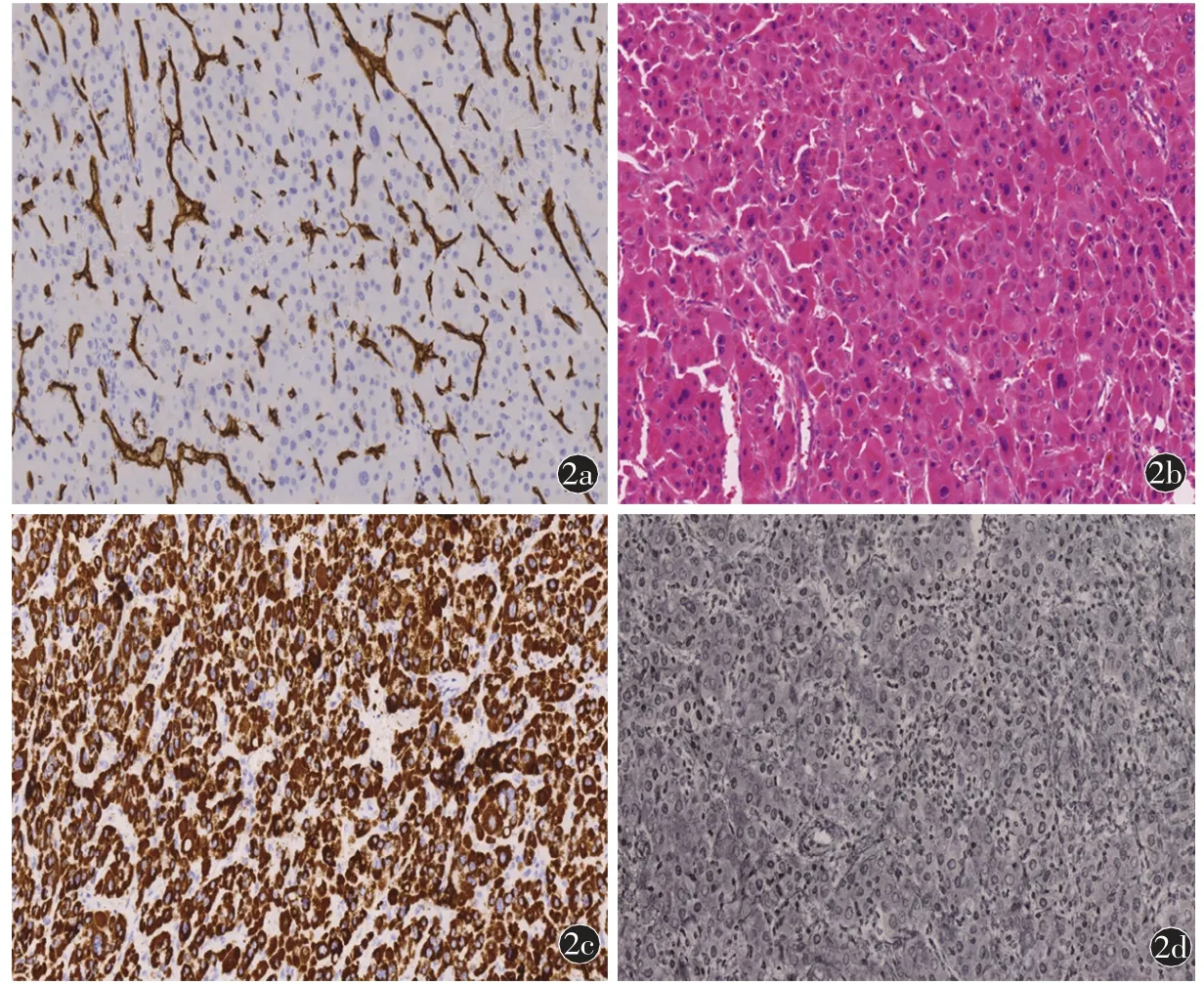
图2 a)CD34(20×10)阳性染色微血管围绕癌细胞粱索分布;b)HE(20×10)癌细胞细胞质嗜酸性,核有异型。癌细胞排列呈梁索状,梁索状之间为血窦;c)Hepa-1(20×10)胞质阳性;d)网染(20×10)网状纤维减少,围绕癌巢分布
讨论 肝脏外生型肿瘤指中心超出肝脏范围但起源于肝脏的肿瘤。肝脏良性肿瘤和恶性肿瘤均可向外生长。良性外生型肝肿瘤包括肝囊肿、血管瘤、肝腺瘤、局灶性结节增生、血管平滑肌脂肪瘤等。恶性外生型肝肿瘤包括肝细胞癌、肿块型肝内胆管细胞癌、转移等[1]。由于难以判断肿瘤的起源,肝脏外生型肿瘤的诊断较难。
1897 年Roux 首次报道外生型肝癌(pedunculated hepatocellular carcinoma,PHCC)。1934 年Goldberg 和Wallerstein首次报道PHCC 的病理组织学为肝细胞癌。PHCC 指肝外生长、增殖的原发性肝癌,是一种生长方式和外观形态上的特殊类型。病理上PHCC 与一般的肝细胞癌没有区别,其独特性是肿块与肝脏分离[2]。PHCC 的发生率占原发性肝癌的0.2%~4.2%[1]。
PHCC 的起源可能如下:(1)起源于副肝叶或异位肝组织的癌变[3],异位肝组织可位于肝脏三角韧带、脾脏、脐窝、网膜、腹腔干周围的后腹膜、胆囊和胆囊周围、胸腔、腹膜后间隙,其中肝副叶癌变的可能性高于异位肝组织;(2)也可起源于肝硬化突出部分的癌变[4]。
PHCC 目前尚无统一分类方法。张凤瑞等[5]认为外生型肝癌可分为两种类型:一种为带蒂型,多见于肝右叶,表现为向外生长的瘤体通过蒂与肝脏连接,肿瘤与肝脏有一定的距离且不影响肝脏本身的形态;瘤体巨大时可侵犯周围结构而出现临床症状。另一种为无蒂型,多见于肝脏左叶,瘤体与肝脏相连但大部分位于肝外。
PHCC 临床特点如下:HBsAg 阳性率低,AFP 阳性率相对较低(30%~50%);肝功能都代偿良好;病程通常较长,早期常无症状,多为偶然发现,瘤体较大时可出现症状,主要表现为上腹部包块和腹痛。国内病例有肝炎后肝硬化和AFP 明显升高阳性率均较高。
影像学上,PHCC 以单发为主,合并肝内病变亦不少见,患者多有肝硬化基础。CT 和MRI 表现为肝脏轮廓外的肿块。由于PHCC 的位置或与其他器官粘连,放射科医生在CT 和MRI 上仍难以确定肿瘤起源,可能误诊。PHCC 血供丰富,与HCC 相似,主要血供是肝内动脉,肝外侧支动脉是PHCC 的补充血供。PHCC 的肝外侧支血供应通常来源于胃十二指肠动脉、胃左动脉、膈动脉、肠系膜上动脉、胰十二指肠动脉和右肾上腺动脉等。肝外侧支循环的多少与肿瘤大小密切相关。病灶小于5 cm 较少有肝外供血,大于10 cm 病灶80%由肝外血管参与供血[6,7]。
多期增强CT 上,PHCC 与肝内肝癌“快进快出”强化特点相似,表现为动脉期明显强化,静脉期强化减低,延迟期呈相对低密度。CT 多平面重组(multi-planner reformation,MPR)可显示肿块与肝脏是否相连,并可显示肿块的强化特征和供血动脉[1,7]。动脉血供起源于肝动脉是肿瘤来源于肝脏的重要证据,这非常有助于诊断外生型肝肿瘤[8]。多排螺旋CT 血管成像(multi-slice spiral CT angiography,MSCTA)能清晰显示供血动脉,带蒂型通常显示一支供血动脉通过窄蒂进入肿瘤,无蒂型可显示多支血管进入瘤体,是简单有效的定位诊断依据,有助于判断肿瘤起源。
有关外生型肝癌的MRI 报道很少,Horie等[9]研究1例PHCC 的MR图像,显示轴位MRI 的图像对检测肿瘤的出血和坏死优于CT,且矢状位有助于显示PHCC 与肝脏的连接。
PHCC 可发生在任何肝叶和节段,由于其向外生长且瘤体与肝脏有一定界限的特点,临床表现为肿瘤引起的压迫症状或肿瘤侵犯周围器官,因而易误诊为腹膜后或胃肠道等部位的肿瘤[4]。当PHCC 发生在右肝叶并向尾状生长时,可向腹膜后延伸,有可能误诊为右肾上腺肿瘤。偶尔PHCC 直接侵犯腹膜和脾脏,可误诊为脾脏或腹膜肿块。也可侵犯十二指肠,类似胃肠道间质瘤。当肿块巨大时甚至可误诊为盆腔肿物[10]。胆管和门静脉侵袭在PHCC也可发生[1]。
PHCC 治疗以手术为主,其切除率较肝内型肝癌更高,切除范围应包括肿瘤及其所在肝段与受侵犯脏器的联合切 除[4]。Yeh 等[11]分析432例肝癌病例手术治疗后的预后,其中18 例(4.2%)外生型肝癌,生存率明显高于对照组。对不能手术切除的PHCC 患者,可进行经导管动脉栓塞(transcatheter arterial chemoembolization,TACE),或TACE和经皮碘化油化疗乳剂(percutaneous chemotherapeutic agents lipiodol emulsion,CALE)注射联合治疗[12]。
PHCC 的鉴别诊断与其部位有密切关系,需和以下疾病进行鉴别:(1)PHCC 需与肝脏其他外生型肿块病变相鉴别,包括良性肝外生型肿瘤(如囊肿、血管瘤、肝腺瘤、肝脏局灶性结节性增生等)和其他恶性肝外生型肿瘤(肿块型肝内胆管细胞癌、转移等)鉴别。依据这些病灶的典型增强特点及临床病史、实验室检查,与PHCC 较易区分。(2)起源于尾状叶的外生型肝癌须与胰腺内分泌肿瘤鉴别:胰腺功能性内分泌肿瘤由于临床有明显症状,一般发现时肿瘤较小,非功能性肿瘤没有临床症状,发现时可以较大。胰腺内分泌肿瘤几乎都是富血供肿瘤,增强后动脉期明显强化,持续时间较长,可与PHCC 鉴别。(3)起源于右后叶外生型肝癌与右侧肾上腺肿瘤鉴别:如嗜铬细胞瘤、神经节细胞瘤等。嗜铬细胞瘤释放儿茶酚胺,可引起患者高血压及高代谢症候群,肿瘤一般较大,可有出血、坏死、囊变,血供丰富,增强后动脉期强化显著,持续时间长;神经节细胞瘤坏死囊变少见,形态不规则,可沿附近结构之间的空隙生长,增强后强化程度一般较轻。(4)起源于右前叶及左内叶外生型肝癌应与胆囊癌相鉴别:胆囊癌多数发生在50~80 岁,女性多见,多有胆结石病史。肿块型胆囊癌表现为胆囊窝软组织肿块,侵犯临近肝脏时与肝脏分界不清,而PHCC 推压胆囊使胆囊移位,结合病史及仔细观察解剖结构鉴别不难。(5)起源于左外侧叶外生型肝癌与胃肠道肿瘤鉴别:主要与胃外型间质瘤相鉴别,胃外型间质瘤位于胃浆膜下,向腔外生长,有时可见蒂挂于胃壁上,肿瘤密度均匀或不均匀,可有坏死、囊变,钙化少见,增强后动脉期明显强化,如病史不明确与PHCC 鉴别有一定困难。PHCC 与来源于其他脏器肿瘤鉴别要点在于是否有乙肝、肝硬化、AFP 阳性病史、肝癌的强化特点以及肿块与周围结构的关系。
影像诊断思维 影像诊断都要遵循先定位、后定性、再定期的原则。外生型肿瘤的诊断难点在于定位,尤其是腹腔巨大肿瘤与多个脏器关系密切时,确定其起源是正确诊断的基础。一般而言,通过病灶与周围脏器的关系、病灶的血供来源以及病灶的影像学特点可以做出正确诊断。
对于肝脏外生型肿瘤而言,首先依然是要确定肿瘤是否起源于肝脏,“鸟嘴征”(指肿瘤与肝脏的接触面呈“鸟嘴”样)[1]以及病灶与肝脏之间的蒂的显示有助于外生型肝肿瘤的诊断,此时CT 薄层、二维和三维重组图像、MRI多平面图像有助于显示以上的特征。若病灶较大,与周围脏器紧贴,就应仔细观察病灶与其他脏器之间是否存在脂肪间隙,病灶对相邻结构是推压还是侵犯。其次是判断肿瘤的供血动脉是否来源于肝脏,有时候其引流静脉同样有助于判断病灶起源,MSCTA 对显示其征象有帮助。现在的多排螺旋CT 所获得的是容积数据,多期扫描的原始数据可直接进行动脉和静脉的三维重组,不需要额外进行血管成像,因此在判断病变起源存在困难时,要想到做血管重组来帮助定位;需注意的是,肝脏外生型肿瘤巨大时,侧支血管参与供血,如胃右动脉供血时更易误诊为胃间质肿瘤。其三是判断肿瘤特异的影像学特征,如病灶的密度/信号变化、是否有坏死、钙化等,以及病灶的动态增强模式等,此时MRI 具有更好的价值。对于判断病灶的内部成分、与周围器官的关系以及是否具有类似周围器官之处均能提供更多的信息。有时,恶性肿瘤同时侵犯周围多个脏器,判断其起源存在困难,只能依赖肿瘤的影像学表现和特征来进行判断,即此时就变成“先定性、后定位”,譬如肝癌侵犯胆囊与胆囊癌侵犯肝脏,在定位困难时,就可根据肿瘤的影像学表现来进行鉴别,进而确定肿瘤的起源。
外生型肝肿瘤的影像学特征除了发生位置,其余与肝内的肿瘤相似。如能找到准确证据证明病灶来源于肝脏、具有肝肿瘤的增强特征,结合患者乙肝、肝硬化病史、AFP阳性等,诊断一般不难。本例患者增强CT 提示上腹部胃大弯左侧肿物,诊断考虑胃间质瘤可能大、副脾不完全除外,主要理由在于病灶的强化方式并不太符合典型肝癌“快进快出”特点,且与胃底的关系更为密切,与起源于胃浆膜下的间质瘤表现相仿。一般而言,胃间质瘤具有向外生长的特点,且有持续性强化特点,所以术前首先考虑间质瘤的诊断。由于病灶强化方式与肝脏、脾脏类似,所以考虑到副肝与副脾的可能性,但副肝相对少见,而副脾更为常见,所以将副脾作为第二诊断。本例外生型肝癌之所以与典型肝癌的CT 表现不符,考虑其主要原因在于病灶起源于肝脏左外叶游离缘,并没有独立的血供,其强化方式与肝脏类似,不具备典型肝癌的表现,所以术前未考虑到外生型肝癌,且在CT 检查时尚未检测AFP,需要引起重视的是异位肝组织来源的外生型肝癌,由于其与肝脏没有直接联系,只能通过其典型的影像学表现来进行定性诊断,如果影像学表现不典型则往往很难做出正确诊断。
总之,外生型肝癌虽然少见,临床表现无特异性,但仔细判断影像学表现可减少误诊:PHCC 表现为凸出肝脏轮廓外的肿块,薄层图像及MPR 重组可明确显示病灶与肝脏关系,CT、MRI 动态增强时病灶的强化方式与原发性肝癌一致,CTA 可显示供血动脉来源于肝动脉,结合患者乙肝、肝硬化病史及AFP 阳性更有助于做出诊断。

