管花肉苁蓉多糖水提物的分离及免疫活性研究
艾拉旦·麦麦提艾力 李洋 姚军 袁洁

摘 要 目的:分離管花肉苁蓉多糖水提物,考察分离物的体外免疫活性。方法:采用AB-8大孔吸附树脂法对管花肉苁蓉多糖进行脱色,以多糖保留率和多糖脱色率为指标进行综合评分,以吸附速率、脱色时间、上样质量浓度为因素,采用正交实验优化脱色工艺并验证。采用DEAE-650M离子交换柱层析柱对脱色后的管花肉苁蓉多糖水提物进行分离。采用CCK-8法检测不用质量浓度(6.25~100 μg/mL)分离前、后各种多糖对小鼠巨噬细胞RAW264.7增殖率的影响,采用Griess法和酶联免疫吸附测定法检测低、中、高质量浓度(12.5、25、50 μg/mL)分离前、后各种多糖对脂多糖(LPS)诱导RAW264.7细胞一氧化氮(NO)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)释放量的影响。结果:AB-8大孔吸附树脂的最优脱色工艺为吸附流速1.2 BV/h,脱色时间9 h,上样质量浓度25 mg/mL;3次验证实验的综合评分分别为63.43%、63.29%、63.34%,平均值为63.35%(RSD=0.11%,n=3)。从管花肉苁蓉多糖水提物中分离出1种中性多糖(CTZ)和5种酸性多糖(CT1、CT2、CT3、CT4、CT5),含量分别为299.2、168.0、123.2、121.6、54.4、11.2 mg/g。与对照组比较,6.25~100 μg/mL的CTZ(6.25 μg/mL除外)、CT2、CT4、CT5和6.25 μg/mL的CTC(即分离前的多糖)均可显著增加RAW264.7细胞的增殖率(P<0.05),6.25~100 μg/mL的CT1、CT3和50 μg/mL的CTC均可显著降低RAW264.7细胞的增殖率(P<0.05)。与LPS组比较,低、中、高质量浓度CTC、CT2、CT3、CT5组和低质量浓度CTZ组细胞的NO释放量均显著降低(P<0.05),高质量浓度CT1、CT4组细胞的NO释放量均显著升高(P<0.05);低、中、高质量浓度各组细胞的IL-6(高质量浓度CT1组和低质量浓度CT5组除外)、TNF-α释放量(中质量浓度CT1组除外)均显著降低(P<0.05)。结论:本研究所优化的大孔吸附树脂脱色工艺稳定、可行;管花肉苁蓉多糖水提物中可分离出1种中性多糖、5种酸性多糖,其中酸性多糖CT2的免疫活性较强。
关键词 管花肉苁蓉多糖;脱色;分离;免疫活性
ABSTRACT OBJECTIVE: To isolate the water extract of polysaccharide from Cistanche tubulosa,and to investigate their immunocompetence in vitro. METHODS: AB-8 macroporous adsorption resin was used to decolorize C. tubulosa polysaccharide. The decolorization process was optimized by orthogonal test with retention rate and decolorization rate of polysaccharide as comprehensive score, and using adsorption rate, decolorization time, sample concentration as factors. The verification tests were conducted. DEAE-650M ion exchange column was used to separate the water extract of decolorized C. tubulosa polysaccharide. CCK-8 assay was used to detect the effects of different concentration of polysaccharide (6.25-100 μg/mL) before and after isolation on the proliferation rate of mice macrophage RAW264.7. Griess method and ELISA assay were adopted to detect the effects of low, medium and high concentration of polysaccharide (12.5, 25, 50 μg/mL) on the release of NO, IL-6 and TNF-α in LPS-induced RAW264.7 cells. RESULTS: In the optimal decolorization process of AB-8 macroporous adsorption resin, the adsorption flow rate was 1.2 BV/h, the decolorization time was 9 h, and sample concentration was 25 mg/mL. The comprehensive scores of 3 times of verification tests were 63.43%, 63.29% and 63.34%, respectively, with an average of 63.35% (RSD=0.11%, n=3). One neutral polysaccharide (CTZ) and 5 acid polysaccharides (CT1, CT2, CT3, CT4, CT5) were isolated from the polysaccharide of C. cistanche, the contents were 299.2, 168.0, 123.2, 121.6, 54.4, 11.2 mg/g. Compared with control group, 6.25-100 μg/mL CTZ (except for 6.25 μg/mL), CT2, CT4, CT5 and 6.25 μg/mL CTC (the polysaccharide before seperation) could significantly increase the proliferation rate of RAW264.7 cells (P<0.05), while 6.25-100 μg/mL CT1, CT3 and 50 μg/mL CTC could decrease te proliferation rate of RAW264.7 cells (P<0.05). Compared with LPS group, the release of NO were decreased significantly in low, medium and high concentration groups of CTC, CT2, CT3 and CT5, CTZ low concentration group (P<0.05), while were increased significantly in high concentration groups of CT1 and CT4 (P<0.05). The release of IL-6 (except for CT1 high concentration group and CT5 low concentration group) and TNF-α (except for CT1 medium concentration group) were decreased significantly in low, medium and high concentration groups (P<0.05). CONCLUSIONS: The optimized decolorization technology of macroporous adsorption resin is stable and feasible in the study. One neutral polysaccharide and 5 acidic polysaccharides can be isolated from water extract of C. tubulosa polysaccharides, among which CT2 polysaccharide has stronger anti-inflammatory ability.
KEYWORDS Cistanche tubulosa polysaccharide; Decolorization; Separation; Immunocompetence
管花肉苁蓉为列当科管花肉苁蓉Cistanche tubulosa(Schenk)Wight的干燥带鳞叶的肉质茎。现代研究表明,管花肉苁蓉含有苯乙醇苷类、环烯醚萜苷类、木脂素类、多糖类、生物碱类等多种生物活性物质,具有壮阳、通便、保肝、抗衰老、抗疲劳、增强免疫力及益智等功效[1-4],可用于临床治疗肾阳不足、精血亏虚、阳痿不孕、腰膝酸软、筋骨无力、肠燥便秘等症[5]。
管花肉苁蓉多糖水提物呈棕黄色,本课题组前期实验发现,该水提物中除含管花肉苁蓉多糖外,还包含水溶性色素、蛋白质等非目标成分,这给多糖的分离纯化、生物活性研究等造成了很大的困难。传统的有机溶剂脱色处理会破坏粗提物中目标成分的化学结构,降低后者的药理活性,并引入对人体有害的成分[6]。大孔吸附树脂是中药提取物中多糖脱色的常用材料,是一种性价比较高的高分子吸附材料,其物理、化学性质稳定,利用其对色素成分的选择吸附和筛分性能,可针对性地去除中药提取物中的色素,加之其可通过酸洗碱洗的方式进行再生,因而得以广泛应用[7]。本研究拟利用大孔吸附树脂对管花肉苁蓉多糖水提物进行脱色处理,并采用正交实验对脱色条件进行优化;提取物经脱色处理后,依据多糖所携带基团性质的不同,拟用离子交换柱层析的方法,进一步分离管花肉苁蓉多糖中的中性、酸性多糖组分。
已有研究表明,植物多糖具有免疫调节作用,是天然的免疫调节剂,可以激活补体系统和T/B淋巴细胞、巨噬细胞、自然杀伤(NK)细胞等免疫细胞,同时亦可促进多种细胞因子的释放,并促进抗体的生成等[8-11]。脂多糖(LPS)可激活巨噬细胞的炎症信号通路,诱导一氧化氮(NO)和诸如白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)等促炎细胞因子诱导的合成及释放,从而引发机体一系列的炎症反应[12]。本研究拟建立LPS诱导的小鼠RAW264.7巨噬细胞炎症模型,从管花肉苁蓉多糖对巨噬细胞增殖、炎症因子分泌和NO产生等方面的影响入手,初步评价其对机体免疫活性的影响,旨在为深入研究管花肉苁蓉多糖抗炎活性物质基础以及开发其多糖资源提供理论依据。
1 材料
1.1 主要仪器
本研究所用主要仪器包括UV-2550型紫外-可见分光光度计(日本Shimadzu公司)、Multiskan Go型全波长酶标仪(美国Thermo Fisher Scientific公司)、Herocell 180型CO2培养箱(上海润度生物科技有限公司)、AB135-S型分析天平(瑞士Mettler Toledo公司)、OSB-2100EYELA型油浴锅(上海爱郎仪器有限公司)、N-1001EYELA型旋转蒸发仪(上海爱郎仪器有限公司)、THZ-100型恒温摇床(上海一恒仪器有限公司)、3-18K型离心机(德国Sartorius AG公司)、IX71-12FL/PH型荧光倒置显微镜(日本Olympus公司)等。
1.2 主要药品与试剂
管花肉苁蓉多糖水提物(批号20180201,每克多糖相当于17.36 g管花肉苁蓉)由新疆和田帝辰医药生物科技有限公司惠赠,样品于密封、阴凉、干燥处存放;蒽酮(批号20190120)购自上海科丰实业有限责任公司;无水葡萄糖(分析纯,批号:20181115)购自天津市科密欧化学试剂有限公司;DEAE-650M离子交换填料(粒径40~90 μm)购自日本Tosoh公司;AB-8大孔吸附树脂(粒径3.3~1.25 mm)购自天津市光复精细化工研究所;胎牛血清(FBS,批号1966173C)购自美国Gibco公司;DMEM高糖培养基(批号AF29562465)、链霉素+青霉素双抗(批号AB10166019)、胰蛋白酶(批号SH30042.01)均购自美国Hyclone公司;磷酸盐缓冲液(PBS,批号2035126,pH 7.4)购自以色列BI公司;NO检测试剂盒(Griess法)(批号011020200430)購自北京索莱宝科技有限公司;LPS购自美国Sigma公司;CCK-8细胞增殖毒性测定试剂盒(批号BJ05203090)购自北京博奥森生物技术有限公司;IL-6(批号202012)、TNF-α(批号201922)酶联免疫吸附测定(ELISA)试剂盒均购自上海酶联生物科技有限公司;其余试剂均为分析纯,水为纯化水。
1.3 细胞株
小鼠巨噬细胞RAW264.7购自中国科学院上海生命科学研究院细胞资源中心。
2 方法与结果
2.1 相关指标的检测
2.1.1 色素波长的选择及多糖脱色率的计算 管花肉苁蓉多糖水提物经水适当稀释后,使用紫外-可见分光光度计进行紫外-可见全波长扫描,结果未见最大吸收波长。因溶液呈现的颜色是溶液吸收光的互补色,管花肉苁蓉多糖水提物脱色前后、稀释前后均为黄棕色,可知溶液主要吸收蓝色波段的可见光[13]。因此,选择处于该波段吸光度较大的450 nm作为检测波长,并按如下公式计算多糖脱色率:多糖脱色率(%)=(A1-A2)/A1×100%(式中,A1和A2分别为管花肉苁蓉多糖水提物经大孔吸附树脂处理前、后在450 nm波长处的吸光度)。
2.1.2 多糖质量浓度的测定及多糖保留率的计算 按2020年版《中国药典》(一部)中灵芝多糖含量测定项下的硫酸-蒽酮法处理管花肉苁蓉中多糖[14]:使用使用紫外-可见分光光度计于625 nm波长处测定吸光度(A),并根据回归方程A=39.603c-0.077 1(R 2=0.999 8)计算管花肉苁蓉多糖的质量浓度[15],并按如下公式计算多糖保留率:多糖保留率(%)=c2/c1×100%(式中,c1和c2分别为管花肉苁蓉多糖水提物用大孔吸附树脂处理前、后管花肉苁蓉多糖的质量浓度)。该方法的方法学考察结果均符合2020年版《中国药典》(四部)的相关规定[16]。
2.2 吸附脱色实验
2.2.1 大孔吸附树脂的预处理 AB-8大孔吸附树脂(类型据前期研究结果选择)用95%乙醇浸泡24 h,倒去浮在水面的小颗粒树脂后,用水清洗至澄清、无醇味,然后分别用5%盐酸溶液和5%氢氧化钠溶液浸泡24 h,用水清洗至中性,最后用水浸泡并封存,备用。
2.2.2 洗脱方法 取经预处理的AB-8大孔吸附树脂1.0 g,置于锥形瓶中,加入质量浓度为8 mg/mL的管花肉苁蓉多糖溶液50 mL,摇床振摇3 h,抽滤,接流出液,浓缩,烘干,备用。
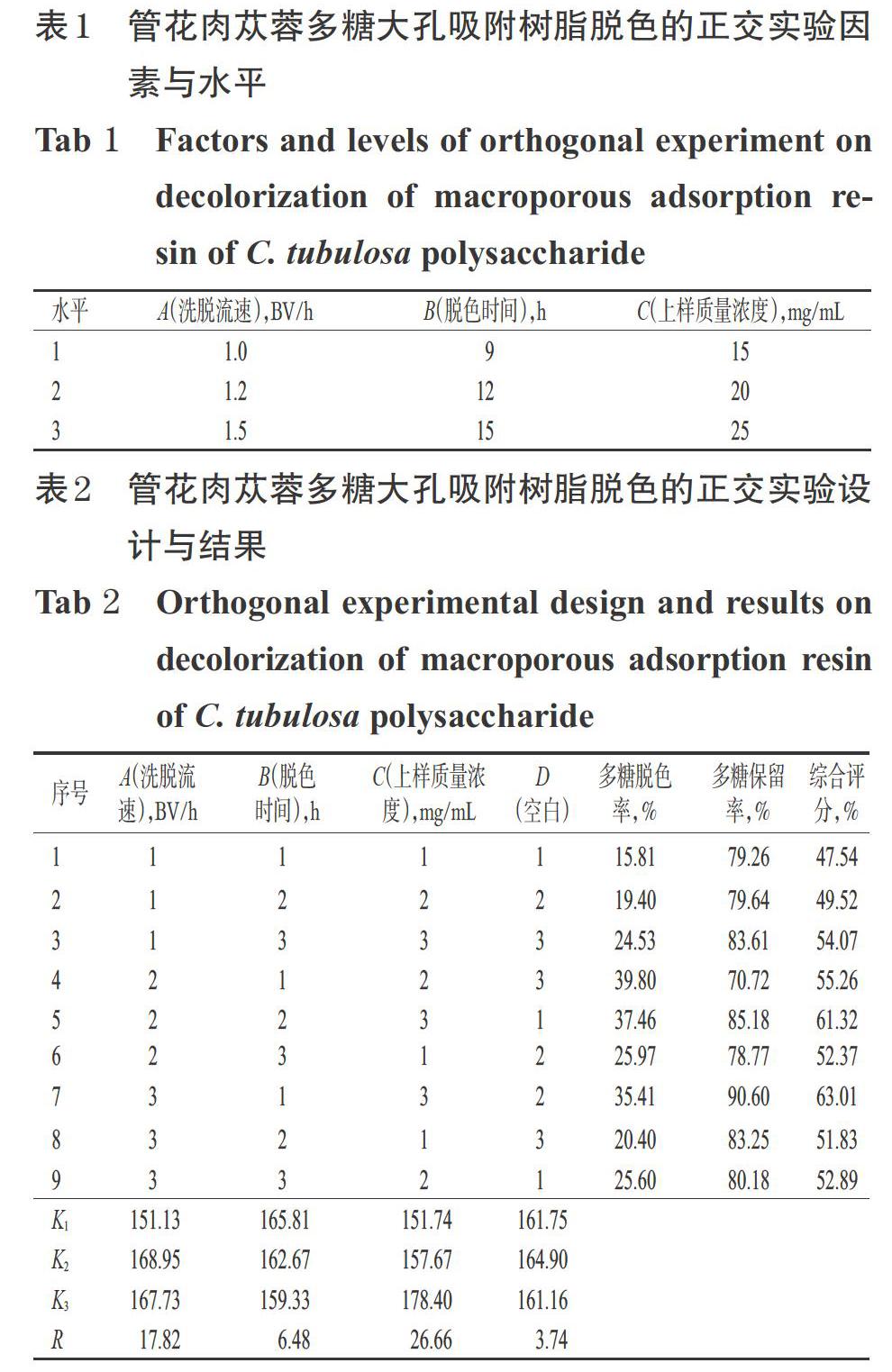
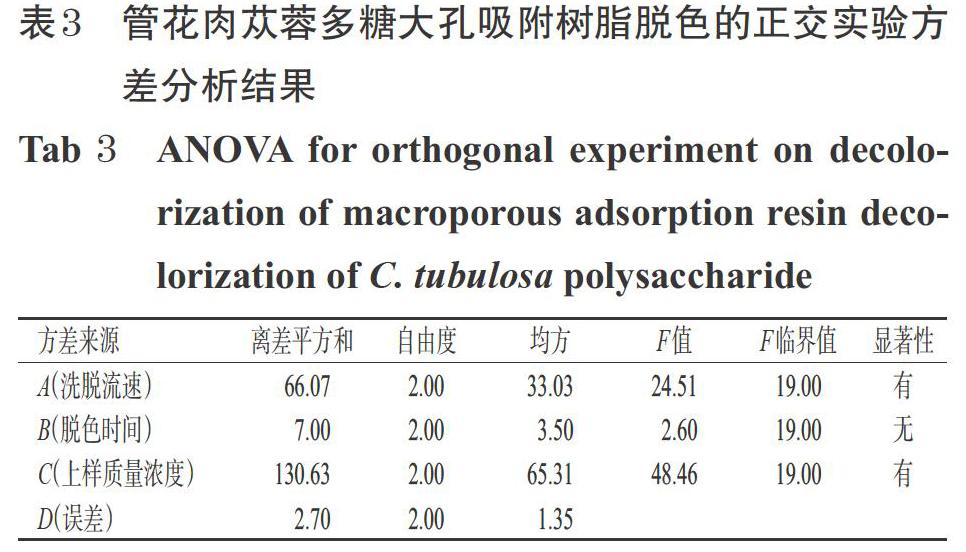
2.2.3 实验参数优化 在参考文献[17-19]和前期单因素实验的基础上,以多糖脱色率、多糖保留率为指标计算综合评分(根据前期研究结果设置权重均为50%),选用L9(34)正交实验设计对大孔吸附树脂脱色的洗脱流速(A,BV/h)、脱色时间(B,h)、上样质量浓度(C,mg/mL)进行优化,确定管花肉苁蓉多糖的大孔吸附树脂脱色最优工艺条件。管花肉苁蓉多糖大孔吸附树脂脱色的正交实验因素与水平见表1,实验设计与结果见表2,方差分析结果见表3。
由表2的极差结果可知,各因素对综合评分的影响由高到低为C>A>B,说明上样质量浓度对大孔吸附树脂脱色效果的影响最大,其次是洗脱流速和脱色时间。由表3的方差分析结果可知,上样质量浓度和洗脱流速对大孔吸附树脂的脱色效果均有显著影响,脱色时间的影响不显著。根据上述正交实验结果可知,大孔吸附树脂脱色的最优参数组合为A2B1C3,即洗脱流速1.2 BV/h,脱色时间9 h,上样质量浓度25 mg/mL。
2.2.4 验证实验 取质量浓度为25 mg/mL的管花肉苁蓉多糖溶液3份,分别上样至填有大孔吸附树脂的层析柱(100 cm×6 cm)中,分别吸附9 h后开始洗脱,洗脱流速为1.2 BV/h,接流出液,浓缩后检测多糖脱色率、多糖保留率并计算综合评分。结果,3次重复试验综合评分分别为63.43%、63.29%、63.34%,平均值为63.35%(RSD=0.11%,n=3),表明此脱色方法可行。
2.3 管花肉苁蓉粗多糖的初步分离
2.3.1 DEAE-650M离子交换填料的预处理 先把DEAE-650M离子交换填料倒入较大的容器内,加入3~4倍体积的水浸泡,等填料大部分沉底后弃去上清液,再加入水重复以上操作3~5次,备用。
2.3.2 粗多糖分离 将层析柱(80 cm×4 cm)垂直固定在层析架上,装上经预处理的DEAE-650M离子交换填料,将已脱色的管花肉苁蓉多糖(记为CTC)溶液250 mL,以25 mg/mL的质量浓度上样至层析柱中,分别用水和系列浓度的氯化钠溶液(0.1、0.2、0.3、0.4、0.5 mol/L)依次进行洗脱,收集洗脱液。其中,水洗脱下来的成分为中性多糖,不同浓度的氯化钠溶液洗脱得到的为酸性多糖。将收集的洗脱液按洗脱曲线合并,经浓缩、透析后,冻干得到多个多糖组分。结果,分离出1种中性多糖,记为CTZ,含量为229.2 mg/g;0.1、0.2、0.3、0.4、0.5 mol/L氯化钠溶液洗脱的各酸性多糖分别命名为CT-1、CT-2、CT-3、CT-4、CT-5,含量分别为168.0、123.2、121.6、54.4、11.2 mg/g。
2.4 管花肉苁蓉多糖对巨噬细胞免疫活性的影响
2.4.1 细胞增殖率的检测 采用CCK-8法进行检测。实验分为空白组[只含完全培养基(含有10%FBS、100 U/mL的链霉素和100 U/mL青霉素,下同)]、对照组(含细胞与完全培养基)和不同质量浓度的CTC、CTZ、CT1、CT2、CT3、CT4、CT5组(含细胞、完全培养基和6.25、12.5、25、50、100 μg/mL的管花肉苁蓉多糖、中性多糖和各酸性多糖,根据预实验结果设置质量浓度),每组设5个复孔。取对数生长期的RAW264.7细胞,用胰蛋白酶消化后,以1 000 r/min离心5 min,吸弃上清液,加入完全培养基调整细胞浓度,并按1×105 mL-1接种至96孔板中,每孔100 μL,置于37 ℃、5%CO2培养箱(下同)内培养。待细胞贴壁后,每孔吸弃上清液,按上述分组加入完全培养基或含相应药液的完全培养基,继续培养24 h后,每孔加入CCK-8试剂10 μL,室温孵育1 h后,用酶标仪在450 nm波长处检测各孔的吸光度(A)值并计算细胞增殖率:细胞增殖率(%)=(实验组A值-空白组A值)/(對照组A值-空白组A值)×100%。采用SPSS 25.0软件对数据进行统计分析。计量资料以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05表示差异有统计学意义。管花肉苁蓉多糖对RAW264.7细胞增殖率的影响见表4。
由表4可知,与对照组比较,6.25~100 μg/mL CTZ(6.25 μg/mL除外)、CT2、CT4、CT5组和6.25 μg/mL CTC组细胞的增殖率均显著增加(P<0.05),6.25~100 μg/mL CT1、CT3组和50 μg/mL CTC组细胞的增殖率均显著降低(P<0.05)。
按照毒性分级标准,细胞增殖率≥100%为0级,75%~99%为1级,50%~74%为2级,25%~49%为3级,1%~24%为4级,<1%为5级,其中0和1级被认为对细胞无毒性[13]。结果,当CT1、CT3质量浓度为100 μg/mL时,毒性可达到2级,因此选择12.5、25、50 μg/mL作为后续研究的低、中、高质量浓度。
2.4.2 NO释放量的检测 采用Griess法进行检测。实验分为对照组(含细胞与完全培养基)、LPS组(含细胞、完全培养基和终质量浓度为1 μg/mL的LPS)和低、中、高质量浓度的CTC、CTZ、CT1、CT2、CT3、CT4、CT5组[含细胞、完全培养基、终质量浓度为1 μg/mL的LPS和低、中、高质量浓度(12.5、25、50 μg/mL)的管花肉苁蓉多糖、中性多糖和各酸性多糖],每组设3个复孔。取对数生长期的RAW264.7细胞,按“2.4.1”项下方法消化、重悬后,按1×105 mL-1接种至48孔板中,每孔300 μL,同法培养。待细胞贴壁后,吸弃去上清液,按上述分组加入完全培养基或含相应药液的完全培养基,继续培养48 h后,收集细胞上清液,以1 000 r/min离心15 min,取上清液,使用酶标仪在540 nm波长处检测各孔的A值,按NO检测试剂盒说明书方法计算NO释放量,并按“2.4.1”项下方法进行统计分析,结果见表5。
由表5可知,与对照组比较,LPS组细胞的NO释放量显著升高(P<0.05)。与LPS组比较,低、中、高质量浓度CTC、CTZ(中、高质量浓度除外)、CT2、CT3、CT5组细胞的NO释放量均显著降低(P<0.05);此外,高質量浓度CT1、CT4组细胞的NO释放量均显著升高(P<0.05)。
2.4.3 IL-6、TNF-α释放量的检测 按ELISA法进行检测。取对数生长期RAW264.7细胞,按“2.4.1”项下方法消化、重悬后,按1×105 mL-1接种至48孔板中,每孔500 μL,同法培养。待细胞贴壁后,吸弃上清液,按“2.4.2”项下方法进行分组、加药、培养,收集细胞上清液,以1 000 r/min离心15 min,收集上清液,使用酶标仪在450 nm波长处检测各孔的A值,按ELISA试剂盒说明书方法计算IL-6、TNF-α释放量,并按“2.4.1”项下方法进行统计分析,结果见表5。
由表5可知,与对照组比较,LPS组细胞的IL-6、TNF-α释放量均显著升高(P<0.05)。与LPS组比较,除高质量浓度CT1组细胞的IL-6释放量显著升高(P<0.05)、中质量浓度CT1组细胞的TNF-α和低质量浓度CT5组细胞的IL-6释放量均无显著变化(P>0.05)外,其余各组细胞的IL-6、TNF-α释放量均显著降低(P<0.05)。
3 讨论
前期研究发现,水提管花肉苁蓉中多糖时会有较多水溶性物质一同溶出,影响管花肉苁蓉多糖纯度,因此进一步对其进行分离纯化,可为多糖物质基础及生物活性研究奠定基础。大孔吸附树脂法是常用的脱色方法[17-19]。由于目前还不清楚管花肉苁蓉中色素成分的极性,所以课题组前期通过静态吸附实验,从不同极性的大孔吸附树脂中筛选了最适大孔吸附树脂AB-8,该树脂对非目标成分具有较好的吸附能力,又对管花肉苁蓉多糖具有较好保留能力。为达到更好的脱色效果,本研究在前期研究基础上,采用正交实验对脱色工艺(洗脱流速、脱色时间、上样质量浓度)进行了优化。结果,管花肉苁蓉多糖的最优脱色方法为洗脱流速1.2 BV/h,脱色时间9 h,上样质量浓度25 mg/mL。验证实验结果显示,本脱色方法可行。
天然多糖的纯度及种类是影响其活性的重要因素,因此多糖分离纯化方法的相关研究仍然是天然活性多糖研究工作的重点。多糖分离常用的方法有沉淀法、凝胶色谱法、阴离子交换色谱法、大孔树脂柱色谱法和超滤法等[20]。多糖因单糖组成不同,其所带电荷性质也会有一定的差异,可被分为中性多糖和酸性多糖。中性多糖是由2种以上不含有机酸的不同糖基单体构成的聚合物;而酸性多糖在组成成分和结构上要比中性多糖复杂,除含有2种以上的糖基单体外,还含有糖醛酸单体[21]。阴离子交换柱层析法是利用多糖所带电荷的差异将中性多糖与酸性多糖进行分离[22]。为此,本研究采用DEAE-650M离子交换柱层析柱对管花肉苁蓉多糖进行分离,共分离出1种中性多糖、5种酸性多糖。
巨噬细胞是免疫活性细胞,可通过吞噬和杀伤病原微生物,从而起到调节免疫的作用。已有研究表明,当人体受到病理或机械损伤刺激时,药物干预可激活巨噬细胞使LPS诱导的巨噬细胞吞噬能力增强,进而抑制NO的产生和IL-6、TNF-α等系列炎症细胞因子的分泌,从而保护宿主免受病原体的侵害[23]。为此,本研究检测了各种管花肉苁蓉多糖对RAW264.7细胞增殖率的影响,以及对LPS诱导巨噬细胞释放NO、IL-6、TNF-α的影响。结果,在12.5、25、50 μg/mL质量浓度范围内,既对RAW264.7细胞增殖起一定的促进作用,又可显著抑制LPS诱导的RAW264.7细胞释放NO、IL-6、TNF-α的管花肉苁蓉多糖为CT2。相关研究显示,多糖的单糖组成和分子量会影响其免疫调节活性,半乳糖、阿拉伯糖、甘露糖以及葡萄糖等单糖与多糖的免疫活性成正相关[24],分子量较大的多糖可能含有较多的高度重复结构,可以多向性交叉连接质膜表面受体,特异性增强免疫调节效果[25]。因此本研究中的酸性多糖CT2的单糖组成中可能含有特殊的单糖或含多个与免疫活性正相关的单糖,且分子量可能较中性多糖和其他酸性多糖大,但有待进一步研究确认。
综上所述,本研究所优化的大孔吸附树脂脱色工艺稳定、可行;可从管花肉苁蓉多糖水提物中分离出1种中性多糖、5种酸性多糖,其中酸性多糖CT2的免疫活性较强。本研究可为管花肉苁蓉多糖的开发利用奠定实验基础。
参考文献
[ 1 ] 杨胜杰,刘明川,杨进平,等.管花肉苁蓉提取物通便作用的实验研究[J].北方药学,2019,16(8):128-130.
[ 2 ] GUO Y H,CAO L L,ZHAO Q S,et al. Preliminary cha- racterizations,antioxidant and hepatoprotective activity of polysaccharide from Cistanche deserticola[J]. Int J Biol Macromol,2016,93(Pt A):678-685.
[ 3 ] 范亚楠,黄玉秋,贾天柱,等.肉苁蓉炮制前后对衰老模型大鼠抗衰老及免疫功能的影响[J].中华中医药学刊,2017,35(11):2882-2885.
[ 4 ] GU L,XIONG W T,ZHUANG Y L,et al. Effects of Cistanche deserticola extract on penis erectile response in ca- strated rats[J]. Pak J Pharm Sci,2016,29(2):557-562.
[ 5 ] 朱乃亮,徐荣,吴海峰,等.荒漠肉苁蓉和管花肉苁蓉指纹图谱比较研究[J].中国药学杂志,2016,51(13):1116- 1119.
[ 6 ] 李月,王昀,左绍远.植物多糖脱色工艺研究进展[J].现代化工,2018,38(10):31-33,35.
[ 7 ] 常明泉,車向前,江蓉敬.含多糖中药提取物脱色方法研究进展[J].中国药师,2017,20(5):893-896.
[ 8 ] KIM H S,KIM Y J,LEE H K,et al. Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through Toll-like receptor 4[J]. Food Chemi Toxicol,2012,50(9):3190-3197.
[ 9 ] 徐伟,方思佳,关然,等.白术多糖对小鼠淋巴细胞的免疫调节作用[J].中国免疫学杂志,2020,36(13):1573-1577.
[10] 韦喜生,刘英香,郑晓君. NK细胞联合红花多糖对结肠癌细胞的杀伤作用及机制研究[J].中国免疫学杂志,2020,36(5):571-576.
[11] 孙伟,童仕伦,郑勇斌,等.红花多糖对人结肠癌LoVo细胞增殖、凋亡、侵袭作用机制研究[J].安徽医药,2016,20(6):1045-1050.
[12] 郭婷婷.香兰素对LPS诱导急性肺损伤的预保护作用机制研究[D].长春:吉林大学,2020.
[13] 陈卓尔,李敏,王小静,等.大孔吸附树脂对维药恰麻古粗多糖脱色纯化工艺研究[J].应用化工,2017,46(2):230-233,239.
[14] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:195-196.
[15] 艾拉旦·麦麦提艾力,杨婷,袁洁,等.管花肉苁蓉药渣中多糖提取工艺及体外抗氧化活性研究[J].化学与生物工程,2020,37(2):36-41.
[16] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:480-483.
[17] 何钊,李娴,陈智勇,等.大孔吸附树脂对白蜡虫多糖脱色及抗氧化活性的影响[J].林业科学研究,2014,27(1):31-37.
[18] 刘瑞,张弘弛,延文星,等. XDA-4型大孔树脂对黄芪总皂苷富集工艺的优选[J].食品研究与开发,2020,41(23):92-98.
[19] 蔺蓓蓓,郑红星,刘祥,等.天麻中总多酚的大孔树脂纯化工艺优化[J].中国药房,2019,30(14):1965-1969.
[20] 李翠丽,王炜,张英,等.中药多糖提取、分离纯化方法的研究进展[J].中国药房,2016,27(19):2700-2703.
[21] 熊清平.田螺硫酸多糖的制备、表征及稳定动脉粥样硬化斑块作用研究[D].广州:广州中医药大学,2019.
[22] 丁卫军,楚占营.天然产物中活性多糖提取纯化技术进展[J].生命科学仪器,2016,14(5):20-24.
[23] 吴怡亮,仲磊,马宁,等.大豆分离蛋白-杏鲍菇多糖共价结合物对RAW264.7细胞的免疫调节作用[J].食品科学,2019,40(17):202-207.
[24] 肖颖,吴梦琪,张文清,等.茯苓多糖HPLC指纹图谱与免疫活性的相关分析[J].华东理工大学学报(自然科学版),2020,46(5):672-679.
[25] 吴磊,吴静,胡居吾,等.白莲莲子皮多糖的理化性质及免疫调节活性[J].现代食品科技,2021,37(5):100-108,129.
(收稿日期:2021-01-24 修回日期:2021-05-31)
(编辑:邹丽娟)

