戒烟干预对早期稳定期慢性阻塞性肺疾病患者气道局部免疫及生活质量的影响研究
刘贤兵,李芳,徐宁,祝利芬,郑晓燕
慢性阻塞性肺疾病(COPD)具有较高患病率、致残率及病死率,对人类危害巨大[1],且早期具有隐蔽性,当症状明显时常已经处于疾病中晚期。因早期COPD〔慢性阻塞性肺疾病全球倡议(GOLD)1级或慢性阻塞性肺疾病评估测试(CAT)评分<10分〕常无临床症状,或仅有少许咳嗽及活动后胸闷等症状,故常被临床忽视[2]。吸烟是COPD发病的重要因素之一,而戒烟是最有效、成本效益最高的延缓COPD进展的干预措施[3]。吸烟对人类的危害是巨大的,是社会性问题。戒烟不仅可以预防COPD,还可以有效地延缓气流受限,减缓肺功能恶化[4]。COPD患者局部气道免疫功能下降是导致其发生呼吸道感染或急性加重的重要原因之一,吸烟时有害物质直接接触气道,对局部气道产生各种损伤,局部气道的免疫屏障也受到了破坏,从而严重影响患者的生活质量及预后[5]。戒烟能使戒烟者获益,目前戒烟干预的文献较多,但是关于戒烟和局部气道免疫情况的研究相对较少,而且针对早期COPD的戒烟干预的研究也不多。但是在COPD防治中,早期防治才是防治的重点,然而此期患者常对各种治疗有抵触,因此戒烟作为最有效、成本效益最高的延缓 COPD 进展的干预措施就显得尤为重要。故本研究通过观察早期COPD患者经过戒烟干预后气道局部免疫指标变化情况,以及生活质量改善情况,探讨戒烟的重要性及局部气道免疫变化对患者生活质量和预后的影响。
1 资料和方法
1.1 研究对象 选取2016年6月—2019年6月到浙江省衢州市人民医院就诊的符合以下纳入排除标准的早期稳定期COPD患者170例。纳入标准:(1)符合GOLD 2011早期COPD诊断标准[6]:肺功能GOLD 1~2级或综合评估处于A级〔0或1次急性加重史/年,且未导致入院;慢性阻塞性肺疾病评估测试(CAT)评分<10分或呼吸困难量表(mMRC)评分0~1分〕;(2)符合烟草依赖标准[7];(3)未使用过免疫抑制剂及长期全身糖皮质激素等影响机体免疫功能的药物;(4)未接受除戒烟治疗外的任何针对COPD的治疗(患者因COPD早期阶段无明显不适,故拒绝使用药物干预,但同意随访);(5)现在或将来有戒烟意愿的患者;(6)年龄40~80岁,来自衢州地区,自愿入组,并签署知情同意书,可完成为期1年的6次随访。排除标准:(1)合并其他严重疾病的患者;(2)支气管哮喘、肺结核、支气管扩张、间质性肺疾病等其他慢性肺部疾病患者;(3)预期寿命<1年的恶性肿瘤患者;(4)各种原因需要吸入糖皮质激素治疗患者;(5)有精神类疾病患者;(6)依从性差,且多次给予健康教育后仍对自身疾病不重视者。本研究经浙江省衢州市人民医院伦理委员会批准〔编号:伦理Y第(2020-07-12)号〕,研究对象均知情同意。
1.2 研究方法
1.2.1 分组 对COPD患者进行戒烟教育,最终按患者意愿,分为戒烟组(106例)及未戒烟组(64例)。戒烟组按不同烟草依赖程度给予戒烟干预,最终戒烟成功者(戒烟成功组)48例,戒烟失败者(戒烟失败组)58例,戒烟失败组均在随访1个月内复吸。戒烟干预:采用“5A”干预法联合药物干预。5A包括询问(Ask)、建议(Advise)、评估(Assess)、帮助(Assist)、安排随访(Arrange),成立戒烟小组于患者开始戒烟后每2周进行一次电话随访持续1年。药物干预,采用酒石酸伐尼克兰片(商品名:畅沛,辉瑞制药有限公司)进行戒烟治疗,戒烟前1~2周开始用药,使用启动装+维持装,疗程:8~12周。符合以下2项标准即判定为戒烟成功:(1)6个月内未吸烟;(2)经呼出CO检测证实(呼出CO≤10 ppm即判断为未吸烟)[7]。
1.2.2 观察指标 (1)一般资料:收集研究对象性别、年龄、吸烟指数(吸烟指数=每天吸烟支数×吸烟年数)等。(2)对患者随访1年(即:0个月、0.5个月、1个月、3个月、6个月、9个月及12个月),记录不同时间点患者以下指标:①诱导痰免疫指标:T淋巴细胞亚群(CD3+、CD4+、CD4+/CD8+、CD8+)、免疫球蛋白(IgG、IgA、lgM)及补体C3、C4;②肺功能检查〔第1秒用力呼气末容积(FEV1),仪器型号:德国耶格MasterScreen大型肺功能仪〕;③生活质量:咳嗽情况、咳痰情况、呼吸困难情况、CAT评分、烟草依赖情况、吸烟严重度指数、呼出CO值、合并焦虑/抑郁情况,并记录患者随访前1年内及随访期间呼吸道感染情况及COPD急性加重情况。
1.2.3 临床症状评分标准 (1)咳嗽情况:采用咳嗽积分表[8]进行评定,将日间和夜间咳嗽按频率和强度划分为0~3分4个等级,无咳嗽计0分、间断咳嗽计1分、经常咳嗽计2分、昼夜或剧烈咳嗽计3分。分值越大,表示咳嗽越剧烈,对患者生活质量的负面影响也更明显。(2)咳痰情况:采用咳痰积分表[8]进行评定,无痰计0分;咳痰量0~<10 ml/d计1分;10~50 ml/d计2分;>50 ml/d 计3分。(3)呼吸困难情况:采用改良英国医学研究学会mMRC[9]进行评定,根据患者活动能力分为5级(0~4级)。气促或呼吸困难:仅在费力运动时出现呼吸困难计0分(0级);平地快步行走或步行爬小坡时出现气促计1分(1级);由于气促,平地行走时较同龄人速度慢或需要停下来休息计2分(2级);在平地上步行100 m或数分钟后需要停下来喘气计3分(3级);严重呼吸困难以至于不能离开家,或在穿衣服、脱衣服时出现呼吸困难计4分(4级)。mMRC的级别≥2级,提示患者的症状评分高。(4)日常生活质量情况采用CAT评分[9]进行评定:采用CAT问卷进行调查。CAT问卷共包括8个项目:咳嗽、咳痰、胸闷、睡眠、精力、情绪、运动耐力、日常运动影响。患者根据自身情况,对每个项目做出相应评分(0~5分),CAT分值范围是0~40分。得分为0~10分为“轻微影响”,11~20分为“中等影响”,21~30分为“严重影响”,31~40分为“非常严重影响”。患者CAT评估测试≥2分的差异或改变量即可提示具有临床意义。CAT评分≥10分时,提示患者的症状评分高。(5)烟草依赖评分:采用《中国临床戒烟指南(2015年版)》[7]推荐的法氏烟草依赖评估量表(fagerstrom test for nicotine dependence,FTND)进行评分。0~3分为轻度烟草依赖;4~6分为中度烟草依赖;≥7分为重度烟草依赖。(6)吸烟严重度指数[7]:评估内容为您早晨醒来后多长时间吸第一支烟?>60 min为0分,31~60 min为1分,6~30 min为2分,≤5 min为3分;您每天吸多少支卷烟?≤10支为0分,11~20支为1分,21~30支为2分,>30支为3分,≥4分为重度烟草依赖。(7)呼出CO检测采用我院袖珍式医用一氧化碳检测仪检测(型号QT-200)。(8)焦虑/抑郁情况:采用抑郁焦虑量表(HAD)进行评定,HAD共由14个条目组成,其中7个条目评定抑郁,7个条目评定焦虑。共有6条反向提问条目,5条抑郁分量表,1条焦虑分量表;0~7分属无症状,8~10分属症状可疑,11~21分属肯定存在症状。但对于HAD筛查的临界数值,目前仍不统一,本研究采用刘贤兵等[10]的研究结果,以9分作为焦虑或抑郁的临界值。(9)COPD急性加重情况的判断标准[9]:胸部症状加重(胸闷、不适、胸部紧迫感),咳嗽、咳痰增加,呼吸急促增加(日常活动时),且至少持续2 d。要求患者独立完成各种问卷,如有疑问,可以做适当的解释,但不能做任何有暗示性的提醒,调查结束后立即统计出分值,并由患者签字。完成问卷后再进行肺功能检查。
1.2.4 诱导痰收集、处理及诱导痰T淋巴细胞亚群、免疫球蛋白(IgG、IgA、lgM)及补体检测 按标准收取痰液至少2 ml,用5倍体积的0.9%氯化钠溶液清洗,去除唾液和0.9%氯化钠溶液后,在痰液中加入等体积的痰消化酶,然后将其置于37 ℃水浴恒温振荡器充分水浴、振荡15 min,使其完全溶解。最后,将其离心(3 000 r/min,离心5 min,离心半径16 cm),提取痰上清液2 ml。诱导痰收集参照曾勉等[11]所报道的操作流程。
诱导痰T淋巴细胞亚群检测:取1 ml诱导痰上清液,先离心(1 000 r/min,离心5 min,离心半径16 cm),弃上清液,再加入20 μl抗体(CD3+/CD4+/CD8+抗体),混匀后在室温(25 ℃)下避光孵育15 min,上机分析。(CD3+/CD4+/CD8+)三色荧光单克隆抗体购自美国BD公司。流式细胞检测仪(型号:BD FACSCalibur)。
诱导痰lgG、lgA、lgM及补体C3、补体C4检测:取1 ml诱导痰上清液,入生化管离心(3 500 r/min,离心5 min,离心半径16 cm),取上清液300~500 μl直接上机分析。全自动生化分析仪(型号LABOSPECT 008 AS,日立)。
1.3 统计学方法 应用SPSS 17.0软件对结果进行统计学分析。符合正态分布的计量资料采用(±s)表示,两组间比较采用两独立样本t检验;多组间比较采用双因素重复测量方差分析。计数资料以相对数表示,组间比较采用χ2检验。采用Pearson相关分析探讨各时间点免疫功能指标与各指标的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 未戒烟组与戒烟组各指标比较 两组患者年龄、性别分布、吸烟指数、烟草依赖评分、吸烟严重度指数评分、呼出CO值、肺功能、咳嗽情况、咳痰情况、mMRC级别、CAT评分、HAD评分、随访前1年呼吸道感染情况及COPD急性加重情况、CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM、补体 C3、补体 C4比较,差异均无统计学意义(P>0.05),见表1。

表1 未戒烟组与戒烟组各指标比较Table 1 Comparison of indicators between non-smoking group and smoking cessation group
2.2 3组各不同时间点生活质量及肺功能指标情况比较组别与时间在咳嗽评分、咳痰评分、FEV1、mMRC评分、CAT评分、HAD评分、烟草依赖评分、吸烟严重度指数评分、呼出CO值、随访期间呼吸道感染次数、随访期间患者急性加重次数上存在交互作用(P<0.05),组别在咳嗽评分、咳痰评分、FEV1、mMRC评分、CAT评分、HAD评分、烟草依赖评分、吸烟严重度指数评分、呼出CO值、随访期间呼吸道感染次数、随访期间患者急性加重次数上主效应显著(P<0.05),时间在咳嗽评分、咳痰评分、FEV1、mMRC评分、CAT评分、HAD评分、烟草依赖评分、吸烟严重度指数评分、呼出CO值、随访期间呼吸道感染次数、随访期间患者急性加重次数上主效应显著(P<0.05)。随访0.5个月时,未戒烟组咳嗽评分高于戒烟成功组和戒烟失败组、咳痰评分低于戒烟成功组和戒烟失败组,随访6、9、12个月时咳嗽评分、咳痰评分高于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访1个月时,未戒烟组FEV1水平低于戒烟成功组,随访3、6、9、12个月时未戒烟组FEV1水平低于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访1、3、6、9、12个月时未戒烟组mMRC评分、CAT评分、烟草依赖评分、呼出CO值高于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访0.5个月时未戒烟组HAD评分低于戒烟成功组和戒烟失败组,随访1、3、6、9、12个月时戒烟成功组HAD评分低于未戒烟组和戒烟失败组,差异有统计学意义(P<0.05)。随访0.5、1、3、6、9、12个月时未戒烟组吸烟严重度指数评分高于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访1、3、6个月时未戒烟成功组随访期间呼吸道感染发病次数及随访期间患者急性加重次数多于戒烟成功组,少于戒烟失败组,随访9、12个月时未戒烟组随访期间呼吸道感染发病次数及随访期间患者急性加重次数多于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随着随访时间延长,未戒烟组咳嗽评分、咳痰评分、CAT评分、mMRC评分、HAD评分、烟草依赖评分、吸烟严重度指数、呼出CO值、随访期间呼吸道感染发病次数、随访期间COPD急性加重次数逐渐上升,FEV1逐渐下降,差异有统计学意义(P<0.05);随着随访时间延长,戒烟成功组咳嗽评分、咳痰评分、CAT评分、mMRC评分、HAD评分、烟草依赖评分、吸烟严重度指数、呼出CO值、随访期间呼吸道感染发病次数、随访期间COPD急性加重次数逐渐下降,FEV1逐渐上升,差异有统计学意义(P<0.05)。随着随访时间延长,戒烟失败组各指标比较,差异无统计学意义(P>0.05),见表2。
表2 三组不同时间点生活质量及肺功能指标情况比较(±s)Table 2 Comparison of life quality and lung function indicators in each survey point of the three groups

表2 三组不同时间点生活质量及肺功能指标情况比较(±s)Table 2 Comparison of life quality and lung function indicators in each survey point of the three groups
咳嗽评分(分)0个月 0.5个月 1个月 3个月 6个月 9个月 12个月戒烟成功组 48 0.48±0.71 0.65±0.7 a 0.50±0.58 0.50±0.58 0.38±0.53 a 0.38±0.53 a 0.31±0.51a戒烟失败组 58 0.26±0.44 0.43±0.45 a 0.45±0.45 0.45±0.65 0.66±0.78 a 0.66±0.78 a 1.21±0.67a未戒烟组 64 65.00±4.25 64.36±4.13 64.16±3.47 64.36±4.13 60.78±3.20 60.48±3.00 59.36±3.68 F 值 F交互=7.83,F组间=6.52,F时间=18.47 P 值 P交互<0.001,P组间<0.001,P时间<0.001组别 例数咳痰评分(分)0个月 0.5个月 1个月 3个月 6个月 9个月 12个月戒烟成功组 0.54±0.68 0.61±0.65 a 0.44±0.54 0.44±0.54 0.35±0.23 a 0.36±0.53 a 0.36±0.51 a戒烟失败组 0.26±0.44 0.65±0.70 a 0.64±0.72 0.64±0.72 0.78±0.77 a 0.78±0.77 a 1.28±0.69 a未戒烟组 0.39±0.61 0.58±0.70 0.72±0.68 0.72±0.68 0.91±0.75 1.03±0.76 1.38±0.65 F值 F交互=7.97,F组间=7.39,F时间=20.67 P值 P交互<0.001,P组间<0.001,P时间<0.001组别FEV1(L)0个月 0.5个月 1个月 3个月 6个月 9个月 12个月戒烟成功组 2.07±0.28 2.07±0.28 2.12±0.30a 2.37±0.30a 2.46±0.26a 2.40±0.27a 2.41±0.33a戒烟失败组 1.85±1.59 1.87±0.15 1.85±0.17 1.71±0.29a 1.60±0.23a 1.53±0.23a 1.47±0.25a未戒烟组 1.90±0.26 1.91±0.25 1.89±0.28 1.58±0.19 1.43±0.13 1.41±0.13 1.34±0.21 F值 F交互=13.20,F组间=242.73,F时间=15.59 P值 P交互<0.001,P组间<0.001,P时间<0.001组别mMRC评分(分)0个月 0.5个月 1个月 3个月 6个月 9个月 12个月戒烟成功组 0.21±0.41 0.17±0.38 0.15±0.36 a 0.14±0.35a 0.06±0.24 a 0.10±0.31a 0.10±0.30a戒烟失败组 0.26±0.44 0.22±0.42 0.29±0.46a 0.30±0.45a 0.31±0.46a 0.33±0.47a 0.78±0.42a未戒烟组 0.25±0.44 0.36±0.48 0.44±0.50 0.46±0.50 0.44±0.50 1.09±0.34 1.13±0.33 F值 F交互=19.95,F组间=27.31,F时间=26.43 P值 P交互<0.001,P组间<0.001,P时间<0.001组别

(续表2)
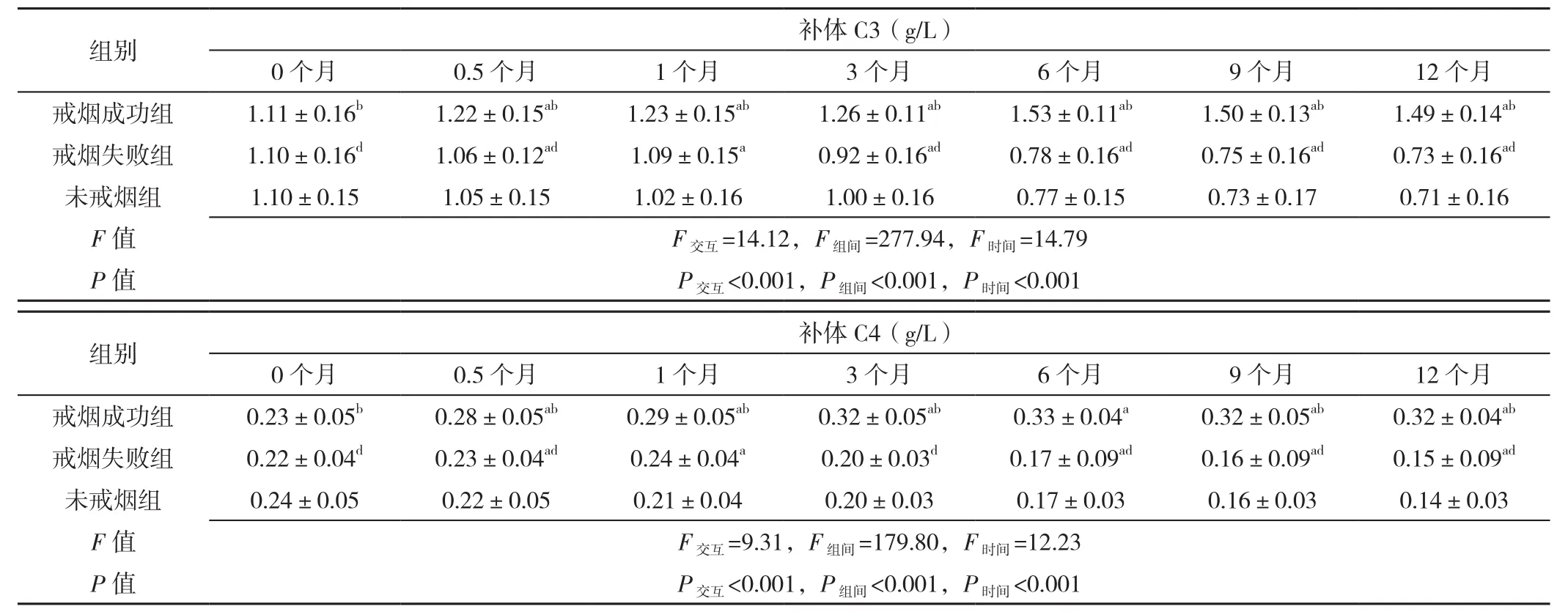
2.3 3组患者不同时间点局部气道免疫情况比较 组别与时间在CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM、补体C3、补体C4间存在交互作用(P<0.05);组别在CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM、补体C3、补体C4上主效应显著(P<0.05),时间在CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM、补体C3、补体C4上主效应显著(P<0.05)。随访0.5个月、1个月、3个月、6个月、9个月、12个月时3组CD3+、CD4+、CD8+、IgG、IgA、lgM、补体C3及补体C4水平比较,差异有统计学意义(P<0.05);随访1个月、3个月、6个月、9个月、12个月时3组CD4+/CD8+比较,差异有统计学意义(P<0.05)。随访0.5、1、6、12个月时未戒烟组CD3+水平低于戒烟成功组和戒烟失败组,随访3、9个月时未戒烟组CD3+水平低于戒烟成功组、高于戒烟失败组,差异有统计学意义(P<0.05)。随访0.5、1、3、6、9、12个月时未戒烟组CD4+水平、IgM水平、补体C3水平、补体C4水平低于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访0.5、1、3、6、9、12个月时未戒烟组CD8+水平高于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访1、3、6、9、12个月时未戒烟组CD4+/CD8+、IgG水平低于戒烟成功组和戒烟失败组,差异有统计学意义(P<0.05)。随访0.5、1、12个月时未戒烟组IgA水平低于戒烟成功组和戒烟失败组,随访3、6、9个月时未戒烟组IgA水平低于戒烟成功组、高于戒烟失败组,差异有统计学意义(P<0.05)。戒烟成功组CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、补体C3、补体C4水平在其余各随访时间与随访6个月时比较,差异有统计学意义(P<0.05)。戒烟成功组IgM水平在其余各随访时间与随访12个月时比较,差异有统计学意义(P<0.05)。戒烟失败组CD3+、CD4+、CD8+、CD4+/CD8+、IgG、IgA、IgM、补体C3、补体C4水平在其余各随访时间与随访1个月时比较,差异有统计学意义(P<0.05),见表3。
表3 三组患者各观察点局部气道免疫情况比较(±s)Table 3 Comparison of local airway immunity at each observation point in the 3 groups

表3 三组患者各观察点局部气道免疫情况比较(±s)Table 3 Comparison of local airway immunity at each observation point in the 3 groups
+(%)0个月 0.5个月 1个月 3个月 6个月 9个月 12个月戒烟成功组 48 66.戒烟失败组 58 64.未戒烟组 64 65 F 值P 值组别 例数0个戒烟成功组 31.79±戒烟失败组 32.10±未戒烟组 30.23±F值P值0个戒烟成功组 28.29±戒烟失败组 30.38±未戒烟组 29.56±F值P值组别组别0个戒烟成功组 1.12±戒烟失败组 1.08±未戒烟组 1.13±F值P值0个戒烟成功组 12.12±戒烟失败组 11.32±未戒烟组 12.01±F值P值组别0个戒烟成功组 2.58±戒烟失败组 2.60±未戒烟组 2.66±F值P值组别0个戒烟成功组 1.49±戒烟失败组 1.48±未戒烟组 1.55±F值P值组别组别14±4.28b 66.10±4.24ab 66.67±4.35ab 68.77±3.62ab 69.20±3.22a 69.60±3.34ab 70.00±2.92ab 08±3.70d 64.41±3.51ad 64.90±4.24a 61.98±3.88ad 60.84±3.48ad 60.08±2.60ad 59.89±2.51ad.00±4.25 64.36±4.13 64.16±3.47 64.36±4.13 60.78±3.20 60.48±3.00 59.36±3.68 F交互=10.10,F组间=83.83,F时间=6.41 P交互<0.001,P组间<0.001,P时间<0.001 CD3 CD4+(%)月 0.5个月 1个月 3个月 6个月 9个月 12个月5.37b 32.13±5.14ab 35.58±4.80ab 38.19±4.34ab 38.23±3.25a 38.05±3.45ab 38.19±3.37ab 4.41d 30.08±7.77ad 30.10±4.14a 27.17±4.01ad 26.36±3.93ad 25.50±3.77ad 25.01±3.92ad 7.82 29.84±4.01 28.67±6.65 26.45±3.98 25.80±4.13 23.34±1.90 21.98±2.07 F交互=9.85,F组间=123.57,F时间=10.58 P交互<0.001,P组间<0.001,P时间<0.001 CD8+(%)月 0.5个月 1个月 3个月 6个月 9个月 12个月3.65b 27.90±3.55ab 24.31±2.89ab 23.77±2.70ab 22.10±2.51a 21.88±2.52ab 21.67±2.56ab 5.14d 30.07±5.41ad 29.73±6.76a 31.34±4.8ad 32.91±4.26ad 33.81±3.45ad 34.33±3.21ad 6.75 31.22±5.98 30.62±5.26 32.84±4.25 33.24±4.59a 34.21±4.40 34.74±3.93 F交互=10.18,F组间=89.61,F时间=5.08 P交互<0.001,P组间<0.001,P时间<0.001+CD4+/CD8月 0.5个月 1个月 3个月 6个月 9个月 12个月0.39b 1.25±0.37b 1.50±0.34ab 1.55±0.30ab 1.79±0.27ab 1.77±0.28ab 1.75±0.27ab 0.27d 1.12±0.29d 1.14±0.28ad 0.90±0.26ad 0.82±0.22ad 0.77±0.19ad 0.73±0.17ad 0.52 1.12±0.52 0.99±0.43 0.83±0.22 0.80±0.20 0.70±0.09 0.65±0.10 F交互=14.16,F组间=148.03,F时间=8.22 P交互<0.001,P组间<0.001,P时间<0.001 IgG(g/L)月 0.5个月 1个月 3个月 6个月 9个月 12个月2.02b 14.00±1.91ab 14.50±1.85ab 15.48±1.41ab 16.40±0.90a 16.10±0.99ab 16.20±1.01ab 1.93d 11.66±1.96d 11.67±1.87a 10.79±1.47ad 9.94±1.22ad 9.84±1.29ad 9.67±1.21ad 2.73 11.66±3.16 11.47±3.12 10.06±2.76 8.66±1.27 8.60±1.20 8.28±0.72 F交互=8.69,F组间=196.30,F时间=6.27 P交互<0.001,P组间<0.001,P时间<0.001 IgA(g/L)月 0.5个月 1个月 3个月 6个月 9个月 12个月0.46b 2.86±0.43ab 3.29±0.41ab 3.31±0.38ab 3.43±0.38a 3.40±0.42ab 3.39±0.48ab 0.46d 2.62±0.47ad 2.66±0.77a 2.14±0.38ad 2.01±0.31ad 1.89±1.74ad 1.66±0.38ad 0.73 2.57±0.45 2.56±0.65 2.20±0.48 2.05±0.32 1.92±0.36 1.56±0.45 F交互=8.89,F组间=153.45,F时间=29.72 P交互<0.001,P组间<0.001,P时间<0.001 IgM(g/L)月 0.5个月 1个月 3个月 6个月 9个月 12个月0.24c 1.68±0.23ac 1.89±0.21ac 1.95±0.19ac 2.10±0.21ac 2.18±0.24ac 2.19±0.27a 0.27d 1.52±0.43ad 1.55±0.27a 1.45±0.25ad 1.34±0.29ad 1.32±0.31ad 1.29±0.32ad 0.45 1.49±0.44 1.48±0.26 1.44±0.36 0.89±0.23 0.87±0.23 0.84±0.22 F交互=10.80,F组间=175.63,F时间=7.76 P交互<0.001,P组间<0.001,P时间<0.001
(续表3)
2.4 3组患者随访开始时气道局部免疫功能指标与咳嗽咳痰情况、肺功能检查、mMRC分级、CAT评分、HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值相关性分析 随访开始时,3组患者CD3+、CD4+、CD4+/CD8+、IgA、IgG、IgM、补体C3、补体C4与FEV1呈正相关(P<0.05),与HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈负相关(P<0.05)。CD8+与FEV1呈负相关(P<0.05),与HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈正相关(P<0.05),但与咳嗽评分、咳痰评分、mMRC评分及CAT评分无直线相关关系(P>0.05),见表4。
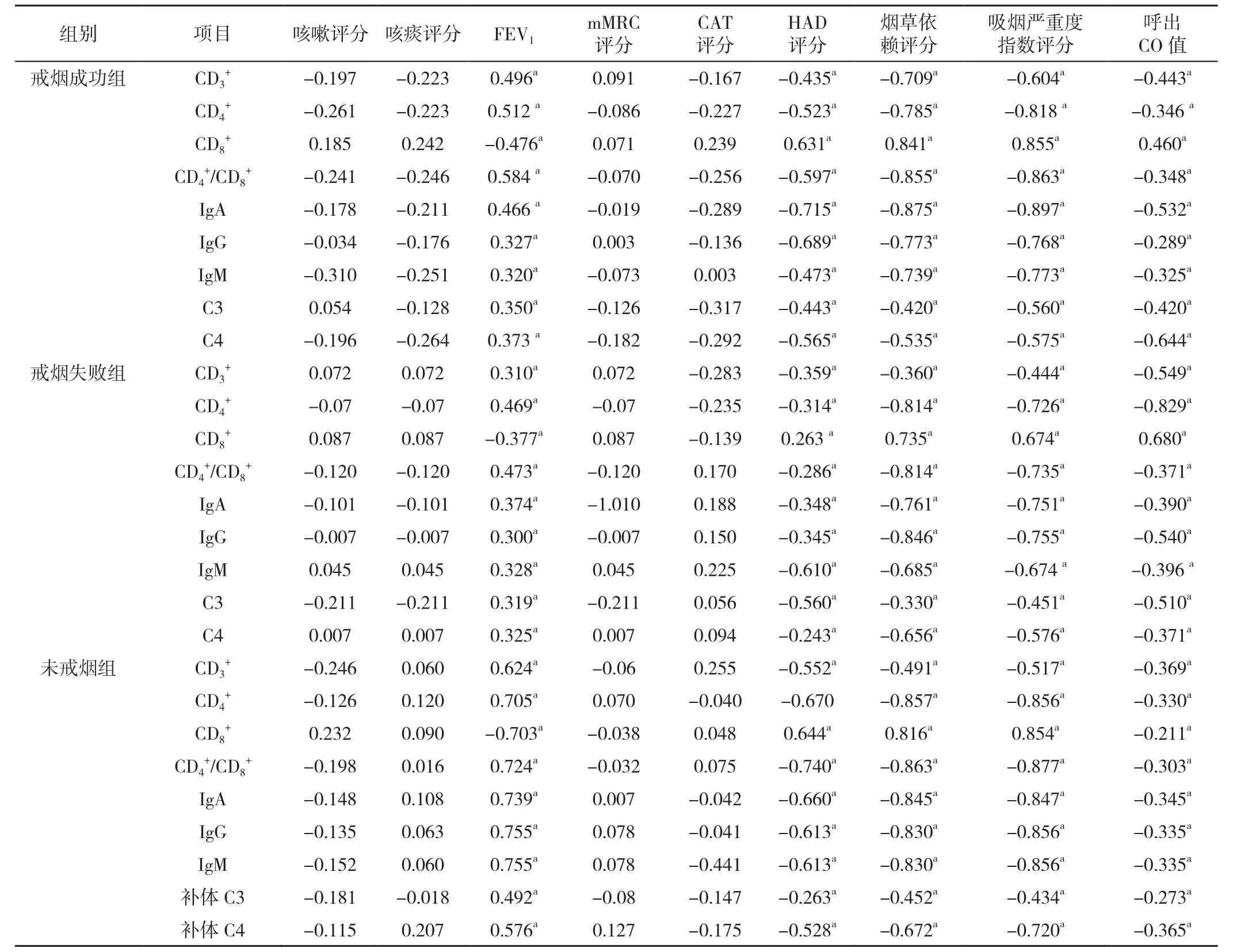
表4 三组患者随访开始时气道局部免疫功能指标与其余各指标相关性分析(r值)Table 4 Correlation analysis of airway local immune function indexes and other indexes at the beginning of follow-up of 3 groups of patients
2.5 3组患者随访结束时气道局部免疫功能与咳嗽评分、咳痰评分、肺功能检查、mMRC评分、CAT评分、HAD评分,烟草依赖评分、吸烟严重度指数评分及呼出CO值相关性分析 随访结束时,戒烟成功组和未戒烟组患者CD3+、CD4+、CD4+/CD8+、IgA、IgG、IgM、补体C3、补体C4与FEV1呈正相关(P<0.05),与咳嗽评分、咳痰评分、HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈负相关(P<0.05)。CD8+与FEV1呈负相关(P<0.05),与HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈正相关(P<0.05)。戒烟失败组随访结束时气道局部免疫各指标与咳嗽评分、咳痰评分、肺功能检查、mMRC分级、CAT评分、HAD评分,烟草依赖评分、吸烟严重度指数评分及呼出CO值无直线相关关系(P>0.05),见表5。
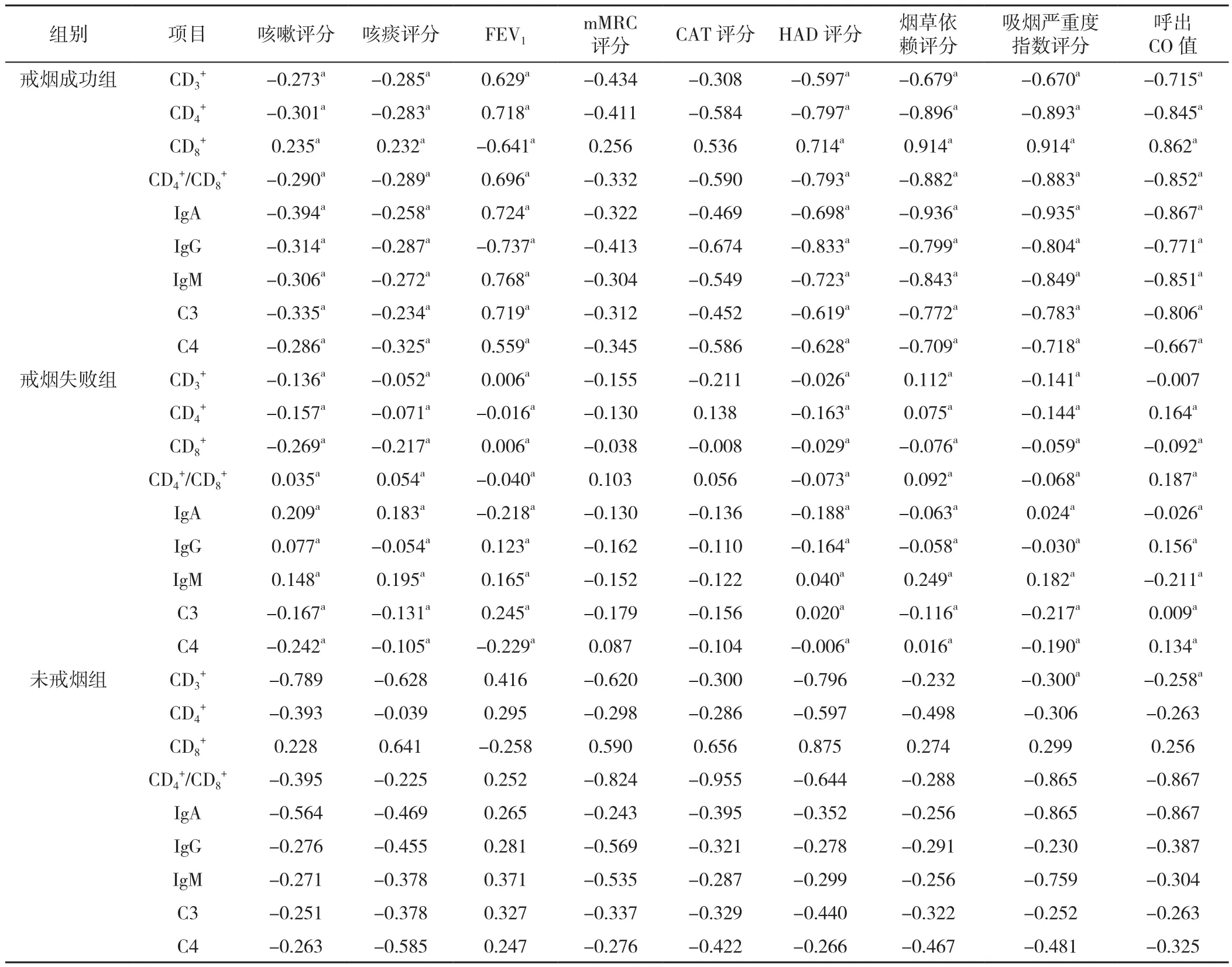
表5 三组患者随访结束时气道局部免疫功能指标与其余各指标相关性分析(r值)Table 5 Correlation analysis of airway local immune function indexes and other indexes at the end of follow-up of 3 groups of patients
3 讨论
烟草的危害是巨大的,烟草烟雾中有超过7 000种化合物,其中有69种为已知的致癌物[12]。吸烟与COPD关系密切,吸烟烟雾中的有害颗粒物所造成的气道慢性炎症在COPD中起着至关重要作用[13-14]。一般认为戒烟可在一定程度上减缓COPD的进展,但尚需更多的研究依据。本文前瞻性地研究了戒烟过程中患者的气道炎症、生活质量、症状和肺功能等变化,为戒烟减缓COPD进展提供了更直接的证据。本次研究发现,未戒烟组CD3+、CD4+、 CD4+/CD8+、IgA、IgG、IgM、补体C3、补体C4及FEV1随时间逐渐下降,CD8+、HAD评分、烟草依赖评分、吸烟严重度指数评分、呼出CO值、呼吸道感染情况及急性加重情况随时间逐渐上升,也说明了吸烟对COPD患者肺功能、局部气道免疫功能及生活质量均是有害的[15]。结果还发现,在随访0.5个月时戒烟组咳嗽较高、咳痰评分较低,随访6个月后未戒烟组咳嗽、咳痰评分较高,考虑吸烟患者长年吸烟后肺会产生大量黏液来自卫,在戒烟期间黏液会松解,从呼吸道排出,纤毛也开始重新运动,故戒烟的人有一段时间(数周)咳嗽、咳痰可能会严重。
尼古丁是使烟草具有成瘾性的罪魁祸首,大多数吸烟者对尼古丁产生依赖,烟草使用者很难凭自己的力量戒烟,每日吸烟者在无帮助的情况下戒烟,复吸率高达90%~95%[16]。1998年世界卫生组织将烟草依赖作为一种疾病列入《国际疾病分类(第10版)》,确认烟草是目前对人类健康的最大威胁,且吸烟危害具有明显滞后性。慢性呼吸道症状可以使其产生隐性忧郁,而烟草中的尼古丁等物质可以缓解这种症状,所以与健康者相比患者对烟草有更强的依赖性。本研究对所有入选者进行HAD筛查,发现32.6%入选者合并不同程度的抑郁/焦虑状态,且焦虑/抑郁贯穿于整个随访期间。本次研究发现3组HAD评分在随访0.5、1个月时均较高,且戒烟失败组在随访0.5个月明显高于其他两组,这可能与戒烟患者戒烟后体内尼古丁减少导致戒断综合征有关,此时患者常会表现抑郁/焦虑加重或烦躁不安等,部分患者需要重新复吸烟草后才能缓解,故此期焦虑和抑郁的加剧可能是戒烟失败的原因之一。本次研究也发现戒烟成功组与未戒烟组比较HAD评分相对较低,也可能是戒烟成功组能够成功戒烟的原因之一。戒烟失败组,HAD评分在各随访时间均高于戒烟成功组,在随访0.5、1、3个月时高于未戒烟组,这可能也与戒断综合征有关,此时期患者焦虑/抑郁加重,需要通过复吸才能缓解,也说明了戒烟如果单凭患者自己的意识去戒烟常会失败,而且在某种程度上对患者的身心不利,影响患者以后的戒烟信心。随着时间推移,戒烟成功组HAD评分逐渐下降,随访3个月后基本正常,未戒烟组HAD评分逐渐上升,说明戒烟成功后患者抑郁/焦虑情况会改善,这也说明了戒烟对患者生活质量有改善作用。
CO主要从呼吸道进入机体,经肺泡入血液循环,80%~90%的CO与血红蛋白相结合形成碳氧血红蛋白(COHb)分布于全身,使氧合血红蛋白的解离曲线左移,干扰血液的携氧功能,对人体是有危害的。吸烟为个人接受CO污染的主要途径,而且排泄也需要时间,有研究发现即使已戒烟COPD患者呼出气CO浓度高于健康不吸烟者,接近从不吸烟COPD患者水平[17]。本次研究发现,戒烟成功组在各随访时间呼出CO值低于其他两组,且随着时间推移,呼出CO值逐渐下降,说明戒烟有利呼出CO值下降;但在随访12个月时仍可检验出呼出CO值,可能与烟草危害具有延续性有关。戒烟失败组在随访1个月时和其余各随访时间比较,呼出CO值低,此后逐渐上升;未戒烟组,在各随访时间呼出CO值高于其他两组,且随着时间推移,其值逐渐上升,说明戒烟有利于体内CO值的减少。
多数研究表明COPD患者机体免疫功能下降,包括体液免疫和细胞免疫,故易发生呼吸道感染[18]。自1992年PIN等首次在哮喘气道炎症研究中运用诱导痰技术后,该技术因其有效、安全、无创、操作简单、重复性好等特点,受到国内外学者的重视[19-20],现有研究发现气道局部免疫情况与机体整体免疫情况一致,且与COPD患者的生活质量存在相关性[21]。大量研究已证实T淋巴细胞在 COPD 的发展过程中的重要作用[22-23],持续吸烟组患者支气管肺泡灌洗液(BALF) 中T 淋巴细胞功能明显降低[24]。本研究也采用诱导痰技术提取患者深部痰液,经过处理后提取痰上清液行T淋巴细胞亚群、免疫球蛋白及补体C3、C4检测,以观察气道局部免疫变化。本研究发现,未戒烟组在各时间点CD3+、CD4+、CD4+/CD8+、IgG、IgA、lgM、补体 C3、补体 C4水平逐渐下降,CD8+、呼吸道感染情况及急性加重情况逐渐上升;且在同一随访时间上其与戒烟组比较,CD3+、CD4+、CD4+/CD8+、IgG、IgA、lgM、补体 C3、补体C4水平较低,CD8+水平较高,说明未戒烟患者的气道免疫功能是下降的,戒烟后患者的免疫功能有所改善。戒烟成功组CD3+、CD4+、CD4+/CD8+,IgA,IgG及补体C3、补体C4水平随时间逐渐升高,CD8+水平逐渐下降,随访6个月时达到高峰;IgM水平随时间推移逐渐上升,且对方12个月时到高峰。说明戒烟后免疫指标恢复需要时间,T淋巴细胞亚群和IgA、IgG更能较早反映气道局部免疫变化[25]。同一随访时间点戒烟失败组与未戒烟组比较,CD3+、CD4+、CD4+/CD8+、IgG、IgA、lgM、补体C3、补体C4水平较低,CD8+水平较高;随访1个月时与其他随访时间点比较,CD3+、CD4+、CD4+/CD8+、IgG、IgA、lgM、补体C3、补体C4水平较高,CD8+水平较低,说明即使戒烟失败,短期戒烟也可以获益。且同一随访时间点3组之间比较,各免疫指标差异在随访0.5个月时有统计学意义,说明戒烟后患者局部气道免疫指标较早发生变化,进而更直接反映了气道免疫情况,也从侧面说明了戒烟的重要性。
本次研究对患者随访开始和结束时局部气道免疫功能和生活质量的相关性进行分析,发现随访开始时患者CD3+、CD4+、CD4+/CD8+、IgA、IgG、IgM、补体C3、补体C4与FEV1呈正相关,与HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈负相关。CD8+与FEV1呈负相关,与HAD评分、烟草依赖评分、吸烟严重度指数评分及呼出CO值呈正相关。说明免疫指标和生活质量具有相关性,也证明了免疫功能下降时患者容易发生呼吸道感染,导致疾病急性加重,频繁的发作会影响患者各种生活质量。但在随访开始时患者免疫指标和咳嗽咳痰情况、mMRC分级及CAT评分无直线相关关系,考虑入选患者为早期COPD,患者上述症状可能尚未明显,故相关性较差。随访结束时两者再次行相关性分析,发现戒烟成功组和未戒烟组患者免疫指标和生活质量指标均具有相关性,说明此时戒烟成功组免疫指标和生活质量均得到了改善,两者的相关性变的更佳,包括免疫指标和咳嗽咳痰情况、mMRC分级及CAT评分;而未戒烟组患者因烟草的危害肺功能指标进一步下降,导致患者mMRC分级及CAT评分进一步恶化,同时气道局部免疫功能进一步下降,为此两者的相关性也增加了。但是戒烟失败组两者却无相关性,考虑初期戒烟改变了疾病进展的自然规律,患者的气道局部免疫情况曾因“短期戒烟”而变的一度好转,但是在“复吸”及戒烟后“戒断综合征”等影响下患者生活质量各项指标均发生了变化,为此随访结束时戒烟失败组两者相关性下降。上述研究也说明,吸烟对患者局部气道免疫及生活质量均有不良的影响,而戒烟无论是否成功,对上述指标均是有益的,不过“复吸”及尼古丁的“戒断综合征”应该尽量避免。
综上所述,烟草对早期COPD患者局部气道免疫功能和生活质量均是有损害的,戒烟干预有利于气道免疫功能和生活质量的改善,戒烟成功者获益更大,同时研究还发现即使戒烟失败,短期戒烟也是可以获益的。但烟草对人体的危害存在延续性,戒烟至少6个月后各项指标才能明显改善。局部气道免疫功能和生活质量均有相关性,改善患者气道免疫功能可改善患者的生活质量,同时对局部免疫指标监测可以预测患者的预后,且气道局部免疫指标中T淋巴细胞亚群和IgA、IgG更能反映气道免疫情况。有研究发现即使已戒烟COPD患者呼出气CO浓度高于健康不吸烟者,接近从不吸烟COPD患者水平,也说明了戒烟的重要性,但目前CO系统在COPD中的作用机制尚不明了,其与气道炎症的关系还有待进一步研究。吸烟COPD患者常合并抑郁/焦虑情况,尼古丁的戒断综合征是导致焦虑/抑郁的原因之一,同时也是患者戒烟失败的重要原因,所以临床上提倡科学戒烟。
作者贡献:刘贤兵进行文章的构思与设计,研究的实施与可行性分析,进行统计学处理,进行论文的修订,负责文章的质量控制及审校,对文章整体负责,监督管理;刘贤兵、李芳、徐宁、祝利芬、郑晓燕进行数据收集;刘贤兵、李芳、徐宁进行数据整理;刘贤兵、李芳进行结果的分析与解释,撰写论文。
本文无利益冲突。

