干旱胁迫对荆芥生长发育的影响
张妙娟,吴琼,赵艳云
(1 山西运城农业职业技术学院,山西运城 044000;2 晋中学院,山西榆次 030600)
荆芥(Nepeta cataria)是唇形科(Labiatae)荆芥属(Nepeta)多年生植物。茎坚强,基部木质化;叶卵状至三角状心脏形,草质;聚伞花序呈二歧状分枝;坚果卵形,灰褐色,花期7-9 月,果期9-10 月[1]。《神农本草经》称之为假苏,后来又称其鼠蓂、鼠实、胡荆芥、新罗荆芥、石荆芥、稳齿菜等。现代中药称其为荆芥,同时还记载有“线芥”“四棱杆蒿”“香荆芥”“小茴香”等俗称[2]。多分布在黑龙江、辽宁、河北、河南、山西、陕西、甘肃、四川、贵州及云南等地[3]。
荆芥是一种常见的中药材,具有祛风止痒、宣散透疹、解表散风等功效,对其研究主要集中于抗炎、阵痛等药理机理方面,如荆芥内酯能明显抑制神经中枢系统,与戊巴比妥钠联合应用时能增强其解热作用;荆芥超微粉可明显抑制发热家兔体温升高;以荆芥等中药制成的复方喷雾剂,对甲、乙型流感病毒模型小鼠具有明显的发汗、解热作用等[4-10]。关于干旱胁迫也偶有报道,随着干旱胁迫时间的延长,荆芥叶的渗透调节作用受到影响[11],在重度干旱胁迫下,荆芥叶表皮的头状腺毛密度、气孔密度有所增加。随着胁迫时间延长,生物量和叶表面积逐渐增大,腺毛和气孔密度降低[12]。通过PEG 模拟干旱胁迫培养皿育种和盆栽2 种试验方法,研究干旱胁迫下荆芥种子萌发、幼苗形态、SOD、POD、MDA 等生理指标的变化波动情况,为园林育种栽培、植物资源开发利用提供理论依据。
1 荆芥种子、幼苗干旱胁迫试验
1.1 试验材料与试剂
1.1.1 试验材料。以一年生荆芥种子为试验材料,平均百粒重1g,黑褐色,原产于河南新乡市蔬菜种子服务中心。
1.1.2 主要试剂。PEG-6000,核黄素,氯化硝基四氮唑蓝(NBT),聚乙烯聚毗咯烷酮(PVP),0.6%的硫代巴比妥酸(TBA),甲硫氨酸,愈创木酚,10%的三氯乙酸(TCA)
1.1.3 主要器材。TGL-18M 台式高速冷冻离心机(上海卢湘仪),SPX-150BSH-Ⅱ恒温培养箱(上海新苗医疗器械制造有限公司),HH 恒温水浴锅(金坛市中大仪器厂),EU-2600R 紫外可见分光光度计(上海昂拉仪器有限公司)。
1.2 试验方法与测定
1.2.1 试验设计。选取约1000 粒颗粒饱满且大小相近的荆芥种子,用80℃的热水烫种2min,放入铺有双层滤纸的90mm 培养皿中。设置不同浓度PEG-6000 的干旱胁迫试验梯度,在预试验中浓度在0.3mol/L 溶液中时种子不能发芽,在15℃下发芽时间太长,在20℃下发育良好,故浓度梯度设计为0mol/L、0.05mol/L、0.1mol/L、0.2mol/L,重复3 次,每个培养皿放置50 粒种子,于20℃恒温培养箱中育种,定时加入10mL 各浓度PEG-6000 的溶液,记录每天荆芥种子发芽个数,将第1粒种子发芽的日期记为起始日,将各个处理下的种子发芽率不再明显变化的日期记为终止日。终止日后在各培养皿均随机选取5 株幼苗放置于A4 纸上,测量其胚根长、胚芽长、叶面积。
等培养皿中幼苗长至健壮时,从中选取5 株移栽至花盆,每个花盆中沙壤土质量均为100g,每天定时加入各个浓度的PEG-6000 溶液各20mL,分别在第0d、5d、10d、15d、20d 时在每盆中随机选取1 株对其生理指标进行测量。
1.2.2 SOD、POD 活性及MDA 含量的测定。检测荆芥幼苗叶片SOD、POD 活性及MDA 含量使用的方法依次为氮蓝四唑(NBT)光还原法[13]、愈创木酚还原法[14]、硫代巴比妥酸比色法[15]。
1.3 数据处理
将待测幼苗洗干净后平铺于A4 纸上,分别测量其胚根长、胚芽长、叶面积。计算公式如下[16]:

2 结果与分析
2.1 干旱胁迫对荆芥种子萌发的影响
用不同浓度PEG-6000 对种子进行干旱胁迫处理,结果荆芥种子的发芽率、发芽势、胚根长、胚芽长、叶面积均发生了变化。由表1 可知,荆芥种子在0.05mol/L、0.1mol/L、0.2mol/L 处理下,与对照组相比,发芽率在0.2mol/L 处理下有显著差异(P<0.05)。在0.05mol/L、0.1mol/L、0.2mol/L处理下发芽势分别为18.410.21、9.670.17、2.010.05,与对照相比,发芽势先迅速上升随后减缓。胚根长随着干旱胁迫程度的增加而增加;胚芽长随干旱胁迫程度的增加而呈现先增加后减少的趋势,在0.05mol/L 的浓度处理下,胚芽长显著大于其它处理(P<0.05);叶面积随PEG-6000 浓度的增加呈先增加后减少的趋势。
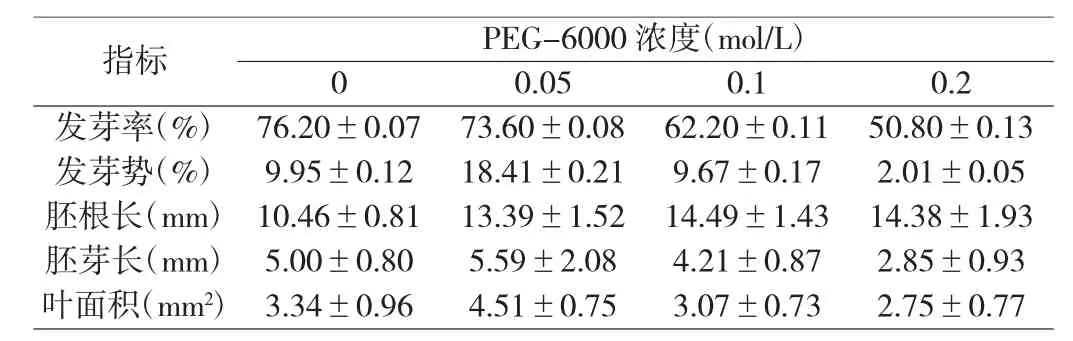
表1 不同浓度PEG-6000 处理对荆芥种子萌发及其形态指标的影响
2.2 干旱胁迫对荆芥幼苗SOD 活性的影响
由图1 可知:在各干旱胁迫处理下SOD 酶活性变化趋势有差异。除PEG-6000 浓度0.1mol/L 处理之外,其余浓度处理下荆芥叶片SOD 活性随着时间的延长而逐渐增加,且各胁迫时间与0d 有显著差异(P<0.05);在PEG-6000 浓度0.05mol/L 处理在20d 时SOD 活性达到最大;与对照组相比,5d 时,在0.05mol/L、0.1mol/L、0.2mol/L 处理下SOD 活性分别提高9U/g、-17U/g、8U/g;5~10d 内,在0.05mol/L、0.1mol/L、0.2mol/L处理下SOD活性分别提高2U/g、24U/g、14U/g;10~15d 内,在0.05mol/L、0.1mol/L、0.2mol/L 处理下SOD 活性分别提高46U/g、53U/g、43 U/g;15~20d 内,在0.05mol/L、0.1mol/L、0.2mol/L 处理下SOD 活性分别提高22U/g、-12U/g、-16 U/g。

图1 不同浓度PEG-6000 处理对荆芥叶片组织SOD 活性的影响
2.3 干旱胁迫对荆芥幼苗POD 活性的影响
由图2 可知:不同PEG-6000 浓度处理时,荆芥叶片POD 活性随着胁迫时间的延长迅速下降后上升,之后又下降,对照组POD 活性下降后趋于平稳;在PEG-6000 浓度0.2mol/L 处理20d 时达到最低值;与对照组相比,5d 时,在0.05mol/L、0.1mol/L、0.2mol/L 处理下POD 活性分别下降3454ΔOD/min·g、3327ΔOD/min·g、3314ΔOD/min·g;5~10d 内。在0.05mol/L、0.1mol/L、0.2mol/L 处理下POD 活性分别提高883ΔOD/min·g、1054ΔOD/ min·g、424ΔOD/ min·g ;10~15d 内,在0.05mol/L、0.1mol/L、0.2mol/L 处理下POD 活性分别下降776ΔOD/min·g、494ΔOD/min·g、578ΔOD/min·g;15~20d 内,在0.05mol/L、0.1mol/L、0.2mol/L 处理下POD活性分别下降1761ΔOD/min·g、1661ΔOD/min·g、1166ΔOD/min·g,且在各个浓度干旱胁迫下第5d、10d、15d、20d 的POD 活性与第0d 相比存在显著差异(P<0.05);在第15、20d 时浓度为0.2mol/L 的干旱胁迫处理与其它各胁迫下的POD 活性均存在显著差异(P<0.05)。

图2 不同浓度PEG-6000 处理对荆芥叶片组织POD 活性的影响
2.4 干旱胁迫对荆芥幼苗MDA 活性的影响
由图3 可知:随着胁迫时间延长,不同浓度PEG-6000 处理下的荆芥叶片中MDA 含量变化趋势各有不同,整体上表现为先下降后上升。与对照组相比,5d 时,在0.05mol/L、0.1mol/L、0.2mol/L 处理下MDA 含量分别减少0.01umol/g、0.013umol/g、0.017umol/g,胁迫强度越强,下降幅度越大,各处理在胁迫5d 时MDA 积累量达到最低。与第5d 相比,在第10d 时,在0.05mol/L、0.1mol/L、0.2mol/L 处理下MDA 含量分别增加0.023umol/g、0.018umol/g、0.013umol/g,荆芥叶片的MDA 含量随着PEG-6000 浓度的增加而逐渐上升,且各浓度下MDA 含量与对照组之间差异显著(P<0.05)。在浓度为0.1mol/L 和0.2mol/L 的干旱胁迫下,MDA 积累量在第20d 均为最大,分别为0.048umol/g 和0.054 umol/g;其中以0.2mol/L 干旱胁迫20dMDA 积累量达到峰值。以上数据说明,荆芥幼苗在0.2mol/L 的干旱胁迫下受到的伤害最大。
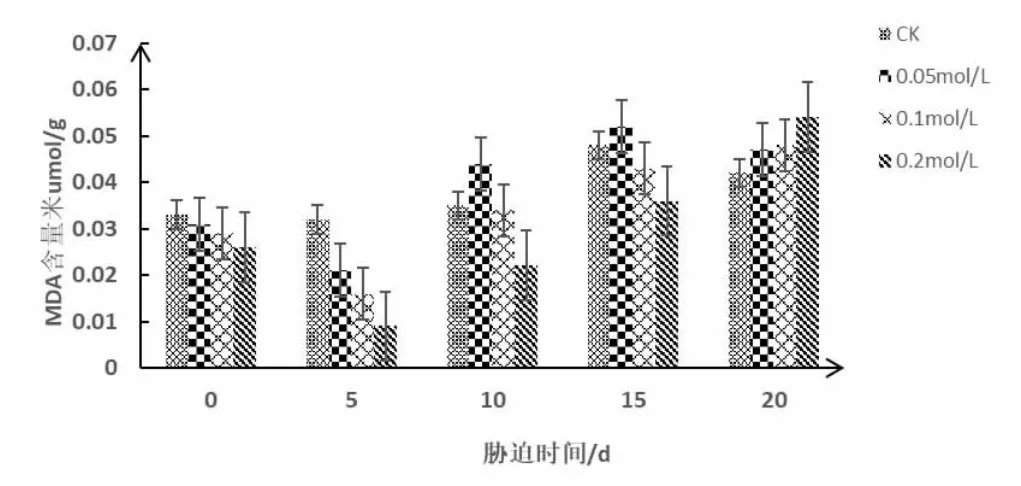
图3 不同浓度PEG-6000 处理对荆芥叶片组织MDA 含量的影响
3 讨论与结论
植物的种类不同抗逆性则不同,在植物不同的生长阶段,其抗逆性也存在很大差异。植物在种子萌发期与幼苗形成期对逆境反应较敏感,成株时抗性普遍升高,因此,种子萌发和幼苗形成期是研究植物抗逆性的最佳时期。植物形态、生理特征可直观反映植物的抗旱能力。本试验通过PEG 模拟干旱胁迫培养皿育种和盆栽两种试验方法,研究干旱胁迫对荆芥种子萌发和幼苗生长的影响。结果表明,荆芥种子的发芽势、发芽率在浓度0.05mol/L 的PEG-6000 处理下达到最高,随着PEG-6000 浓度升高,各项指标逐渐下降,且对照组的生长指标明显高于干旱组,该结论与孙天晓等[17]研究的种子的发芽率、发芽势随着PEG-6000 浓度的增加而明显呈降低趋势的研究结果一致。荆芥种子的胚根长在浓度为0.1mol/L 的PEG-6000 处理下最长,荆芥种子的叶面积、胚芽长在PEG-6000 浓度为0.05mol/L 时最大,且随着PEG-6000 浓度的增加,胚根长、胚芽长、叶面积逐渐降低,该结果与谭彦等[18]研究的5 种园林植物的抗旱性试验中结论一致。本试验的试验方法与前人不同,刘凯月等[19]采用田间人工控水方法,研究了荆芥的株高、冠幅、叶面积等形态及电导率、脯氨酸等生理指标,最终结果表明,荆芥的耐旱能力较强,可忍耐60d以上的自然干旱。李柯、周庄煜等[11]直接采用盆栽控水的方法,研究荆芥的生长、渗透调节和抗氧化能力对干旱的响应。本试验首先采用培养箱育种,避免了田间天然条件的干扰,接着移栽到沙壤土中,做到很好衔接。
SOD、POD 活性高低是研究植物抗旱性的重要指标,SOD 和POD 相互协调作用,既减少氧自由基对细胞膜造成的伤害,又减轻逆境中植物的损伤程度。本试验结果表明,经过20d 干旱胁迫后荆芥叶组织中SOD 活性越来越大,说明在干旱胁迫下SOD 清除氧自由基的活性增强;荆芥叶组织中POD 活性随胁迫时间的延长呈先降后升的趋势,且干旱胁迫的不同时期各浓度干旱处理与对照组相比均存在显著差异(P<0.05)。在本试验中,SOD 除0.1mol/L 处理外,其余浓度处理下荆芥叶片SOD 活性随着时间的延长而逐渐增加,POD 则随胁迫时间延长呈现迅速下降后上升又下降,这与武曦[20]的研究结果不同,SOD 在中度干旱处理下随胁迫时间延长先下降后上升,而POD 活性则随胁迫时间延长总体呈下降趋势。MDA 是植物在遭受逆境情况下,膜脂过氧化反应的最终分解产物。MDA 浓度的高低代表细胞膜系统受到伤害的程度。随胁迫浓度的加大和胁迫时间的延长荆芥叶组织中MAD 的积累量呈先降后升的趋势,这个结果与武曦[20]的研究相同,而MAD 浓度高低表明了荆芥抗旱能力的强弱,其浓度越高则细胞膜脂过氧化程度高。由此可见,荆芥有一定的抗旱能力。
综上所述,荆芥种子在0.05~0.2mol/L 浓度PEG-6000 干旱胁迫下具有较良好的萌发能力,荆芥幼苗可通过提高体内SOD 活性、POD 活性,抵御一定程度干旱胁迫带来的影响。所以,荆芥能对干旱胁迫做出适应性的应答,对缺水环境具有一定的耐受性。本研究为荆芥在山西省内推广种植、规范栽培及用水管理提供一定的参考。

