一株贝莱斯芽孢杆菌的分离与鉴定
缪伏荣,陈鑫珠,邱华玲,刘 景
(福建省农业科学院畜牧兽医研究所,福州350013)
0 引言
茶渣是茶饮料、速溶茶和茶单宁产业等加工茶叶后产生的残渣,据统计,仅茶饮料和速溶茶公司每年产生的茶渣超10万t。研究报道,干基的茶渣粗蛋白质含量为17%~25%,是一种良好的蛋白质饲料资源[1-3]。日本研究者[4]、高风仙[5]和陈晓虹[6]以茶渣为添加剂喂养禽畜不仅可以降低成本,还可以一定程度上改善畜牧产品的质量,提高经济效益。但马帮军[7]研究表明,猪日粮中添加茶粉1%~3%会降低猪的平均日增重;舒庆龄[8]的实验结果表明,在肉鸡饲料中添加茶渣3%~5%,喂养60天,肉鸡增重明显低于对照组。这主要原因是茶渣粗纤维含量高,畜禽纤维素酶活力低,不利于吸收利用;其次刚出产的茶渣水分达到80%不易储藏和运输,因此仅有小部分的茶渣作为饲料源利用,大部分茶渣被丢弃或掩埋;这不仅造成资源浪费,而且造成生态环境污染[9-10]。为了更好利用茶渣资源,刘姝等[11]利用木霉等组合微生物发酵茶渣,30℃,经4~8天发酵后测定饲料中粗蛋白含量达到25%以上,比对照组提高了20%,其营养价值达到了仔猪配合饲料中粗蛋白的含量。胡桂萍等[12]以提取茶多酚后的茶渣为发酵原料,利用乳杆菌、枯草芽孢杆菌、酵母菌和米曲霉菌进行常温(25~35℃)的厌氧固态发酵5~7天,发酵产品中粗蛋白含量达29.49%。倪星虹[13]以混合菌种温度28℃、发酵7天,茶渣发酵产物中蛋白质含量提高了60.78%。朱飞等[14]利用黑曲霉在添加5%玉米粉的茶渣中进行固态发酵,自然pH、37℃、8天发酵后显著提高茶渣的营养价值,茶渣经发酵后虽然能在一定程度上提高茶渣的营养价值。但发酵温度均不超过37℃,发酵效率低,时间长,易被杂菌污染。因此有必要筛选能高效分解茶渣的高温菌株。贝莱斯芽抱杆菌(Bacillusvelezensis)是2005年由Ruiz-Garcia等[15]新命名的一种生防菌,是芽孢杆菌属的一个新种[16-19]。国内外己有学者研究表明Bacillusvelezensis能产生具有广谱抗菌活性的次生代谢产物,包括纤维素酶、蛋白酶以及多种抗菌的活性物质,是用来增加作物产量、维护生态环境和农业生态系统的首选生物药剂[20-28]。贝莱斯芽孢杆也作为水产养殖的益生菌[29]。Liu等[30]对从海洋微生物中筛选到菌株BacillusvelezensisH3的发酵培养基和拮抗物质进行研究,发现该菌株的活性物质是一种替代性的表面活性素,有较高的研究价值。但鲜见贝莱斯芽抱杆菌(Bacillusvelezensis)分离茶渣的研究报道。
本研究从堆积废弃茶渣中分离到即耐高温又能产生较高酶活力的贝莱斯芽孢杆菌,对该菌进行形态学、生理生化以及分子生物学鉴定,同时研究其最适的生长条件,为后续的茶渣开发研究奠定理论的基础。
1 材料与方法
1.1 材料
LB培养液(L):酵母粉10 g,蛋白胨10 g,牛肉浸膏5 g,NaCl 10 g,pH 5.5~6.0。
纯化固体培养基:LB培养液中时加入20 g琼脂粉。
分离固体培养基:取新鲜茶渣50 g加蒸馏水500 mL蒸煮30 min,过滤后的茶渣液定容到200 mL,加入4 g琼脂粉。
液体发酵培养基:同LB培养液。
主要仪器:LRH-250A生化培养箱、SW-CJ-1FD单人超净工作台、LDZS-30KBS立式高压灭菌器、CRY-200恒温摇床、Multiskan MK3酶标仪等。
试剂:酵母粉、蛋白胨、NaCl、硫酸、硼酸、硫酸铜、硫酸钾、氢氧化钠、辛醇、盐酸等均为AR级。
1.2 方法
1.2.1 菌株的培养与分离
(1)富集培养:从某地堆积多年的茶渣处取样品10 g,加入盛有30 mL LB培养液的250 mL锥形瓶中,在42℃、120 r/min条件下富集培养24 h,取2 mL培养物接种到新鲜的LB培养液,以相同的条件进行培养。如此重复3次。
(2)初筛:富集培养物在分离固体培养基上划线培养,42℃培养24 h。挑取生长明显的菌落进行复筛。
(3)复筛:将初筛菌落在纯化固体培养基上划线分离3次,以获得纯培养物,并依据菌种在分离固体培养基的生长情况,挑取有不同形态特征的单菌落,于42℃ LB培养基上分别扩繁后加20%甘油混匀,于-80℃条件下保存。
1.2.2 菌株产酶能力测定 选取生长较好的菌株进行试验。将菌株活化24 h后挑取1环至用液体发酵培养液中,42℃、120 r/min条件下培养48 h后,测定发酵液的蛋白酶、纤维素酶的活力。
采用蒽酮比色法测定纤维素酶(CL)催化羧甲基纤维素钠降解产生的还原糖的含量[31]。每mL样本每分钟催化产生1 μg葡萄糖定义为一个酶活力单位(U)。
酸性蛋白酶(ACP)、中性蛋白酶(NP)和碱性蛋白酶(AKP)的测定按照国标GB/T23527-2009和相关文献[32-33]执行。
1.2.3 菌株形态学观察 筛选获得的菌株,平板划线42℃分别培养16 h和25 h,在自然光下观察菌落形态;革兰氏染色后,观察菌株形态[34-35]。
1.2.4 菌株生理生化特性 糖发酵试验、吲哚试验、淀粉水解试验、油脂试验等实验参考参照文献[36-37]进行。
1.2.5 分子鉴定 菌株的分子鉴定用16S rDNA和gyrB基因进行[38]。以下细菌扩增引物均由生工生物工程(上海)股份有限公司合成。利用NCBI网站的BLAST功能对所测的16S rDNA和gyrA序列进行同源性分析,确定亲缘关系,使用MEGA 5.0软件Neighbor-Joining[39-41]构建系统发育树,进行1 000次的相似度重复计算。
1.2.6 菌株生长特性 首先测量菌株的生长曲线,判断最适生长温度以及生长代时[42]。其次对其他生长条件进行单因素试验按表1中的设计方案,分析不同因素对菌株生长的影响,其他培养条件和培养基相同,间隔2 h取样用酶标仪在波长630 nm处测吸光度。每组设置3个重复。
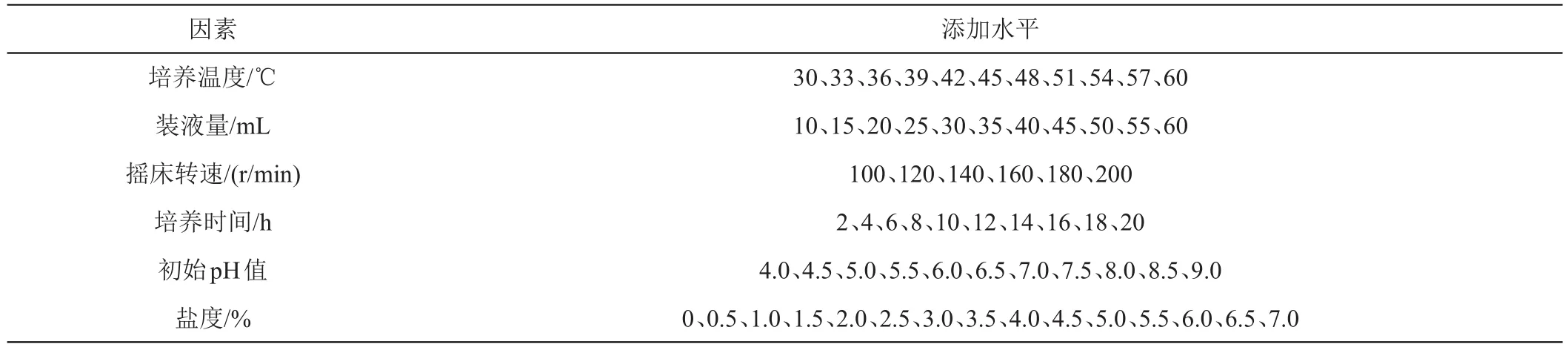
表1 菌株生长条件单因素试验
1.2.7 数据分析 所得数据用SPSS 16.0生统软件进行分析,f检验分析实验数据。
2 结果与分析
2.1 菌株产酶能力比较
对5株菌的发酵液进行分析,产纤维素酶(CL)活力由高到低分别是DJ、8106、Fb、8116、HLH;酸性蛋白酶(ACP)活力由高到低分别是8106、8116、DJ、HLH、Fb;中性蛋白酶(NP)活力由高到低分别是8106、HLH、8116、DJ、Fb;碱性蛋白酶(AKP)活力由高到低分别是Fb、8116、8106、DJ、HLH(表2)。可见Fb株菌产4种酶的活力均较强。
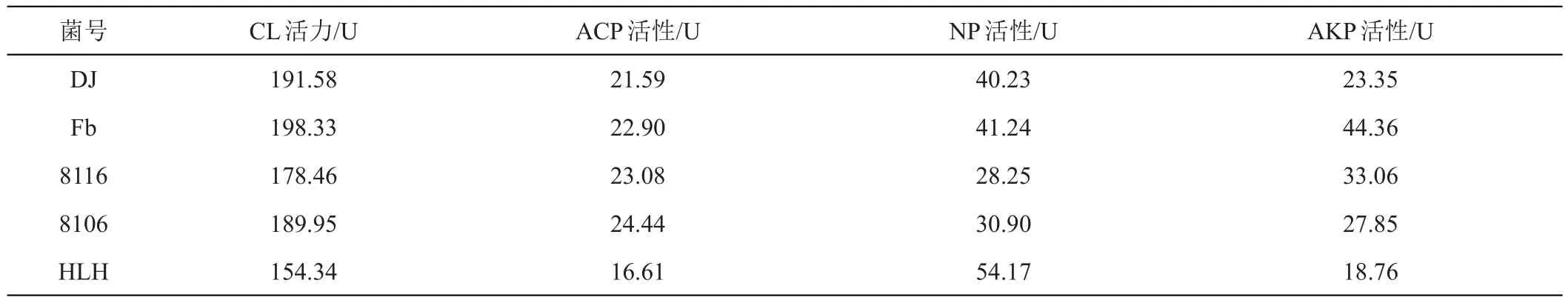
表2 菌株酶活力比较
2.2 菌落形态和菌株形态
Fb菌株在自然光下,LB培养基,42℃培养16 h,其菌落浅黄色,圆形,表面干燥,不透明,边缘不整齐,如图1。菌体呈杆状,0.4~0.6 μm×0.9~4.0 μm,单个或成对排列,见图2。
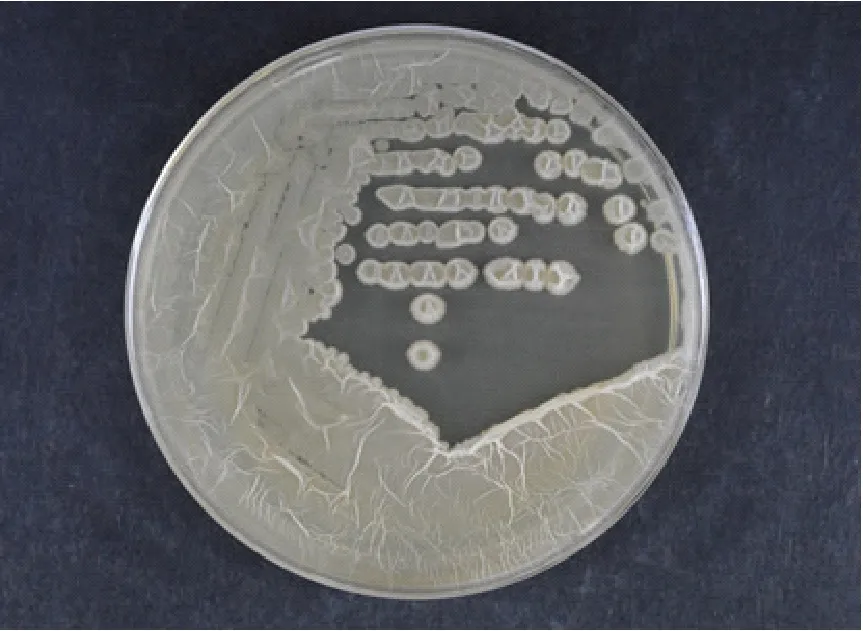
图1 菌落形态
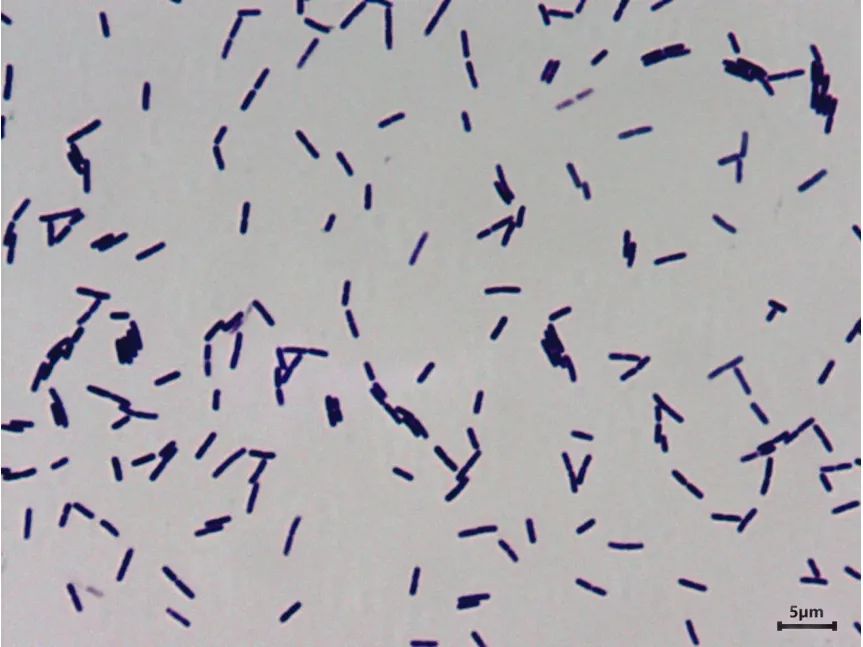
图2 菌株形态
2.3 菌株生理生化特性
由表3可知,Fb菌株能水解七叶苷;吲哚试验阳性;可在β-木糖苷酶、苯丙氨酸芳胺酶、α-半乳糖苷酶、丙氨酸-苯丙氨酸-脯氨酸芳胺酶、L-吡咯烷酮芳胺酶等酶中生长;能利用D-甘露醇、D-甘露糖、古老糖、D-海藻糖、D-葡萄糖、D-核糖等多种糖作为碳源生长;但不能利用肌醇、L-鼠李糖、菊粉、环糊精、N-乙酰-D-氨基葡萄糖、D-塔格糖、糖原、麦芽三糖、D-松三糖等。Fb菌株能在低剂量的抗菌素中生长,其卡那霉素、竹桃霉素和多粘菌素B耐药剂量分别是0.2 g/L、0.1 g/L和0.031 g/L。
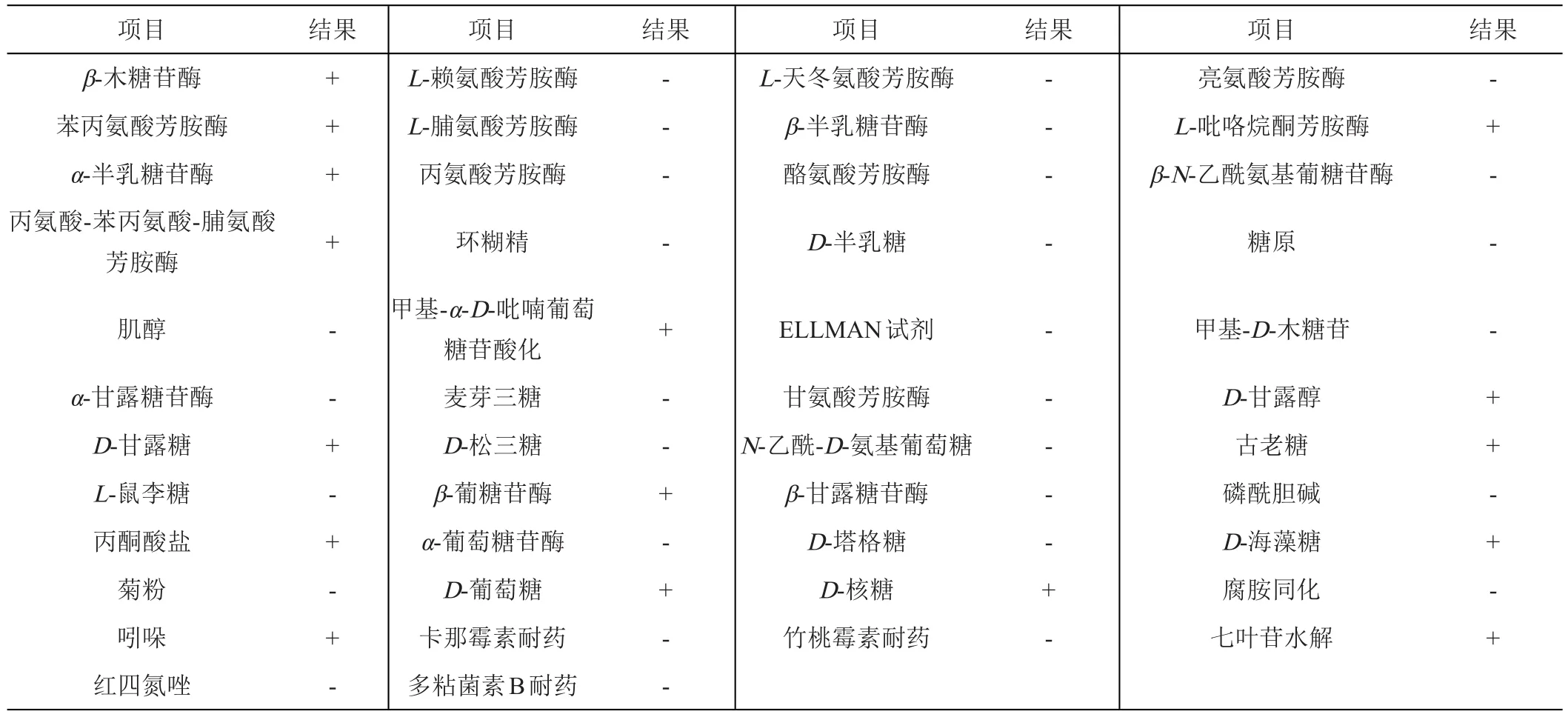
表3 Fb菌株生理生化特性
2.4 菌株的分子鉴定
利用NCBI数据库中的Blast程序分析结果表明,Fb菌株与BacillussiamensisKCTC13613(AJVF01000043)和BacillusamyloliquefaciensDSM 7T(FN597644)菌株的同源性最高,相似性达到99.93%。采用MEGA 5.0软件,邻位链接法显示Fb菌株与相关种的16S rDNA序列系统发育树(图3)。菌株gyrB测序分析表明,序列长1176 bp。MEGA5.0软件分析结果表明,其与BacillusvelezensisBCRC 17467T(DQ903176)的同源性较高,相似性达到100%。同理将该菌株与其他种属明确的10株菌的gyrB基因构建系统发育树(图4)。

图3 基于16S rDNA的相似菌株系统发育树

图4 基于gyrB的相似菌株系统发育树
结合菌株形态学、生理生化特性以及16S rDNA和gyrB的序列比较分析,将Fb菌株鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis)。
2.5 菌株生长特征
2.5.1 Fb菌株的生长曲线 从图5可以看出,Fb菌株可在30~60℃下生长,在30~39℃培养时随着培养温度的提高菌株的细胞分裂加快,即吸光值增加;在39~54℃培养时其吸光值(0.89~0.93)最高,组间差异不显著;54~60℃随着培养温度的提高吸光值下降;因此Fb菌株最适的生长温度为39~54℃。
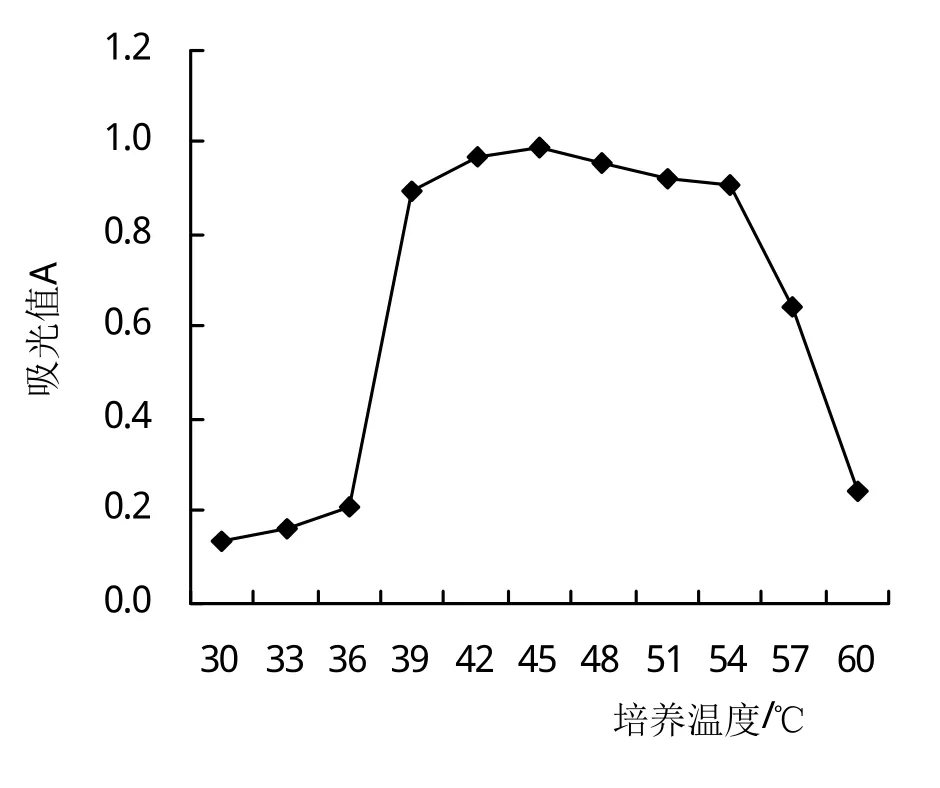
图5 培养温度对菌株生长的影响
2.5.2 装液量和摇床转速对菌株生长的影响 摇床转速120 r/min,随着装液量的增加,菌液的吸光值升高,至装液量30 mL时,Fb菌株的吸光值达最高0.97;再提高装液量,吸光值逐渐降低(图6)。从图7可知,装液量30 mL时,随着摇床转速的提高,吸光值升高,当摇床转速为120 r/min时,Fb菌株的吸光值达到最高0.98;再提高摇床转速,吸光值逐渐降低。表明Fb菌株最佳装液量和摇床转速分别为30 mL和120 r/min。

图6 装液量对菌株生长的影响

图7 摇床转速对菌株生长的影响
2.5.3 培养时间对Fb菌生长的影响 图8为Fb菌株在培养温度42℃下的生长曲线。0~6 h是菌体适应新环境的迟缓期,细胞分裂增殖缓慢;6~16 h为生长繁殖迅速的对数生长期;16 h的菌体吸光值最高0.974;16~18 h为稳定生长期;18 h后由于自溶酶作用或有毒代谢产物积累,细胞裂解菌体吸光值随之下降。表明Fb菌的最适培养时间为16 h。
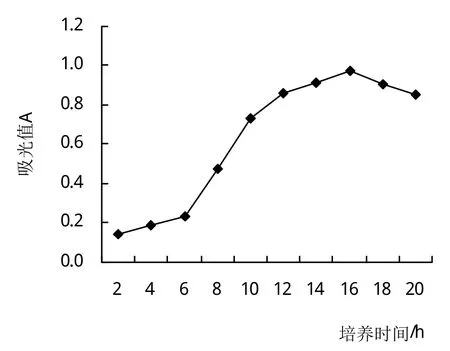
图8 培养时间对Fb菌生长的影响
2.5.4 初始pH对Fb菌生长的影响 从图9可以看出,培养基初始pH 4.0~5.0时,菌体吸光值随pH的提高而提高;培养基初始pH 5.0~7.0范围内,Fb菌生物量较高且各组间差异不显著,吸光值均高0.93;再逐渐提高培养基的初始pH培养时,菌体吸光值随之下降;表明Fb菌株的培养基最适初始pH 5.0~7.0。
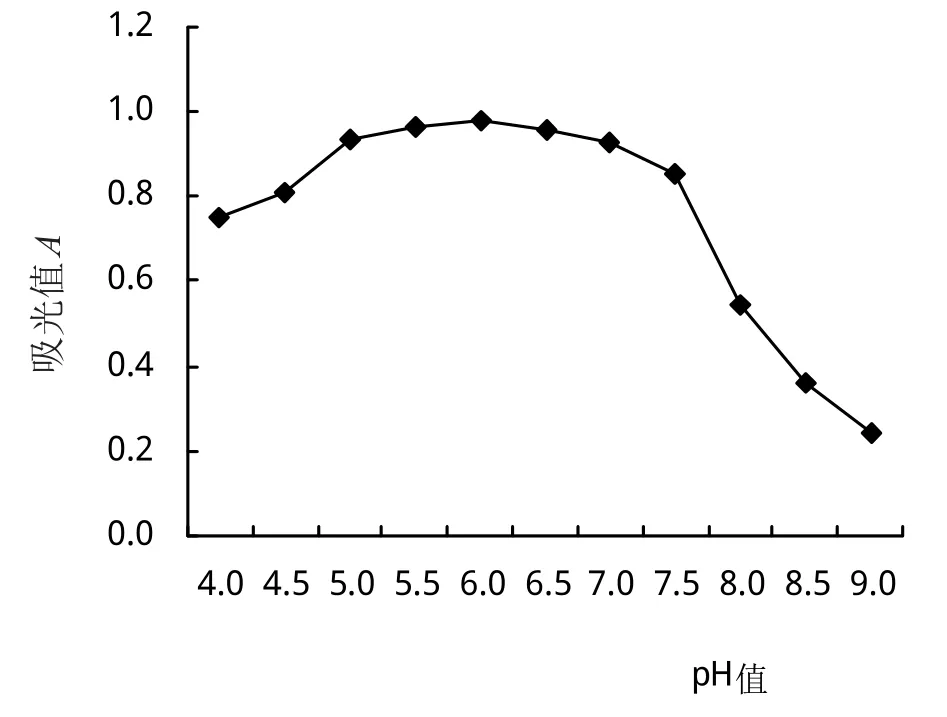
图9 初始pH对Fb菌生长的影响
2.5.5 盐度对菌株生长的影响 实验中改变培养基的盐度,来研究Fb菌株生长最适的盐度。从图10可以看出,培养液的盐度从0.0增加到1.0%菌株的吸光值也从0.46增加到0.92;培养液的盐度1.0%~6.0%菌株的吸光值均大于0.92,无显著差异;6.0%~7.0%菌株的吸光值下降至0.81。

图10 盐度对菌株生长的影响
3 讨论与结论
研究表明,在固态发酵中,适宜的水分和原料粒度能够保证发酵基质深层微生物对氧气的需求,疏松多孔的基质状态还能使得微生物的代谢废物及时排出,基质内部的养分也可随着自由水通过原料间隙扩散到基质表面,满足基质表面微生物对营养的需求,有利于微生物正常繁殖并保持高产酶活性状态[43-44]。对于含水率高的物料一般选择吸水性强的铺料如麦麸等来降低物料的含水率;或选择中高温菌发酵利于物料中水分蒸发。本研究获得贝莱斯芽孢杆菌Fb属高温菌,茶渣经7天发酵后水分下降了42.06%(P<0.05),可有效解决新鲜茶渣水分过高的问题。此外Fb菌株的生长温度均高于刘姝等[11]、胡桂萍等[12]、倪星虹[13]和朱飞等[14]的发酵菌株,这不仅可减少其他杂菌生长,而且可提高发酵效率。
本研究从堆积多年的茶渣中分离筛选到5株茶渣降解菌,其中一株Fb菌株经菌落形态、菌株形态、生理生化特性的研究,及分子鉴定为贝莱斯芽孢杆菌(Bacillusvelezensis)。该菌最适生长条件为:装液量30 mL、摇床转速120 r/min、培养温度39~54℃、培养时间为16 h、初始pH5.0~7.5、盐度为1.0%~6.0%。同时,Fb菌株产生具有较强酶活力的纤维素酶、酸性蛋白酶、中性蛋白酶和碱性蛋白酶。与胡宝东等[45]从酱香型大曲中分离获得的甲基营养型芽胞杆菌(即贝莱斯芽胞杆菌)FBKL 1.0190相似。Fb菌株是否在发酵过程中还会产生一些抗菌的活性物质[20-28]和表面活性素[30],这有待下一步的研究。本研究在茶渣中分离筛选出贝莱斯芽抱杆菌鲜见报道。

