RhoA激酶的硫巯基化修饰在硫化氢抗大鼠神经细胞缺氧性损伤中的作用
谢伟明,陈志武,郭 岩
(安徽医科大学药理学教研室,安徽 合肥 230032)
硫巯基化(S-sulfhydration)是继乙酰化(acetylation)和磷酸化(phosphorylation)等之后发现的一种新的蛋白质翻译后修饰方式[1],硫巯基化修饰可以被二硫苏糖醇(dithiothreitol,DTT)等还原剂抑制[2]。
硫化氢(hydrogen sulfide,H2S)是机体内一种重要的气体信号分子[3],与多种生理及病理过程有关。H2S具有抗神经细胞凋亡、抗炎症反应、保护血脑屏障等效应[4]。有研究表明,H2S可通过硫巯基化修饰靶蛋白的半胱氨酸残基,使半胱氨酸的-SH基团转化为-SSH或过硫酸盐基团,改变靶蛋白的生物学功能,如H2S硫巯基化修饰ATP敏感性钾离子(KATP)通道蛋白的半胱氨酸残基,进而影响该通道开放[5]。
RhoA-Rho激酶(Rho-associated coiled-coil forming protein kinase,ROCK)信号转导通路是机体内一种与细胞的生长、增殖和分化等功能有关的信号通路,与高血压和缺血性脑损伤等血管性疾病密切相关。ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员,有ROCK1和ROCK2两种亚型,ROCK2主要表达在大脑、心脏和肌肉中[6]。有研究表明ROCK2激活促进缺血性神经元损伤,而抑制ROCK2活性或者降低ROCK2蛋白表达,可减轻神经元损伤[7]。我们前期研究发现H2S对小鼠脑缺血损伤具有明显保护作用,并可抑制小鼠脑血管平滑肌细胞中ROCK2活性[8]。但是,H2S抑制ROCK2活性的机制至今未见明确报道。鉴于ROCK2分子结构中的半胱氨酸富集的锌指样结构域(cysteine-rich zine finger-like motifdomain,CRD)中富含半胱氨酸残基[9],H2S是否通过硫巯基化修饰来抑制神经细胞中ROCK2活性抗神经细胞H/R损伤?因此,本研究拟探讨H2S是否可通过抑制ROCK2对大鼠神经细胞H/R损伤产生保护作用及其ROCK2抑制作用的硫巯基化修饰机制。
1 材料与方法
1.1 药品与试剂ROCK2抗体,购自Abcam公司,批号:125025;NaHS,购自Sigma公司,批号:#SHBF1746V;链霉亲和素琼脂糖珠,购自北京博尔西科技有限公司,批号:B190319;ROCK2活性试剂盒,购自江苏酶免实业有限公司,批号:0069R1;Biotin-HPDP,购自APExBIO公司,批号:A800831337769;细胞凋亡试剂盒,购自北京四正柏生物有限公司,批号:20200820;二硫苏糖醇(DTT),购自阿拉丁试剂有限公司,批号:D8220。
1.2 仪器流式细胞仪(美国BD公司);凝胶电泳仪和电泳槽(美国BIO-RAD公司);TGL-16H超速冷冻离心机(珠海黑马仪器有限公司);细胞培养箱(美国Thermo公司)
1.3 动物SPF级SD大鼠新生鼠,购自安徽医科大学实验动物中心,实验动物合格证号:SCXK(皖)2017-001。
1.4 方法
1.4.1原代培养大鼠海马神经细胞[10]取新生24 h内的SD大鼠,在麻醉状态下断头取脑并剥离海马组织,0.125%胰酶液消化20 min,加入10% FBS的DMEM/F12完全培养基,巴氏吸管将组织吹散,70 μm细胞过滤器过滤,1 000 r·min-1常温离心5 min并留沉淀。加入完全培养基重悬细胞,调整细胞数目为1×107个·L-1,接种于预先用多聚赖氨酸包被好的6孔板中,24 h后用专用培养基(Neurobasal+2% B27+0.5 mmol·L-1L-glutamine+1%青霉素-链霉素溶液)半量换液,每隔3 d全量换液。
取培养8 d的海马神经元细胞,用4%的多聚甲醛室温固定10 min,PBS溶液清洗后,加0.3% Tritonx-100放置30 min。弃掉Tritonx-100,清洗3遍,滴加10%山羊血清工作液封闭30 min。加1 ∶100稀释的一抗MAP2,4 ℃放置过夜,次日清洗后滴加同样稀释倍数的FITC标记山羊抗兔IgG(H+L)荧光二抗,室温避光放置1 h,于激光共聚焦显微镜下观察拍照,进行海马神经元细胞的鉴定。
1.4.2硫巯基化蛋白的分离纯化 采用改良生物素转换法[1]分离纯化硫巯基化蛋白。在培养8 d的海马神经元细胞中分别加入50、100、200 μmol·L-1NaHS或等体积的生理盐水(NS)培养24 h后,调节细胞悬液为每mL含有1×105个神经元,取500 μL细胞悬液置于6孔培养板中,加入100 μL的蛋白裂解液,置冰盒上裂解30 min,离心取上清并进行蛋白定量。将200 μL上清液加入2 mL离心管中,再加入800 μL甲基硫代磺酸甲酯(Methyl methanethiosulfonate,MMTS)和HENS缓冲液配制的终止缓冲液,50 ℃恒温水浴30 min,封闭剩余的游离巯基。加入1 mL-20 ℃预冷的丙酮静置30 min后15 000 r·min-14 ℃离心20 min。加入1 mL HENS缓冲液将留下的沉淀吹打溶解。再加入250 μL Biotin-HPDP工作液混匀,室温避光放置过夜。次日再加满-20 ℃预冷的丙酮,-20 ℃冰箱中静置30 min,立即12 000 r·min-14 ℃离心20 min,弃上清。加入1 mL HENS缓冲液吹打溶解,加入50 μL链霉亲和素琼脂糖珠,室温避光放置24 h。再12 000 r·min-1离心2 min后弃上清,用HENS缓冲液重悬琼脂糖珠并反复离心洗涤3次,用洗脱缓冲液洗脱琼脂糖珠后得到纯化的硫巯基化蛋白。
1.4.3ROCK2或硫巯基化ROCK2(SSH-ROCK2)的蛋白含量检测 神经元总蛋白或硫巯基化蛋白中的ROCK2含量分别用Western blot法测定。将100 μg的总蛋白或硫巯基化蛋白置100 ℃变性后,在12% SDS聚丙稀酰胺凝胶中电泳后将蛋白转膜至PVDF膜。5%脱脂牛奶中封闭1.5 h,ROCK2一抗孵育过夜。次日加入HRP标记的二抗孵育1 h。TBST洗膜后用ECL化学发光显色液显影并拍照以兔抗β-actin多克隆抗体为内参照,Image J进行灰度值分析。
1.4.4ROCK2活性检测 将培养8 d的海马神经元细胞随机分为NS对照组和NaHS(200 μmol·L-1)组。NaHS或生理盐水处理24 h后,将NaHS组进行硫巯基化蛋白分离纯化。采用Western blot法定量分析各组ROCK2蛋白的浓度,以灰度值的比值来调整ROCK2蛋白的浓度,待浓度一致后再进行ROCK2活性检测。将蛋白样品加入到96孔板中,并设置空白孔和标准孔,按试剂盒说明书进行操作,以空白孔调零,450 nm波长测吸光度。
1.4.5神经细胞缺氧复氧损伤模型的建立 将原代海马神经细胞随机分为正常对照组、模型组、NaHS(50、100、200 μmol·L-1)组、硫巯基化抑制剂DTT组以及NaHS(200 μmol·L-1)+DTT组。除正常对照组外,细胞预处理24 h后弃去培养基加入缺氧液,置于90% N2-10% CO2三气培养箱中孵育4 h,再更换成完全培养基置于正常三气培养箱(37 ℃、5%CO2)孵育12 h,进行后续实验。
1.4.6CCK-8法检测细胞活力 取缺氧4 h/复氧12 h铺满96孔板(100 μL/孔)的神经元,每孔加入10 μL CCK-8试剂,培养箱中孵育1 h后用酶标仪测定450 nm处的吸光度,计算细胞活力。
1.4.7检测培养上清中LDH、NSE水平 使用试剂盒检测细胞培养上清中LDH和NSE活性。
1.4.8细胞凋亡检测 将细胞用不含EDTA的胰酶消化吹打分离出后,加入1 ∶3稀释的结合缓冲液。将5 μL Annexin V和10 μL碘化丙啶(PI)加入100 μL细胞悬液中避光放置5 min,立即检测各组凋亡率。

2 结果
2.1 原代培养大鼠海马神经元的鉴定取生长8 d的大鼠海马细胞,用神经元特异性标志物MAP2免疫荧光法进行细胞鉴定。如Fig 1所示,原代培养的细胞的细胞核被DAPI染成蓝色,和阴性对照组相比,胞体和轴突经MAP2抗体染色呈绿色荧光,结果表明所培养的大鼠海马细胞为神经元。
2.2 NaHS对大鼠海马神经元H/R损伤的影响
2.2.1NaHS对细胞活力及LDH和NSE活性的影响 如Fig 2A所示,与正常对照组相比,H/R模型组细胞活力显著降低(P<0.01),而给予外源性H2S供体NaHS 100和200 μmol·L-1可显著提高H/R损伤导致的细胞活力降低(P<0.01,与模型组相比);Fig 2B和Fig 2C显示,相比正常对照组,H/R模型组细胞上清中LDH和NSE活性有明显提高,提示H/R损伤细胞致NSE和LDH漏出增多。相比模型组,100和200 μmol·L-1NaHS可降低H/R导致的神经细胞LDH和NSE的漏出(P<0.01),50 μmol·L-1NaHS也可明显降低神经细胞H/R后培养上清中NSE活性。结果表明H2S对大鼠海马神经元H/R损伤有明显的保护作用。Fig 2A、Fig 2B和Fig 2C还显示,联合应用硫巯基化修饰阻断药DTT显著阻断200 μmol·L-1NaHS对H/R损伤诱导的细胞活力降低和上清液中LDH和NSE活性增高的抑制作用(与200 μmol·L-1NaHS组相比,P<0.01),对DTT单独应用对H/R损伤诱导的大鼠海马神经元细胞活力降低和细胞上清液中LDH和NSE活性增高无明显的影响。以上结果表明,外源性H2S对大鼠海马神经元H/R损伤的保护机制可能与蛋白质的硫巯基化修饰有关。
2.2.2NaHS对细胞凋亡的影响 流式细胞术检查结果(Fig 3A)显示:H/R模型组细胞凋亡率明显高于正常对照组(P<0.01),而50、100、200 μmol·L-1NaHS均可降低H/R对细胞凋亡率的影响(与模型组组相比,P<0.05)。结果表明H2S可抑制H/R损伤导致的大鼠海马神经元细胞凋亡。与细胞活力及培养上清中LDH和NSE活性的改变相似,联合应用DTT可降低200 μmol·L-1NaHS对H/R损伤诱导的大鼠海马神经元凋亡的抑制作用(与200 μmol·L-1NaHS组相比,P<0.01),而DTT单独应用同样对H/R损伤诱导的大鼠海马神经元凋亡无明显的影响。结果表明外源性H2S抗大鼠海马神经元H/R损伤的机制与硫巯基化修饰有关。

Fig 1 Identification of rat neurons by MAP2 under fluorescence microscope (×100)

Fig 2 Protection of NaHS on H/R injury in rat neurons and effect of S-sulfhydration on protection n=6)
2.3 NaHS对大鼠海马神经元ROCK2蛋白表达和活性的影响原代培养海马神经细胞,并给予不同浓度NaHS(50、100、200 μmol·L-1)。Western blot结果(Fig 4A)表明,与NS对照组相比,100和200 μmol·L-1NaHS可以降低大鼠海马神经细胞中ROCK2蛋白的表达(P<0.01);Fig 4B显示200 umol·L-1NaHS可以降低海马神经细胞中ROCK2活性(与NS对照组相比,P<0.01)。结果表明H2S对大鼠海马神经细胞中ROCK2蛋白表达和活性均有明显抑制作用。

Fig 4 Effects of NaHS on ROCK2 protein expression and activity in rat neurons n=3)
2.4 NaHS促进大鼠海马神经元中ROCK2的硫巯基化原代培养海马神经细胞,并给予不同浓度NaHS(50、100、200 μmol·L-1),24 h后,经过生物素化处理得到各组硫巯基化修饰蛋白,以硫巯基化修饰ROCK2蛋白量和总ROCK2蛋白量二者比值来定量分析NaHS对硫巯基化修饰ROCK2蛋白的影响,结果如Fig 5所示,与NS对照组相比,NaHS 100和200 μmol·L-1孵育24 h可提高原代培养的大鼠海马神经元中硫巯基化ROCK2(SSH-ROCK2)蛋白的含量(P<0.01),表明H2S可促进海马神经元中ROCK2蛋白的巯基化修饰。
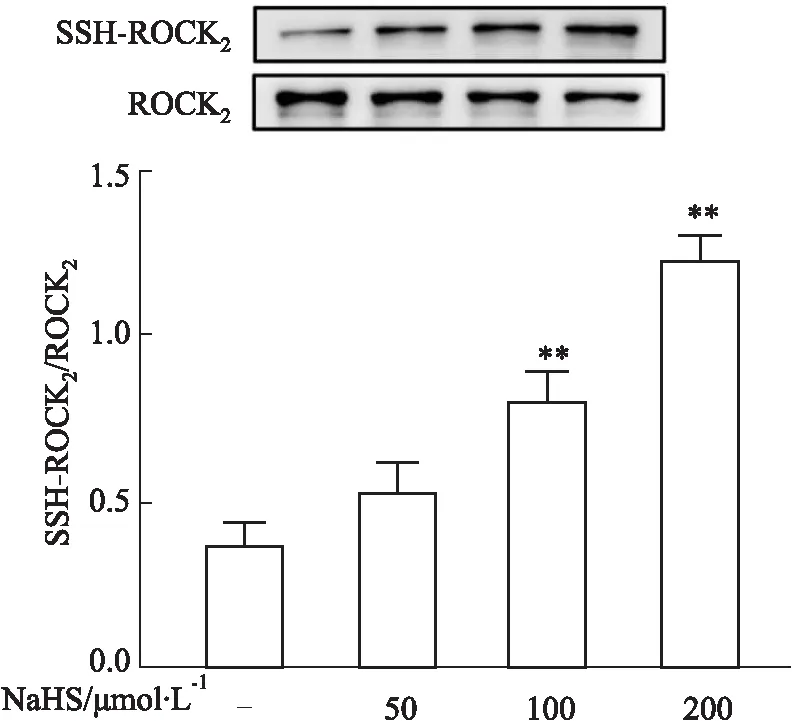
Fig 5 Effect of NaHS on protein level of S-sulfhydration ROCK2(SSH-ROCK2)in rat neurons n=3)
2.5 硫巯基化对ROCK2活性的影响为观察硫巯基化对ROCK2活性的影响,本研究从分别对照组和NaHS处理组海马神经元中提取总蛋白,分离纯化NaHS处理组细胞的硫巯基化蛋白,运用Western blot调整对照组总蛋白中的ROCK2蛋白含量与NaHS处理组硫巯基化蛋白中的SSH-ROCK2蛋白含量相等,继而测定ROCK2活性。结果如Fig 6所示,200 μmol·L-1NaHS处理组细胞中的SSH-ROCK2活性明显低于对照组细胞中的ROCK2活性,提示ROCK2硫巯基化修饰可明显降低其活性。
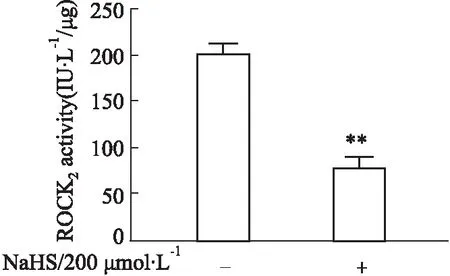
Fig 6 Effect of S-sulfhydration on ROCK2 activity in rat neurons n=3)
3 讨论
脑缺血/再灌注损伤是目前临床上高致残率、高致死率的主要疾病之一[11]。脑缺血/再灌注损伤以及细胞的H/R损伤均可导致细胞膜破损,造成神经细胞内的一些重要酶,比如LDH和NSE的外漏[12]。本研究在大鼠海马神经元H/R模型上,发现外源性H2S供体NaHS明显抑制H/R损伤诱导的细胞培养清液中LDH和NSE活性增高,表明H2S可抑制H/R损伤导致的大鼠海马神经元中LDH和NSE的外漏。同时,NaHS还可抑制H/R损伤诱导的海马神经元的活力降低和细胞凋亡,进一步明确H2S对大鼠海马神经元H/R损伤有明显的保护作用。
Chang等[13]发现Rho/ROCK2信号通路参与了脑缺血/再灌注损伤,而抑制ROCK2蛋白的表达可抑制脑缺血/再灌注后的神经细胞凋亡。本研究发现NaHS 100和200 μmol·L-1对大鼠海马神经元中ROCK2蛋白表达和活性有明显的抑制作用,这与我们以前报道的H2S可抑制小鼠平滑肌细胞中ROCK2活性[9]是一致的。因此,我们的结果提示H2S对海马神经元H/R损伤保护作用可能与抑制ROCK2蛋白表达和活性有关。但是H2S抑制ROCK2活性的机制需要进一步阐明。
近年来的研究表明,H2S可将某些靶蛋白半胱氨酸残基的SH基团转化为-SSH或过硫酸盐基团,对蛋白质结构和功能产生调节作用,这被称为硫巯基化(S-sulfhydration)修饰[5]。硫巯基化修饰是一种非常重要的蛋白质翻译后修饰方式,如H2S通过硫巯基化修饰血管平滑肌细胞的KATP通道,可引起通道的开放和钾离子外流而导致血管舒张[14]。RhoA-ROCK信号转导通路是一种重要的细胞内信号通路,参与了多种细胞功能的调节。ROCK是RhoA最直接的效应分子,在脑细胞中,以ROCK2表达为主。鉴于ROCK2分子结构中含有较多的半胱氨酸残基[15],H2S有可能通过半胱氨酸残基来硫巯基化修饰转录表达的ROCK2,并进而影响ROCK2活性。本研究通过改良生物素转换法[1]分离纯化硫巯基化蛋白,并结合Western blot法检测了硫巯基化蛋白中的SSH-ROCK2,结果表明100、200 μmol·L-1NaHS可以增加大鼠海马神经元中的SSH-ROCK2蛋白水平,证实了H2S可硫巯基化修饰大鼠海马神经元中的ROCK2。靶蛋白翻译后的修饰可影响其功能。本研究进一步发现NaHS组大鼠海马神经元中的SSH-ROCK2活性明显低于对照组中的ROCK2活性,表明H2S硫巯基化大鼠海马神经元中的ROCK2,并抑制其活性,这可能是H2S保护大鼠海马神经元H/R损伤作用的重要机制之一。
硫巯基化修饰可被DTT等还原剂所逆转[2]。本研究在在大鼠海马神经元H/R模型上,观察到了DTT可明显地阻断200 μmol·L-1NaHS对H/R损伤诱导的细胞活力降低、细胞中LDH和NSE外漏及细胞凋亡的抑制作用,结果提示硫巯基化修饰参与了H2S对大鼠海马神经元H/R损伤的保护作用,这与H2S硫巯基化ROCK2并抑制其活性的结果是一致的,但也不能排除H2S对如KATP通道等其它蛋白质的硫巯基化是否也参与了其保护作用,今后研究需要进一步明确。本研究首次阐明了H2S介导的硫巯基化修饰发生在RhoA-ROCK信号通路RhoA激酶2(ROCK2)中。也首次阐明了H2S介导的ROCK2硫巯基化修饰是H2S对大鼠海马神经元H/R损伤产生保护作用的机制之一,为脑缺血/再灌注损伤的临床研究提供了一个新的方向。
综上所述,本研究发现H2S对大鼠海马神经元H/R损伤有明显的保护作用,其机制与硫巯基化修饰致ROCK2活性降低及ROCK2蛋白表达减少有关。

