1,2-二取代吡咯类化合物的体外抗衣原体活性研究
徐顺鑫,解文霞,倪 敏,刘子义,柳凌艳,包小峰
(1.南通大学药学院,江苏 南通 226001;2.南开大学元素有机化学国家重点实验室,天津 300071)
衣原体是革兰阴性病原体,可导致性传播疾病在内的多种人类疾病的高发。同时,它也与动脉粥样硬化、中风和阿尔茨海默病等心脑血管疾病存在某种关联[1-2]。衣原体具有独特的双相发育周期,可在具有感染能力的基体(elementray body,EB)和具有复制能力的网状体(reticular body,RB)之间转换[3-4]。阿奇霉素和多西环素是目前治疗衣原体感染的首选药物[5],然而,症状复发和治疗失败的案例仍然很常见[6],加上目前仍没有可应用于临床的人源疫苗[7],这些现象都促使科研工作者试图从天然或者合成的化合物中寻找新型抗衣原体药物[8-16]。本文中,我们首次评估了前期合成的16个1,2-二取代吡咯类化合物的体外抗衣原体活性,并分析了它们作用机制,为抗衣原体药物的研发提供基础。
1 材料与方法
1.1 1,2-二取代吡咯类化合物1,2-二取代吡咯类化合物1-16的合成和分离如先前所述[17]。化合物溶解在DMSO中保存,实验时使用培养基稀释到适当的浓度。为了消除可能存在的化合物聚集所产生的干扰作用,稀释于培养基中的化合物样品在室温下以12 700 r·min-1(18 213×g)离心30 min,取上清评估其抗衣原体活性。
1.2 细胞培养和衣原体菌株HeLa S3和HEp-2细胞购自美国菌种保藏中心(American Type Culture Collection,ATCC),并进行常规培养。沙眼衣原体L2(ChlamydiatrachomatisL2,434/Bu菌株,简称CtL2)和鼠衣原体(C.muridarum,Nigg II菌株,简称MoPn)在HeLa S3细胞中培养,肺炎衣原体(Chlamydiapneumonia,AR39菌株,简称CpnAR39)在HEp-2细胞中培养。EBs纯化后,将其储存在蔗糖-磷酸-谷氨酸缓冲液(SPG)中,于-80 ℃保存[16]。
1.3 试剂与仪器DMEM 培养基购自Hyclone公司;特级胎牛血清购自Sigma公司;Gentamycin购自上海生工生物;WST-1细胞增殖和细胞毒性检测试剂盒购自碧云天生物;本实验中使用的3种衣原体检测一抗都是本课题组前期制备的常用抗血清[15-16],其中小鼠抗MoPn多克隆抗血清检测MoPn,因其能与CtL2发生交叉反应也用于检测CtL2,小鼠抗CpnAR39多克隆抗血清检测CpnAR39;FITC偶联的小鼠二抗购自Sigma公司。
二氧化碳培养箱(美国Thermo Fisher公司);多功能酶标仪(美国BioTek公司);低温高速离心机(德国Eppendorf公司);DMI3000B荧光显微镜(德国Leica公司)。
1.4 抗衣原体活性分析感染性子代滴度分析。将细胞接种到48孔板中,并按每孔感染复数(multiple of infection,MOI)0.2加入衣原体。除非另有说明,否则都在感染的同时将指定浓度的化合物添加到培养基中。使用0.5% DMSO为阴性对照,11.25 μmol·L-1四环素为阳性对照[16]。AR39感染后的细胞需在室温下900×g离心1 h以促进其感染。在37 ℃(L2和MoPn)或35 ℃(AR39)培养36 h后,洗涤感染的细胞两次,刮取细胞后通过超声裂解释放感染性子代EBs。将裂解液按1 ∶10连续稀释后,再次感染96孔板中的细胞,感染36 h后(hours post infection,hpi)甲醇固定细胞,使用上述一抗和FITC偶联的二抗进行染色,通过Leica DMI3000B荧光显微镜拍摄图片,计数每个样品中的包涵体数量,即为感染性子代EBs的数量。根据每组实验3个复孔的EBs数量平均值,计算化合物处理组相对于DMSO阴性对照组的抑制百分率。以3次重复实验的抑制百分率,非线性回归计算出IC50值,并以平均值(95%置信区间)表示。
免疫荧光染色分析。将细胞接种到24孔板中的盖玻片上,并如上所述加入衣原体感染细胞。36 h甲醇固定,并按上述顺序进行抗体染色,检测衣原体包涵体,同时利用Evans blue染色细胞质。Leica DMI3000B荧光显微镜采用10×目镜和20×物镜拍摄图片。
1.5 细胞毒性测定使用WST-1细胞增殖和细胞毒性检测试剂盒[14,18]评估1,2-二取代吡咯类化合物的细胞毒性。用含有8、16 μmol·L-1化合物或0.5% DMSO的培养基处理接种在96孔板中未感染的HeLa或HEp-2细胞。处理48 h后,添加10 μL WST-1试剂与细胞再培养2 h。根据细胞在450 nm处的吸光度,计算出化合物处理组相对于DMSO处理的对照组(设定为100%)的细胞活力。
1.6 EB感染能力测定将4×108IFU·L-1悬浮于SPG中的CtL2 EBs与不同浓度的化合物或0.5% DMSO在4 ℃共处理1 h。通过洗涤两次除去残留的化合物后,将EBs立即感染HeLa细胞。通过上述免疫荧光染色定量36 h时的包涵体数量。根据样品中EBs数量,计算出化合物处理组相对于DMSO处理的对照组的百分抑制率。
1.7 后加药实验将MOI=0.2的CtL2感染过夜培养的HeLa细胞,并在0、2、12和24 h时给予8 μmol·L-1的化合物8处理。在36 h时,收集细胞并如上所述测定感染性子代EBs的产生。根据样品中子代EBs数量,计算出化合物处理组相对于DMSO处理的阴性对照组的百分抑制率。
1.8 撤药实验将MOI=0.2的CtL2感染过夜培养的HeLa细胞,同时给予8 μmol·L-1的化合物8处理。在2、12、24和36 h,洗涤感染的细胞两次除去残留的化合物,并加入新鲜培养基。在36 h时,如上所述测定感染性子代EBs的产生以及百分抑制率数据。
2 结果
2.1 化合物对衣原体生长具有抑制作用按上述方法测定16个1,2-二取代吡咯类化合物不同浓度下对3株衣原体感染性子代滴度的影响,并根据抑制百分率数据分别计算出它们的IC50值,如Tab 1所示。整体来看,化合物对CtL2的抑制作用强于MoPn和CpnAR39,其中化合物8的抑制作用最强。通过给予8、16 μmol·L-1的化合物处理未感染的HeLa和HEp-2细胞来评估化合物的细胞毒性,如Tab 1所示。由于8 μmol·L-1的化合物8并没有表现出可检测出的细胞毒性,而且比其他化合物更有效,因此我们选择它来进一步分析化合物的抗衣原体作用。
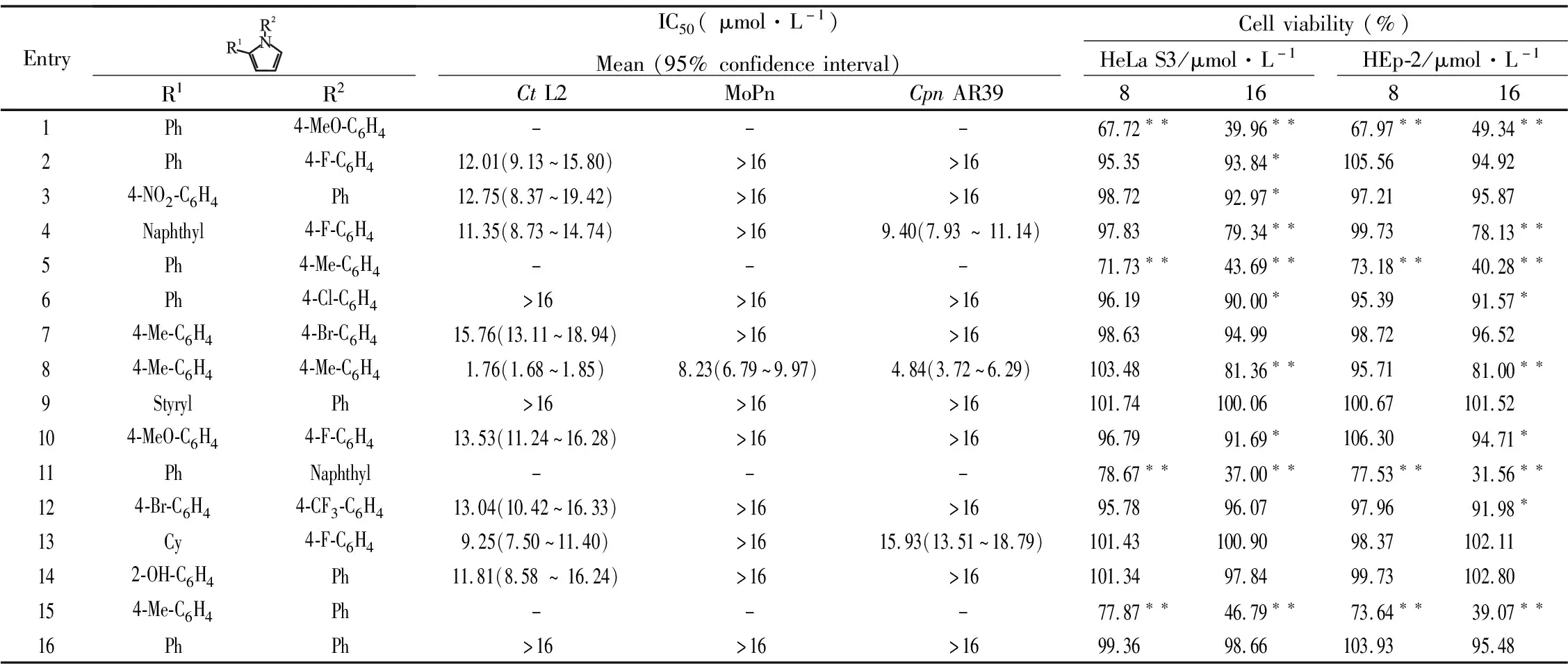
Tab 1 IC50 values(μmol·L-1)of compounds for Chlamydia
2.2 化合物8直接抑制衣原体的生长我们首先采用免疫荧光染色实验,分析了化合物对CtL2的直接抑制作用。与对照组样品相比,化合物8以剂量依赖性方式抑制了CtL2包涵体的形成(数量)和生长(大小)(Fig 1A)。包涵体的数量以及大小从1 μmol·L-1开始下降。在最高非细胞毒性浓度8 μmol·L-1时,包涵体很少且小。在16 μmol·L-1,几乎看不见包涵体,类似于阳性对照组四环素的效果(终浓度11.25 μmol·L-1)[11]。此外,化合物对子代EBs产生的抑制作用与对包涵体数量和大小的抑制作用一致(Fig 1B)。
2.3 化合物8直接抑制衣原体的感染和增殖过程接下来,通过检测化合物处理时间对其抑制作用的影响,进一步探索其抗衣原体作用。首先,我们检测了在感染前对衣原体EBs的预处理是否会影响其感染能力。如Fig 2所示,用化合物8预处理EBs会导致包涵体的形成呈浓度依赖性减少,表明这些吡咯化合物直接降低了EBs的感染能力。

Fig 1 The inhibitory effect of compound 8 on Ct
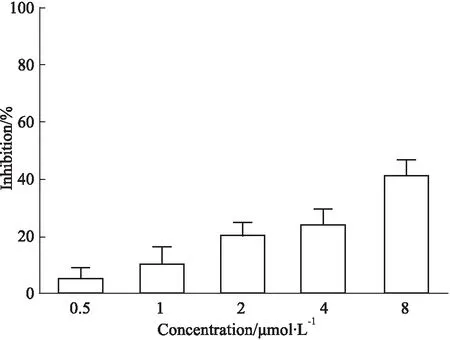
Fig 2 Infectivity of EBs inhibited by compound
其次,我们检测了在衣原体感染后不同时间将化合物加入(后处理,Fig 3A)或从已感染的培养物中撤去化合物(撤药,Fig 3C)后,感染性子代产生的变化。结果发现,在12 h或更早加入8 μmol·L-1的化合物不会改变其抗衣原体效果。在24 h加入化合物时,其抑制活性降低至约60%(Fig 3B)。如果在2 h从已感染的培养物中撤去化合物8,其对感染性子代的抑制率降低至75%。当化合物在12 h撤去时,其抑制效果略微降低至约95%。如果化合物在24 h撤去,仍然能保持其抑制作用。这些结果说明化合物还通过靶向衣原体生命周期24 h之前的早期至中期阶段来抑制衣原体的生长。
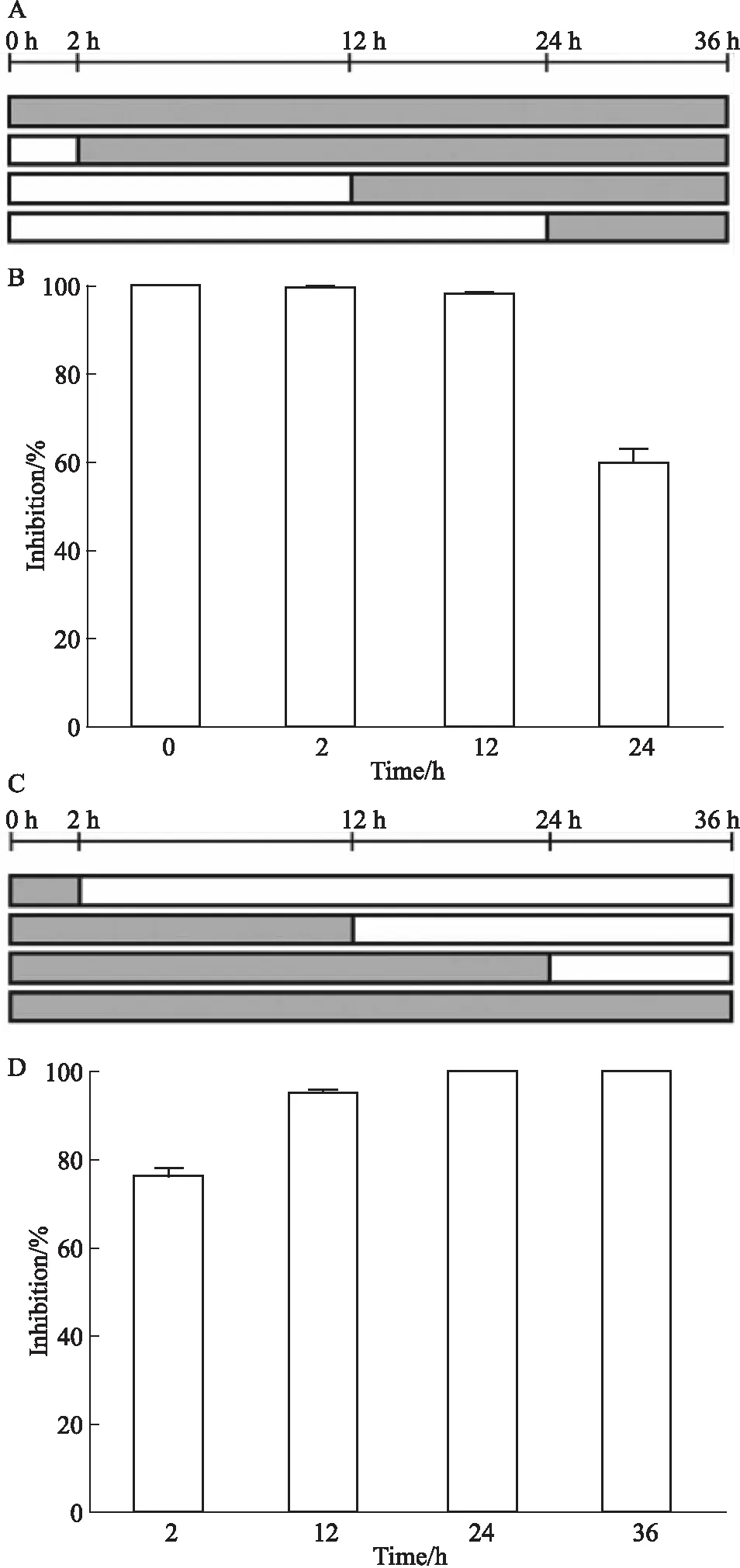
Fig 3 Impact of compound 8 administration time on antichlamydial efficacy
3 讨论
衣原体是世界性的人类致病菌。虽然它们对几种广谱抗生素敏感,但临床治疗失败的情况时有发生。这使得人们对于新型抗衣原体药物的需求越来越强烈[8-16]。在本研究中[13],我们首次发现合成的1,2-二取代吡咯类化合物能够抑制衣原体感染。对感染性子代EBs的IC50值显示,大多数化合物在微摩尔范围内均能抑制衣原体生长,这与我们之前合成的1,2,3,5-四取代吡咯化合物类似。与MoPn和CpnAR39相比,这些1,2-二取代吡咯类化合物选择性抑制CtL2。吡咯的C-1和C-2被对甲基苯基取代的化合物8具有最强的抗衣原体活性。与化合物5、15、16相比,除去R1、R2的苯基取代基上的甲基后,其抗衣原体活性降低,表明了甲基的重要性。R1和R2上具有苯基取代基的化合物16抗衣原体活性最差,表明了苯基上的取代基对其抗衣原体活性的重要性。
WST-1数据显示,在本研究的抗衣原体活性测定中使用的最高浓度16 μmol/L,除了化合物9和13,大多数化合物对宿主细胞均具有明显的毒性作用。此外,在8 μmol·L-1时,化合物8和14也没有显示出细胞毒性。与1,2,3,5-四取代吡咯化合物相比,1,2-二取代吡咯类化合物的细胞毒性随着取代基团的增加而降低[13]。所有被卤代苯基取代的化合物均显示出弱的细胞毒性。C-1具有甲氧基苯基和C-2具有苯基的化合物1对宿主细胞毒性最强。
衣原体独特的EB/RB双相生命周期为治疗干预提供了多种可能。本研究中,EB预处理实验显示化合物8以浓度依赖性方式减少了衣原体包涵体的形成,这表明1,2-二取代吡咯可通过在衣原体进入宿主细胞前的早期阶段抑制EB的感染能力来阻断衣原体感染。由于在最高浓度8 μmol·L-1化合物8也仅能抑制40%左右的衣原体感染(Fig 2),这说明化合物还靶向其他阶段来抑制衣原体的生长。后加药实验和撤药实验进一步证明了化合物8还通过靶向衣原体生命周期24 h之前的早期至中期来干扰衣原体的生长过程(Fig 3)。
我们的体外研究数据表明,1,2-二取代吡咯类化合物是一类具有抗衣原体活性的化合物。其中,C-1和C-2位置具有对甲基苯基的化合物8抑制活性最强。由卤代苯基、苯基和萘基取代的化合物的抗衣原体活性均较弱,表明吡咯上取代基的重要性。这些化合物通过在早期降低EB感染能力对衣原体的感染过程产生抑制作用,并靶向发育周期的早期到中期来干扰衣原体的生长过程。本研究表明,1,2-二取代吡咯类化合物可作为抗衣原体药物开发的先导化合物。

