甲状腺乳头状癌超声造影与肿瘤复发风险的相关性
李 文,张 艳,宋 青,兰 雨,何红莹,马 骏,赵佳航,李 怡,罗渝昆
1中国人民解放军医学院超声科,北京 100853 2中国人民解放军总医院第一医学中心超声诊断科,北京 100853
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)占甲状腺癌的80%~90%[1],尽管PTC为预后良好的一类肿瘤,但仍有部分PTC具有较高的侵袭能力和复发风险,因此术前识别这类肿瘤对治疗方式的选择有一定意义。超声造影(contrast-enhanced ultrasound,CEUS)可以评估肿瘤微血流[2],而肿瘤血供丰富程度与其侵袭性和复发风险密切相关,因此CEUS可以术前预测肿瘤的侵袭能力和复发风险。然而,以往研究多集中在PTC的CEUS增强强度与颈部淋巴结是否转移[3-5]、甲状腺被膜是否被侵犯[4,6]及癌灶大小[7]的关系方面,未能考虑到颈部淋巴结转移的大小、数目、有无结外侵犯,以及甲状腺腺外侵犯(extrathyroidal extension,ETE)的程度,也未充分评估PTC的复发风险。2015美国甲状腺协会(American Thyroid Association,ATA)复发风险分层[1]是分化型甲状腺癌初始术后复发风险的可靠预测指标[8-9],目前对PTC的CEUS与ATA复发风险分层之间的关系鲜有报道。本研究以2015 ATA复发风险分层为肿瘤复发风险分类依据,探讨了PTC CEUS与肿瘤复发风险之间的关系,以期为今后的临床决策提供参考。
资料和方法
资料来源2019年10月至2020年6月在中国人民解放军总医院第一医学中心收治经术后病理证实为PTC且术前超声资料(术前常规超声及CEUS检查)完整的287例患者,其中,男76例,女211例,平均年龄(43.5±11.2)岁(19~69岁)。对于多发PTC患者,选择病理T分期高的癌灶纳入研究,最终287例患者的287个癌灶纳入研究,癌灶中位最大径1.0 cm(0.6~1.3 cm)。所有患者均为首次手术。本研究获得中国人民解放军总医院医学伦理委员会批准(S2019-178-02)。
临床及病理资料采集记录纳入研究癌灶大小、是否多发、有无ETE、有无颈部淋巴结转移、淋巴结转移个数及大小、转移淋巴结有无结外侵犯、是否为cN1、BRAFV600E突变情况及病理亚型等。根据2015 ATA复发风险分层,将287例患者分为低复发风险组、中复发风险组和高复发风险组。
超声检查采用Siemens ACUSON Sequoia超声诊断系统,探头频率5~12 MHz。将造影剂声诺维(SonoVue)冻干粉剂与0.9%氯化钠溶液5 ml配置成微泡混悬液,震荡摇匀。患者取仰卧位,暴露颈部皮肤,首先行常规超声检查,记录病灶大小、内部结构、回声、形态及钙化等特征。选择CEUS最佳观察切面后,打开CEUS模式,调节聚焦点,使之位于病灶后方,保持探头不动,嘱患者避免吞咽,经肘静脉团注2.0 ml造影剂,随后立即推入生理盐水5 ml,同时启动计时器,观察并采集动态造影过程约3 min,并存储于影像工作站。在造影过程中机械指数(mechanical index,MI)调至0.08。
PTC CEUS模式评估
增强强度:根据病灶造影达峰时增强强度与周围甲状腺组织相比,增强强度分为:(1)低增强。(2)等增强:部分等增强,即部分区域为等增强,其余区域为低-无增强;弥漫等增强,即整个区域均为等增强。(3)高增强:部分高增强,即部分区域为高增强,伴等、低或无增强区(图1);弥漫高增强,整个病灶呈现高增强(图2)。

PTC:甲状腺乳头状癌;ATA:美国甲状腺协会;CEUS:超声造影PTC:papillary thyroid carcinoma;ATA:American Thyroid Association;CEUS:contrast-enhanced ultrasound图1 女,38岁,右叶0.9 cm PTC,cN1,术中见淋巴结结外侵犯,根据2015 ATA复发风险分层系统,患者为中复发风险,CEUS示PTC病灶呈病灶周边部高增强且增强范围扩大伴内部低-无增强区(箭头)Fig 1 A 38-year-old female patient with a PTC of 0.9 cm in the right thyroid,cN1,and extranodal extension,the patient was categorized as intermediate risk according to the 2015 ATA Modified Initial Risk Stratification System,CEUS indicated that the PTC periphery presented high and extended enhancement with internal hypo-enhancement region(arrow)
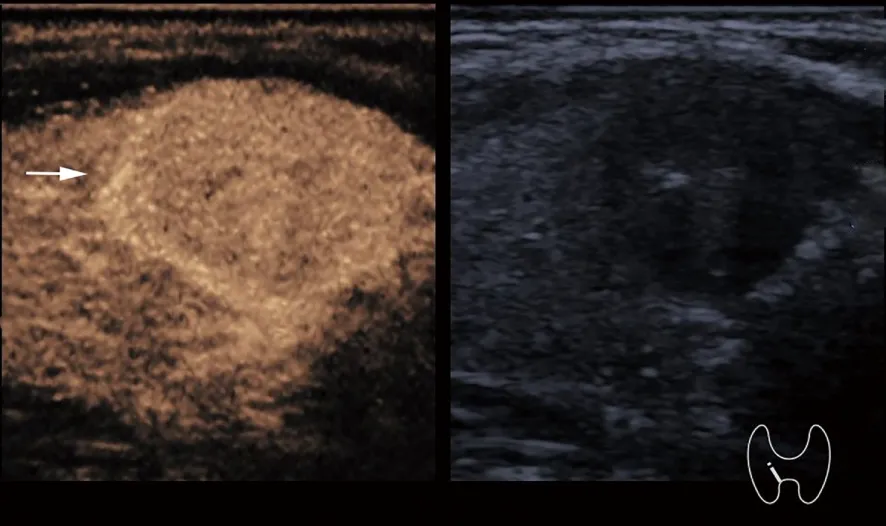
图2 女,42岁,右叶1.5 cm PTC,术中见肿瘤侵犯甲状腺被膜,根据2015 ATA复发风险分层系统,患者为高复发风险,CEUS示PTC病灶呈弥漫高增强伴不完整高增强环,与常规超声相比增强范围扩大(箭头)Fig 2 A 42-year-old female patient with a PTC of 1.5 cm in the right thyroid and gross extrathyroidal extension,the patient was categorized as high risk according to the 2015 ATA Modified Initial Risk Stratification System,CEUS suggested the pervasive hyper-enhancement with incomplete hyper-enhancement ring and extended enhancement region(arrow)
开始增强时间:与周围甲状腺组织相比,分为晚于、同步于和早于。
开始消退时间:与周围甲状腺组织相比,分为晚于、同步于和早于。
高增强环:为环绕病灶走形的环形结构,根据造影过程中有无,分为伴高增强环及不伴高增强环。
CEUS图像由2位经过CEUS技术培训,并具备甲状腺CEUS检查经验的医师分析。
统计学处理采用SPSS 21.0统计软件,符合正态分布的计量资料以均数±标准差表示,不符合正态分布的计量资料以M(Q1,Q3)表示;分类资料以频数(构成比)表示,组间构成比差异比较采用Pearsonχ2检验,双向有序资料多个组间比较采用Kruskal Wallis检验;复发风险与CEUS增强强度之间相关性分析采用Spearman秩相关分析,两者之间线性趋势分析采用Mantel-Haenszelχ2检验;调整年龄、性别,使用有序Logistic回归进一步探讨造影增强强度与PTC复发风险之间关系;P<0.05为差异有统计学意义。
结 果
病理结果及复发风险分层287例PTC患者中,179例为甲状腺微小乳头状癌(papillary thyroid microcarcinoma,PTMC),其临床、病理特征见表1。根据2015 ATA复发风险分层,287例PTC患者中,低复发风险66例(23.0%),中复发风险138例(48.1%),高复发风险83例(28.9%),复发风险分组依据详见图3;不同复发风险组间在年龄(χ2=1.565,P=0.457)、性别(χ2=0.738,P=0.691)方面差异无统计学意义(表2)。179例PTMC患者中,低复发风险59例(33.0%),中复发风险组88例(49.2%),高复发风险组32例(17.8%)。

图3 PTC复发风险分层及分层依据Fig 3 The recurrence risk stratification of PTC and its basis

表1 PTC及PTMC的临床和病理特征Table 1 Clinical and pathological features of PTC and PTMC
CEUS表现287个PTC病灶中,低增强灶84个(29.3%);等增强灶142个(49.5%),其中部分等增强灶34个(11.9%),弥漫等增强灶108个(37.6%);高增强灶61个(21.2%),其中部分高增强灶20个(6.9%),弥漫高增强灶41个(14.2%)。92.9%的低增强灶开始增强时间晚于周围组织,而42.6%和32.8%的高增强灶开始增强时间分别早于和同步于周围组织(P<0.0001)。79.8%的低增强灶开始消退时间早于周围组织,而49.2%和26.2%的高增强灶开始消退时间分别晚于和同步于周围组织(P<0.0001)。18.0%高增强灶伴不完整高增强环,高于10.7%的低增强灶和12.0%的等增强灶,但差异无统计学意义(χ2=1.897,P=0.387)(表3)。

表2 患者性别、年龄及CEUS增强强度与PTC复发风险关系[n(%)]Table 2 The associations of gender,age,and CEUS enhanced intensity with recurrence risk in PTC[n(%)]

表3 开始增强时间、开始消退时间及伴或不伴高增强环与PTC超声造影增强强度关系[n(%)]Table 3 The associations of arrival time,washout time,and hyper-enhancement ring with enhancement intensity in PTC[n(%)]
PTC复发风险与超声造影增强程度之间的关系低复发风险组中57.6%的病灶呈现低增强,中复发风险组中62.3%的病灶呈现等增强,而高复发风险组中48.2%的病灶呈现高增强(P<0.0001)(表2)。PTC复发风险与造影增强强度之间存在显著正相关,Spearman 秩相关系数为0.442(P<0.0001),且两者之间存在线性趋势(χ2=55.921,P<0.0001),表现为随增强强度增加PTC复发风险加大。有序Logistic回归分析显示,在调整年龄、性别后,高增强、等增强与低增强相比,PTC复发风险明显升高(P<0.0001)(表4)。

表4 超声造影增强强度与复发风险的有序Logistic回归分析Table 4 Ordinal logistic regression of enhancement intensity with recurrence risk in PTC
讨 论
PTC是甲状腺癌最常见病理类型,CEUS可实时观察肿瘤内微血流灌注状态,显著提高探测肿瘤病变的敏感性和特异性。本研究证实PTC CEUS增强强度与PTC复发风险分层之间存在显著正相关关系。
多项研究显示,PTC多表现为低增强[4,7,10-15],本研究中低增强灶占比29.3%,高于高增强灶的21.2%,但低于等增强灶的49.5%。甲状腺癌多为不均质增强[12,14-18],恶性肿瘤存在异质性,其内血供分布也存在异质性,但肿瘤的侵袭能力往往由血供较丰富的区域决定,因此在本研究中引入部分等增强和部分高增强的概念,以真实反映肿瘤内部血供丰富区域的增强情况。这可能是与以往研究相比,本研究中低增强灶占比偏低的原因。Liu等[5]在研究中根据病灶伴与不伴低增强区将高增强分为部分高增强和弥漫高增强,并发现相比于弥漫高增强,部分高增强颈部淋巴结转移率更高。本研究结果显示,高增强灶往往呈现开始增强时间早且开始消退时间晚,即呈“早到晚退”模式,而低增强灶往往呈现开始增强时间晚且开始消退时间早,即呈“晚到早退”模式。我们认为“早到晚退”模式反映肿瘤持续的血流灌注,是血供丰富的表现。张艳等[19]研究认为,瘤周不完整的高增强环是甲状腺癌的特征。本研究中12.9%的PTC伴瘤周不完整高增强环,但是PTC增强强度与有无高增强环之间差异无统计学意义。
CEUS作为一种纯血池显像技术,其增强强度可反映肿瘤内血供程度,而肿瘤血供丰富程度与其侵袭性密切相关。本研究结果显示,PTC造影增强强度与复发风险之间存在正相关性,表现为随造影增强强度增加,患者复发风险加大。Liu等[5]研究发现,PTC部分高增强预示颈部淋巴结高转移。Hong等[3]研究提示,高增强及等增强PTC,颈部淋巴结转移率明显高于低增强PTC。崔秋丽等[4]研究显示,与低增强PTC相比,高及等增强PTC颈部淋巴结转移率及甲状腺被膜侵犯发生率更高。周萍等[20]研究认为,增强强度与颈部淋巴结是否转移无关。Liu等[6]研究发现,造影增强强度与是否发生被膜侵犯无关。研究结果差异可能在于这些研究聚焦于有无淋巴结转移和/或有无被膜侵犯,而这并不能充分反映PTC的侵袭能力和复发风险。本研究采用2015 ATA复发风险分层系统进行PTC复发风险分层,可能更能反映PTC造影增强强度与复发风险之间的关系。
本研究存在以下局限性:(1)为单中心研究,病例选择可能存在选择性偏倚,需要多中心研究进一步验证;(2)纳入病例数不够大,需扩大样本量进一步研究;(3)作为初步研究,尚有许多问题待研究,如低增强灶中11.9%(10/84)呈现高复发风险,即乏血供病灶呈高复发风险,其背后原因须进一步探讨;(4)CEUS特征与复发风险分层的关系在PTMC中的表现尚需进一步研究探讨。
综上,本研究结果发现,PTC CEUS与肿瘤复发风险之间存在相关关系,“早到晚退”的高增强灶多呈高复发风险,而“晚到早退”的低增强灶多呈低复发风险,可为术前临床决策提供帮助。

