基于网络药理学探讨四逆散治疗肠易激综合征的潜在作用机制
严海冬 1,缪文清 1,张志鹏 2*,蔡延渠
[1.咸宁市中心医院,湖北咸宁 437000;2.湖北科技学院药学院,湖北咸宁 437100;3.广东药科大学新药研发中心,广东广州 510006;4.广东省教育厅现代中药重点实验室,广东广州 510006;5.国家中医药管理局中药制剂实验室(三级),广东广州 510006]
肠易激综合征(irritable bowel syndrome,IBS)是临床常见的功能性肠胃病,其发病机制不明确,可能与精神心理因素、肠道感染、内脏高敏性等相关[1],目前临床尚无特效治疗药物。依据其临床特征,IBS属于中医“泄泻”“飨泄”“郁症”范畴,病因主要为外感六淫、七情内伤、劳倦过度等[2]。
四逆散出自张仲景的《伤寒论•辨少阴病脉证并治》,由柴胡、白芍、枳实和甘草组成[3],临床治疗IBS取得良好的治疗效果[4]。IBS病机在于肝气郁结、脾胃不和、气机郁滞、通降失常、传导失职。四逆散中柴胡升发阳气、疏肝解郁,苦平,为君药;白芍敛阴养血,为臣药;柴胡协同白芍敛阴和阴、条达肝气,升散而无耗阳伤血;枳实辛苦酸,理气解郁、泄热破结,与柴胡相伍便于阳气布散,与白芍相伍理气和血;甘草调和诸药。现代药理学研究结果显示,四逆散具有促进胃肠活动、抑制胃酸分泌、调节免疫系统、抗病毒等药理作用[5],但缺乏治疗IBS的物质基础和作用机制方面研究。
2007年英国药理学家提出“网络药理学”概念,“网络药理学”的整体观念、系统观念符合中药的作用特点,因此在中药的现代化研究中得到广泛应用。郑洋等[6]利用网络药理学分析了莪术的物质基础和可能的作用机制,李筱楠等[7]分析了“栀子‐川芎”药对的抗抑郁作用靶点,并通过动物实验进行了验证。李娜等[8]应用网络药理学研究优化溃结方治疗溃疡性结肠炎的作用靶点、代谢物、KEGG信号通路等,揭示了优化溃结方的分子通路机理和作用机制,有助于其临床疗效体系的评价。本研究通过网络药理学方法,筛选四逆散活性成分和潜在作用靶点,分析四逆散治疗IBS的潜在作用机制和物质基础。
1 材料和方法
1.1 四逆散活性成分的筛选和收集
在TCMSP平台,分别以“柴胡”“白芍”“甘草”“枳实”进行检索,收集上述中药的物质成分,以OB≥30%和DL≥0.18为截断值,筛选适合口服吸收的物质成分。在此基础上,在Drugbank数据库逐一检索上述成分,获得活性物质成分的作用靶点[9]。
1.2 IBS疾病靶点的收集
以“irritable bowel syndrome”为关键字,分别通过人类基因组注释数据库Genecards、疾病相关的基因与突变位点数据库DisGeNET、治疗靶标数据库TTD收集IBS相关的基因靶点,数据统一为gene symbol后,数据去重,建立IBS疾病靶点数据库[10]。
1.3 四逆散治疗IBS相关靶点的确定
将活性物质成分的作用靶点和IBS疾病靶点数据输入同一Excel表格后,采用IF[COUNTIF(B:B,A2)>0,A2,0]公式取交集获得交集靶点,数据采用在线绘制韦恩图平台Venny 2.1进行可视化。
1.4 四逆散治疗IBS蛋白质互作网络的构建
交集靶点上传至String数据库,设置物种为“Homo sapiens”,进行在线蛋白质‐蛋白质的相互作用分析,导出数据资料,采用Cytoscape3.7.2 进行数据的可视化分析。以中位degree值为截断值,筛选核心靶点,构建四逆散治疗IBS的核心靶点PPI网络[11]。
1.5 GO富集分析和KEGG富集分析
将四逆散治疗IBS的核心靶点导入至Metascape数据库平台GO富集分析和KEGG通路分析。以P<0.01为条件筛选,得到四逆散治疗IBS的核心靶点的GO富集分析和KEGG通路分析,获得的KEGG通路采用KEGGmapper进行可视化[12]。
1.6 活性成分和核心靶点的分子对接验证
随机抽取4对活性成分和核心靶点进行Swiss DOCK分子对接,验证药物与靶点之间的连接性能。
2 结果
2.1 四逆散的主要活性成分
经过筛选,从“柴胡”“白芍”“甘草”和“枳实”中总计筛选获得140种活性化合物,其中柴胡活性成分17种,白芍活性成分13种,甘草活性成分92种,枳实活性成分20种。部分重要活性成分见表1。
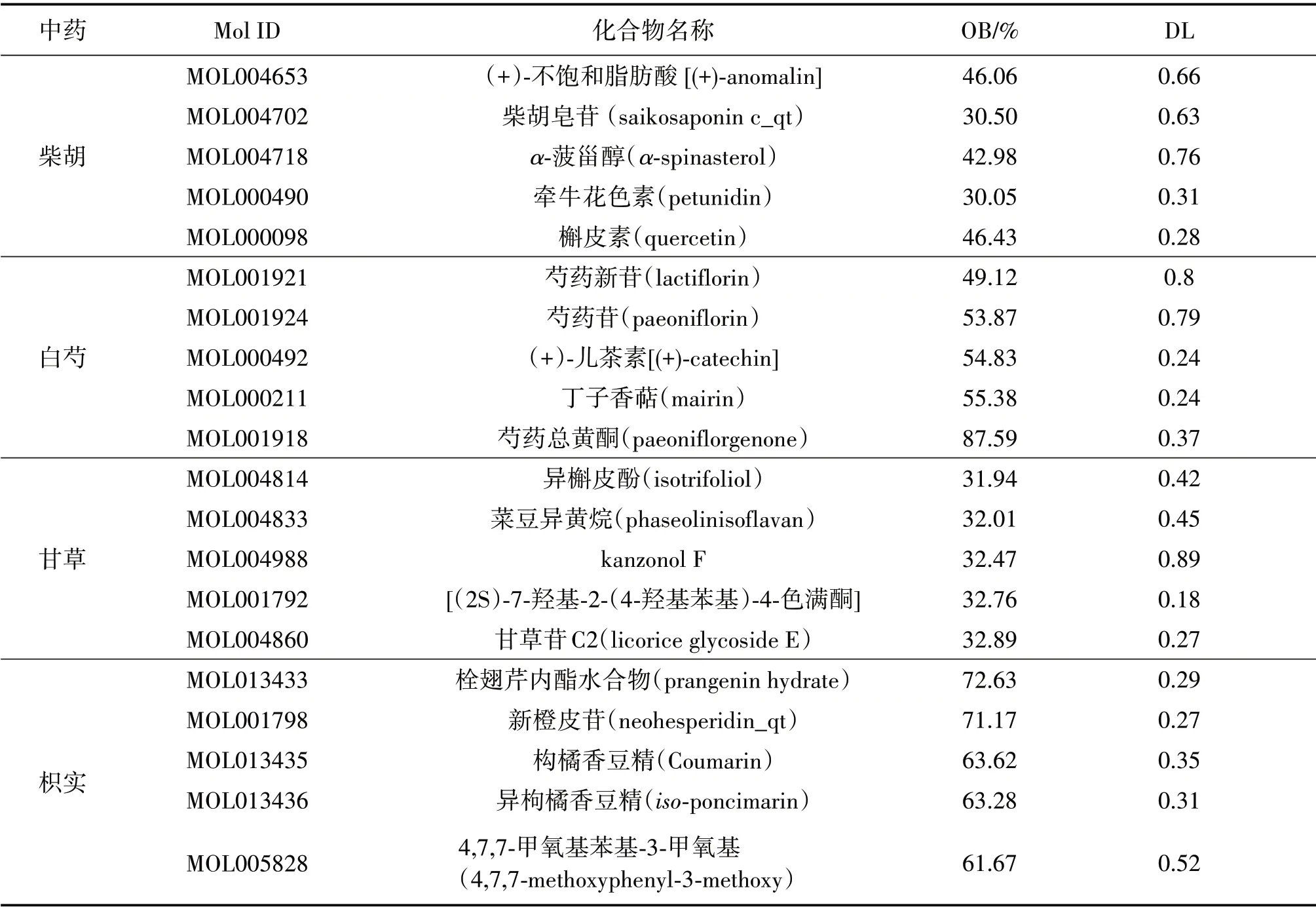
表1 四逆散的主要活性成分Table 1 The main active components of Sini Powder
2.2 IBS的疾病治疗靶点和四逆散活性作用靶点交集
“柴胡”对应疾病靶点342个,“白芍”对应疾病靶点122个,“甘草”对应疾病靶点1 704个,“枳实”对应疾病靶点298个,去重后获得269个疾病靶点。对疾病数据库以“irritable bowel syndrome”为关键词 进 行 检 索,分 别 从“disgenet”“drugbank”“gene‐Cards”“OMIM”和“TTD”数据库获得429、139、1 000、485、27个IBS疾病治疗靶点,去重后获得1 774个靶点。以IBS疾病靶点和四逆散活性成分靶点取交集,获得251个交集靶点。见图1。
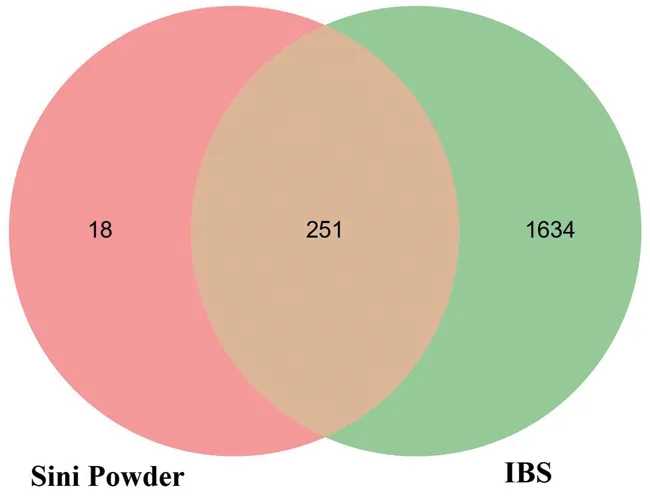
图1 IBS疾病治疗靶点和四逆散活性作用靶点交集Figure 1 The intersection of therapeutic targets of IBS and active targets of Sini Powder
将四逆散活性成分数据和相应疾病靶点数据导入Cytoscape软件,构建“药物‐有效成分‐靶点”网络。通过网络degree分析发现,degree值排名前10的成分分别为白花前胡丁素、槲皮素、谷甾醇、山柰酚、木犀草素、7‑甲氧基‑2‑甲基异黄酮、苯甲酰芍药苷、芒柄花黄素、柚皮素、异鼠李素(degree分别为152、150、63、63、58、42、42、40、38、38),可能是其中发挥药效的主要物质成分。见图2。
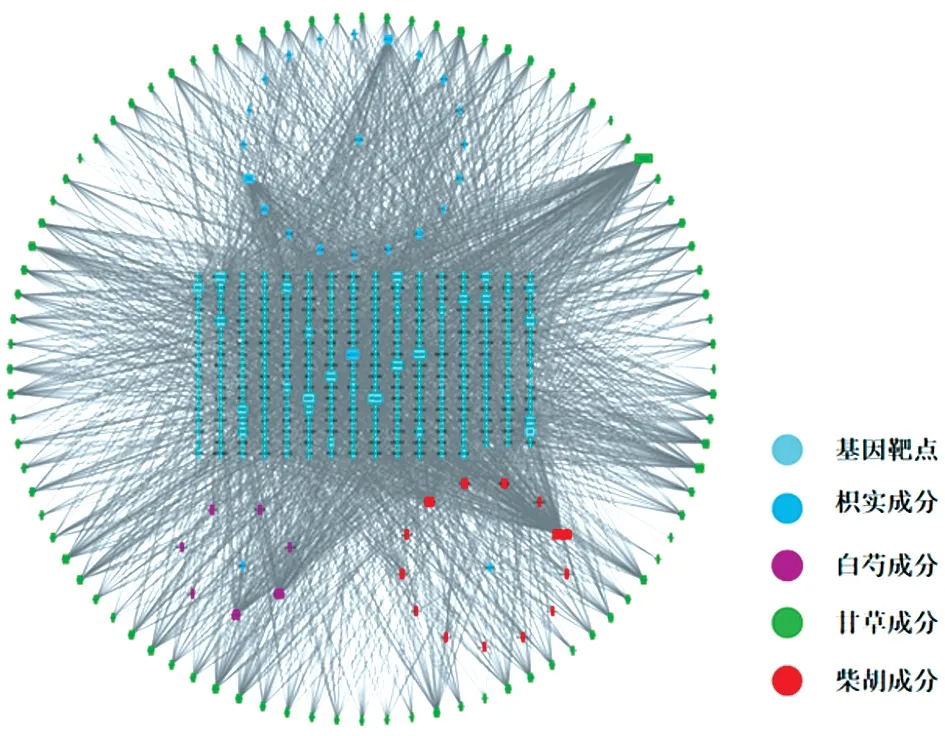
图2 四逆散的“药物‐有效成分‐靶点”网络Figure 2 The"drug‑active component‑target"network of Si‐ni Powder
2.3 四逆散治疗IBS关键靶点的PPI网络
将251个交集靶点导入String数据库,得到四逆散治疗IBS的交集靶点PPI网络,PPI网络中显示节点251个,边8 946条,平均节点度值(degree)为36.51,见图3。颜色越深,节点度值越大,发挥的生物学功能越明显。以degree数值>75为截点,选取核心疾病靶点构建四逆散治疗IBS的核心靶点PPI网络,AKT1、MAPK1、MMP2、EGF、TP53、CASP3、EGFR、MMP9、TNF、IL6具有最高的degree值,是四逆散治疗IBS的关键潜在治疗靶点。见图4。

图3 四逆散治疗IBS的交集靶点PPI网络Figure 3 PPI network of intersection target of Sini Powder in the treatment of IBS

图4 四逆散治疗IBS的核心靶点PPI网络Figure 4 PPI network of core target of Sini Powder in the treatment of IBS
2.4 四逆散治疗IBS核心靶点的GO富集分析和KEGG富集分析
图7 四逆散治疗IBS的信号通路Figure 7 Signal pathway of Sini Powder in the treatment of IBS
以P<0.01为截断值,对四逆散治疗IBS的核心靶点进行GO富集分析(见图5)和KEGG富集分析(见图6~7)。结果显示:GO biological processes主要涉及对刺激的反应、细胞增殖、生殖过程、运动、免疫系统过程、生物黏附、多细胞过程、细胞过程、行为和解毒等。GO cellular components主要涉及ficolin‑1颗粒腔、分泌颗粒腔、区域膜、髓鞘、细胞膜穴样内陷、溶酶体、树突、质膜蛋白复合物和早期内体等。GO molecular functions主要涉及一氧化氮合酶调节活性、细胞因子受体结合、蛋白激酶结合、生长因子受体结合、激活转录因子结合、受体配体活性、受体调节活性、组蛋白脱乙酰基酶结合、RNA聚合酶Ⅱ基础转录因子结合和转录辅激活子结合。KEGG富集分析涉及到的信号通路包括癌症信号通路、IL‑17信号通路、肿瘤坏死因子信号通路、Toll样受体信号通路、c型凝集素受体信号通路、NOD样受体信号通路、细胞凋亡、幽门螺杆菌感染中的上皮细胞信号转导、cAMP信号通路、PI3K‑Akt信号通路、MAPK信号通路、NF‑κB信号通路、炎症性肠病、催产素信号通路等。

图5 四逆散治疗IBS的核心靶点GO富集分析图Figure 5 Go enrichment analysis of the core target of Sini Powder in the treatment of IBS

图6 四逆散治疗IBS的核心靶点KEGG富集分析图Figure 6 KEGG enrichment analysis of core target of Sini Powder in treating of IBS
2.5 活性成分与核心靶点的分子对接验证
随机选取活性成分与核心靶点进行分子对接验证,图8结果显示,山柰酚与AKT1、槲皮素与AKT1、槲皮素与MAPK1、谷甾醇与CASP3的Esti‐matedΔG均小于−5 kJ/mol,表明活性成分与核心靶点具有良好的结合性能。

图8 四逆散活性成分与核心靶点的分子对接验证结果Figure 8 Molecular docking verification of active compo‐nents and core targets of Sini Powder
3 讨论
本研究利用TCMSP平台,对四逆散的4味中药进行了检索,并以OB≥30%和DL≥0.18为截断值,筛选适合口服吸收的物质成分。四逆散中含有活性成分140个,潜在作用靶点作用靶点269个,与IBS疾病靶点取交集,获得251个交集靶点。在四逆散的“药物‐有效成分‐靶点”网络中,通过network分析,degree值排名前10的成分分别为白花前胡丁素、槲皮素、谷甾醇、山柰酚、木犀草素、7‑甲氧基‑2‑甲基异黄酮、苯甲酰芍药苷、芒柄花黄素、柚皮素、异鼠李素。degree值越大,越有可能是四逆散发挥药效的有效成分。
槲皮素是自然界广泛存在的一类黄酮醇类化合物,具有抗菌、抗感染、抗过敏、降血脂等作用。已有研究在动物模型上证实了槲皮素的抗IBS作用,如黄泓轲等[13]发现槲皮素与5‑氨基水杨酸协同治疗、改善感染后肠易激综合征大鼠症状体征;而在体外实验中,槲皮素可通过加强紧密连接蛋白的结构和功能改善肠上皮屏障功能[14]。谷甾醇可通过抑制炎症因子和相关酶的过表达来缓解急性结肠炎[15];木犀草素可通过干预IRE1/XBP1通路调节炎症性肠病小鼠内质网应激稳态,对于肠道具有保护作用[16]。白花前胡丁素是一种香豆素类化合物,本研究中具有最高degree值,但目前尚未见白花前胡丁素在IBS应用中的相关报道,推测它可能是一种潜在的IBS治疗药物,值得在下一步研究中加以验证。
AKT1、MAPK1、MMP2、EGF、TP53、CASP3、EG‐FR、MMP9、TNF‑α、IL6是四逆散治疗IBS的关键潜在治疗靶点。EGF、EGFR可以通过调控ZO‑1和Occludin蛋白来调节屏障的通透性[17],ERK/MAPK通路可以通过调控紧密连接蛋白水平来增强肠道的屏障功能[18],四逆汤或可通过增强肠黏膜紧密连接蛋白的表达促进肠道组织的修复。TNF‑α是一种广谱的炎性细胞因子,也是肠道黏膜屏障损伤的重要启动因子,一方面可改变肠道紧密连接蛋白的表达和分布,另一方面可通过诱导炎症因子IL‑6和IL‑1β的产生,损伤黏膜组织[19]。
IBS在临床上虽然不归属炎性疾病,但是90%IBS患者的肠壁炎性细胞增多,肠道炎症可破坏肠道上皮的屏障功能,导致IBS的发生。本研究通过KEGG富集分析发现,四逆散作用通路中包含多个炎症信号通路,如IL‑17信号通路在炎症反应和炎症维持过程中起着非常重要的作用,在IBS的发生发展过程中,IL‑17出现先下降后升高的动态改变[20];郭文涛等在研究中发现腹泻型肠易激综合征患者肠黏膜中的TLR‑2和TLR‑4的表达升高,TLR的表达水平与肠道拟杆菌门和梭菌属存在一定的关联[21];同时,TLR4可以激活NF‑κB信号通路介导内脏超敏反应的发生,TLR4/MyD88/NF‑κB导致炎性因子的产生也是IBS产生的重要因素[22]。
综上所述,本研究通过网络药理学方法探讨了四逆散治疗肠易激综合征的潜在物质基础和作用机制,其活性成分主要通过调节炎症信号通路和肠道运动发挥治疗IBS作用,为下一步研究的开展提供了理论基础。

