秸秆还田土壤改良培肥基质和复合菌剂配施对土壤生态的影响
宋时丽,吴 昊,黄鹏伟,孙 凯,张振华,张 勇,戴传超,*
1 南京师范大学生命科学学院,江苏省微生物资源产业化工程技术研究中心,江苏省微生物与功能基因组学重点实验室,南京 210023 2 江苏省农业科学院资源与环境研究所,南京 210014 3 江苏省句容蓝天碧水生物科技有限公司,句容 212402
据统计,2018年我国农作物种植面积达1.17亿hm2[1],作物秸秆总量超过9亿t,秸秆利用多以肥料化、饲料化和燃料化为主[2]。但由于技术普及的困难,大多数地方还是采用秸秆粉碎后全量直接还田的方式。秸秆主要由纤维素、半纤维和木质素组成,结构复杂,再加上其较高的C/N比,自然状态下降解缓慢,还田一季后田间还有大量残留,导致秸秆中的养分无法及时还田,长此以往,田间秸秆堆积,极易造成秸秆中的虫卵孵化,加重作物虫害[3],降低作物产量[4]。因此研究快速降解直接还田秸秆的方法是重中之重。
目前,多数研究集中于利用微生物降解还田秸秆上。颜建东[5]等人证明,向田间施加市购秸秆腐熟剂可以使还田麦秸快速腐解,但市购秸秆腐熟剂中所含微生物菌种不详,难以适用于所有作物,盲目施用会取得相反结果[6];钱海燕[7]等人将市购微生物菌剂(主要为腐解菌)与化肥配施,缓解了秸杆的高C/N比,发现能够加快秸秆腐解;然而该类微生物菌剂中的菌种多为单一菌种,腐解效率有待提高且是否对作物有负面影响尚不清楚。一些研究人员转而筛选高效降解纤维素、半纤维、木质素相关细菌、真菌、放线菌[8- 10],制作成复合菌剂,证明其能够进一步加快田间还田秸秆的降解,同时对于土壤肥力、土壤微生物和作物产量都有积极影响[11]。然而这些复合菌剂的效果受到施肥方式、气候、土壤类型、农作物类型的影响,因此,复合菌剂的成分不是一层不变的,需要因地制宜。
黄河故道沿线受水流冲刷影响,土壤呈碱性砂质状态,该地土壤肥力低下、生物功能弱和微生物多样性低,导致农作物生长受限,产量较低。黄河故道地区土壤培肥,对于提高粮食产量有重要意义。本课题选择江苏省盐城市滨海县黄河故道地区作为试验点,开展上述研究。因此本文根据试验区作物秸秆全量直接还田及土壤性质特点,一方面施加复合菌剂促进秸秆快速还田,增加土壤有机质含量、培育土壤微生物多样性和生物功能。该复合菌剂含特色菌种 —一株植物内生真菌Phomopsisliquidambaris,其分离自重阳木茎内皮,被命名为B3。前期研究表明该菌分泌漆酶的活性很高[12],能有效降解木质素并在田间实验中证明可促进水稻生长[13],是一种有益促生菌。除此之外,本复合菌剂还含枯草芽孢杆菌[14]、蜂房芽孢杆菌[15]和黑曲霉[16],它们均具有较好的纤维素和半纤维降解能力。本文已证明用于加速还田秸秆降解且有植物内生真菌B3参与的复合菌剂不仅能够较好地降解盆栽玉米秸秆,还有助于改善土壤理化性质、增加作物产量[17];但该种复合菌剂能否在试验区田间发挥作用还需要进一步研究。另一方面,通过集中腐熟且富含有机质的土壤改良培肥基质的施加,对该砂质碱性土进行培肥,提高土壤有机质,改善耕地质量。通过上述两个方面,进行不同的施肥处理,旨在短期内消减中低产农田土壤障碍、培育土壤生物功能、提升耕地质量和生产力,并选出能够快速土壤培肥和土壤生物功能培育的最优培肥方式进行推广。
1 材料与方法
1.1 试验地概况
试验于2017年11月22日至2018年6月15日在江苏省盐城市滨海县界牌镇黄河湾科技公司试验基地(34°06′08″N, 119°51′16″E)进行。该地区年平均气温为14 ℃,年平均降雨量为942.6 mm,最大为1371.9 mm,最少535.8 mm,年平均降雨日数为100 d左右,多集中在夏季。试验地距离黄河故道7.2 km,土壤为砂质碱性土。该地区的冬小麦和夏水稻秸秆均全部还田;本文主要针对第一季稻茬小麦在上季水稻秸秆全部还田条件下经过处理后土壤的理化性质、生物学性质和土壤微生物多样性变化情况进行研究。
1.2 菌种及菌剂制作
1.2.1菌种
试验中使用的有机物料腐熟剂是用实验室保藏菌种复配形成的复合菌剂,包括植物内生真菌枫香拟茎点霉(Phomopsisliquidambaris),编号为B3、黑曲霉(Aspergillusniger)、枯草芽孢杆菌(Bacillussubtilis)、蜂房芽孢杆菌(Bacillusalvei),它们均为能够降解秸秆并对作物有促生功能的有益菌种;通过平板对峙实验表明这四种菌两两之间没有拮抗作用,说明它们可以一起复配制作成复合菌剂。真菌用4 ℃保藏的斜面进行PDA转接,挑取单菌落真菌菌丝用PDA液体培养基扩繁,28 ℃,180 rpm摇床3 d获得种子液;用-80 ℃甘油保藏的两种细菌进行平板划线法复壮,LB固体培养基培养后挑取单菌落于LB液体培养基中进扩繁,37 ℃,180 rpm摇床2 d获得种子液;取各菌株种子液按接种量5%转移到相应的液体培养基中进行放大培养,培养条件同种子液发酵条件,获得发酵液。接着测定菌液中菌体数目,细菌用稀释涂布平板法计数,其中枯草芽孢杆菌为6.15×109菌落数/mL,蜂房芽孢杆菌为6.25×109菌落数/mL;真菌用摇匀烘干称重法,其中B3为3.52×10-2g/mL,黑曲霉为4.1×10-3g/mL。
1.2.2菌剂制作
实验中所用菌剂剂型均为固体菌剂。按照麸皮:锯木屑:稻壳=6:3:1,将其混匀后每400 g装灭菌袋,并向袋中加200 mL水,拌匀后进行121 ℃,20 min灭菌处理,待其冷却后接入50 mL菌种发酵液单独发酵,整个过程均在超净工作台完成。接种完成后真菌放在28 ℃培养箱培养,待真菌菌丝长满整个发酵袋视为发酵完成;细菌则放在37 ℃培养箱培养,待有机物料质地粘稠视为发酵完成。最后将发酵好的四种菌等量混匀,按照60 kg/ hm2标准均匀撒入田间。
1.3 试验设计
该试验地长期进行水稻-小麦轮作,试验地共分成五个大区,每个大区长30 m,宽45 m,大区之间1.5 m间隔,每个大区面积为1334 m2,整个实验地块面积共6670 m2,各个大区内人为分成三块,作为三个重复,由于地块较大,实验重复不便随机分布,但取样是随机的,每个处理取三组重复。在前季作物水稻秸秆全量还田的条件下,实验以土壤改良培肥基质(Modified organic substrate,MOS,茅峰牌,Q/321183 BLT 001—2017)、复合微生物菌剂(Compound microbial agent,CMA)和化肥(chemical fertilizer,CF)为要素,设计了以下五个处理:①土壤改良培肥基质+有机物料腐熟复合菌剂+常规化肥联合处理,MOS+CMA+CF;②单独有机物料腐熟复合菌剂+常规化肥,CMA+CF;③单独的土壤改良培肥基质+常规化肥,MOS+CF;④常规化肥处理对照,CF;⑤不施肥空白对照,CK。土壤改良培肥基质从公司购得,主要是由畜禽粪便、药渣、蘑菇渣和秸秆等腐熟有机物料发酵制成,每克含有效菌落数(cfu)≥ 2亿个,总养分(N、P、K)≤ 3%,pH为6.5—8.5。其中土壤改良培肥基质施加7500 kg/ hm2、复合微生物菌剂施加60 kg/ hm2、化肥用量则参照当地习惯常规施加,即施加复合肥(江苏中东化肥股份有限公司,绿聚能,N+P205+ K20 ≥ 40%)750 kg/ hm2作为基肥,小麦返青期追氮肥(尿素)105 kg/ hm2,拔节孕穗期追氮肥(尿素)254 kg/ hm2。小麦为机器播种,播种密度为 375 kg/ hm2;小麦生长期间没有进行补苗、间苗工作。考虑到试验区面积较大,划分的小区无法随机分布,为了避免各小区处理前土壤的不均匀,分别测定了划分后各小区处理前土壤的基本理化性质,并与小麦不同生长时期的土壤进行比较分析。
1.4 土壤样品采集与测定
1.4.1土壤样品采集
试验区小区划分后,用取土钻通过五点取样法采取土壤深度为5—20 cm的处理前土壤(S0)、小麦返青期土壤(S1)、小麦拔节孕穗期土壤(S2)、小麦成熟期土壤(S3),每个处理取三次重复。土壤采集后,一部分土壤风干后过1 mm筛进行土壤基本理化性质的测定,其中用于土壤有机质、全氮和全磷测定的土壤需过100目筛。一部分土壤置于4 ℃冰箱进行土壤酶活和土壤微生物量碳/氮测定,另一部分放于-80 ℃冰箱用于土壤总DNA的提取。原始土壤(S0)的基本理化性质如表1所示,且表中数据总体上相对均匀。

表1 处理前土壤(S0)基本理化性质
1.4.2土壤样品理化性质的测定
土壤有机质用重铬酸钾氧化外加热法测定[18],总氮用碱性过硫酸钾法测定[19],总磷用硫酸-过氧化氢消煮钼锑抗比色法测定,速效氮用碱解扩散法测定[20],速效磷用钼锑抗比色法测定[21],速效钾用乙酸铵浸提火焰光度计(WFX- 200)法测定[22],土壤pH用pH计测定(土水比1∶2.5,体积分数),容重用环刀法测定,土壤阳离子交换量用乙酸钠-火焰光度计法测定[23]。
1.4.3土壤样品生物学性质的测定
土壤酶活性的测定主要参照关松荫的相关方法[24]。土壤纤维素酶活性用DNS法测定,脲酶活性用靓酚蓝比色法测定,碱性磷酸酶用苯磷酸二钠比色法测定,分别用mg glucose 10 g-172 h-1,mg NH4-N g-124 h-1,μg phenol g-124 h-1表示;土壤微生物量碳和土壤微生物量氮均用氯仿熏蒸浸提法测定[25-26]。
1.4.4土壤样品总DNA提取
土壤总DNA用试剂盒提取(FastDNA Spin Kit),PCR体系为50 μL,其中真菌进行18SrRNA扩增,引物为NS1:5′-GTAGTCATATGCTTGTCTC- 3′,GCFung 5′-CGCCCGCCGCGCCCCGCGCCCGGCCC/GCCGCCCCCGCCC CATTCCCCGTTACCCGTTG- 3′,扩增条件为94 ℃变性4 min;94 ℃30 s, 55.5 ℃退火30 s, 72 ℃延伸1 min,35个循环,最终再72℃延伸10 min;细菌进行16SrRNA扩增,引物为517R:5′-ATTACCGCGGCTGCTGG- 3′, 357f-GC:5′-CGCCCGCCGCGCGCGGCGGGCGGGGC/GGGGGCACGGGGGGCCTACGGGAGGCAGCAG- 3′, 扩增条件为94 ℃变性4 min; 94 ℃1 min, 65 ℃退火1 min, 20个循环,72℃延伸1 min。扩增好的PCR样品进行DGGE,其中真菌DGGE使用浓度为20%—50%的变性胶,在60 ℃下电泳10 h,然后剥胶进行EB染色,最后扫胶成像进行后续分析;细菌DGGE使用浓度为35%—65%的变性胶,操作同真菌。
1.4 小麦产量测定
2018年6月15日小麦成熟时,沿各处理小区对角线取1 m2样方,每个处理取三组重复,一共15个样方(5处理×3重复)。实时分数每个样方中小麦总穗数,随后从每个样方中随机抽取30株小麦进行穗粒数统计,通过加权平均值确定不同处理的小麦穗粒数。千粒重则是将样方中所有小麦脱粒后带回实验室,数小麦千粒于55 ℃烘箱进行72 h烘干称重所得。
1.5 统计分析
本实验的所有数据均采用SPSS 16.0进行统计分析,柱状图用origin 8.6软件制作,DGGE聚类用GelCompar II软件制作。文中数据通过单因素方差(one-way)分析,Turkey法检验数据差异显著性,其中P< 0.05。
2 结果
2.1 不同处理土壤化学特性的变化情况
本试验区土壤有机质含量整体偏低(低于10 g/kg)。S1时期,MOS+CMA+CF和MOS+CF处理的土壤有机质含量显著高于其他处理,CMA+CF处理的有机质含量最低,仅有4.85 g/kg; S2时期,整体上各处理有机质含量均有所提高,其中仅MOS+CF处理显著高于CF和CMA+CF; S3时期,CMA+CF处理的有机质含量仍然最低,MOS+CMA+CF、MOS+CF、CF和CK均显著高于该处理,分别高出1.44倍、1.34倍、1.22倍和1.28倍。与S0相比,S3时期的MOS+CMA+CF和MOS+CF处理的有机质含量基本保持不变,而CMA+CF和CF处理分别降低了29.41%和11.70%。相同小麦生长期内,各处理之间的TN含量无显著差异;但不同小麦生长期之间,S2时期各处理的TN含量显著高于其他生长期。S1时期,CMA+CF和MOS+CF处理的TP含量显著高于其他处理;S2和S3时期,MOS+CMA+CF和CMA+CF处理的TP含量显著高于其他处理,MOS+CF仅在S1时期提高后便保持较低水平。随着小麦生长期的不同,整体上各处理土壤中AN含量显著提高。S1和S2时期,MOS+CMA+CF和MOS+CF处理的AN含量显著高于其他处理,CF处理最低;S3时期,MOS+CMA+CF处理的AN含量显著高于其他处理;但与S1相比,CMA+CF的AN含量提高了2倍,而MOS+CMA+CF和MOS+CF处理则分别提高了1.44和1.38倍,CF处理的AN含量仍然是最低的。不同小麦生长期中,MOS+CMA+CF、CMA+CF和MOS+CF处理的AP含量均显著高于其他处理,其中联合处理的AP含量最高。此外,MOS+CMA+CF处理的AK含量在不同小麦生长期内也是较高的(表2)。 pH显著下降,缓解了田间土壤碱性环境,与CF相比,MOS+CMA+CF和CMA+CF这两个处理的pH值已接近中性。

表2 不同处理土壤基本化学性质
2.2 不同处理土壤物理特性变化情况
表3结果显示,相同小麦生长期内,各处理土壤容重无显著差异;但一个小麦生长季之后, MOS+CMA+CF、CMA+CF、MOS+CF均表现出容重下降的趋势。该结果与土壤孔隙度结果相对应,即处理组的土壤空隙度到S3时期显著提高,而表中只有CF处理的孔隙度发生下降。在小麦的三个时期中, CMA+CF和CF处理的CEC数值较小, MOS+CMA+CF和MOS+CF的CEC均显著高于CMA+CF。

表3 不同处理土壤物理特性(平均值±标准误)
2.3 不同处理土壤生物学特性的变化情况
2.3.1土壤纤维素酶活
图1中,随着小麦生长,土壤纤维素酶活整体呈上升趋势;与未处理前土壤比,S3时期各处理土壤纤维素酶活均显著提高。S1时期,CMA+CF处理的土壤纤维素酶活最低,CF处理的土壤纤维素酶活显著高于CMA+CF,其他处理之间无显著差异; S2时期,CMA+CF和CK两个处理的土壤纤维素酶活较低,MOS+CF处理的土壤纤维素酶活显著高于CMA+CF和CK;S3时期,CMA+CF处理的土壤纤维素酶活最高并显著高于CK。

图1 不同处理土壤纤维素酶酶活Fig.1 Soil cellulase activity of the different treatmentsMOS+CMA+CF:土壤改良培肥基质+有机物料腐熟剂+常规化肥,CMA+CF:有机物料腐熟剂+常规化肥,MOS+CF:土壤改良培肥基质+常规化肥,CF:常规化肥,CK:不施肥空白对照。完全不同的大写字母表示同一处理不同时期间差异显著,完全不同的小写字母表示同一时期不同处理间差异显著(P < 0.05),图中数据为平均值±标准误(n=3);S0: 处理前土壤; S1:小麦返青期土壤;S2: 小麦拔节孕穗期土壤;S3: 小麦成熟期土壤
2.3.2土壤脲酶酶活
图2中,S1和S2时期(即小麦生长前期)土壤脲酶活性较低,且与S0相比无显著差异。与其他时期相比,S3时期,除CK之外,其他处理的脲酶活性均显著提高;而与CK相比,MOS+CMA+CF提高了56.87%、CMA+CF提高了37.29%、MOS+CF提高了29.15%。CF和CK处理的脲酶活性大小相似。虽然单独施加土壤改良培肥基质和单独施加菌剂都能提高土壤脲酶活性,但二者联合施加的效果更加显著。

图2 不同处理土壤脲酶酶活Fig.2 Soil urease activity of the different treatments
2.3.3土壤碱性磷酸酶酶活
图3显示,在小麦的整个生长时期中,土壤碱性磷酸酶活性呈先提高后下降的趋势,且各处理之间无显著差异。其中S1和S2时期,CK处理的土壤碱性磷酸酶活性较高,其次为MOS+CMA+CF和MOS+CF处理;S3时期,CMA+CF处理的土壤碱性磷酸酶活性较高,其次为MOS+CMA+CF处理。
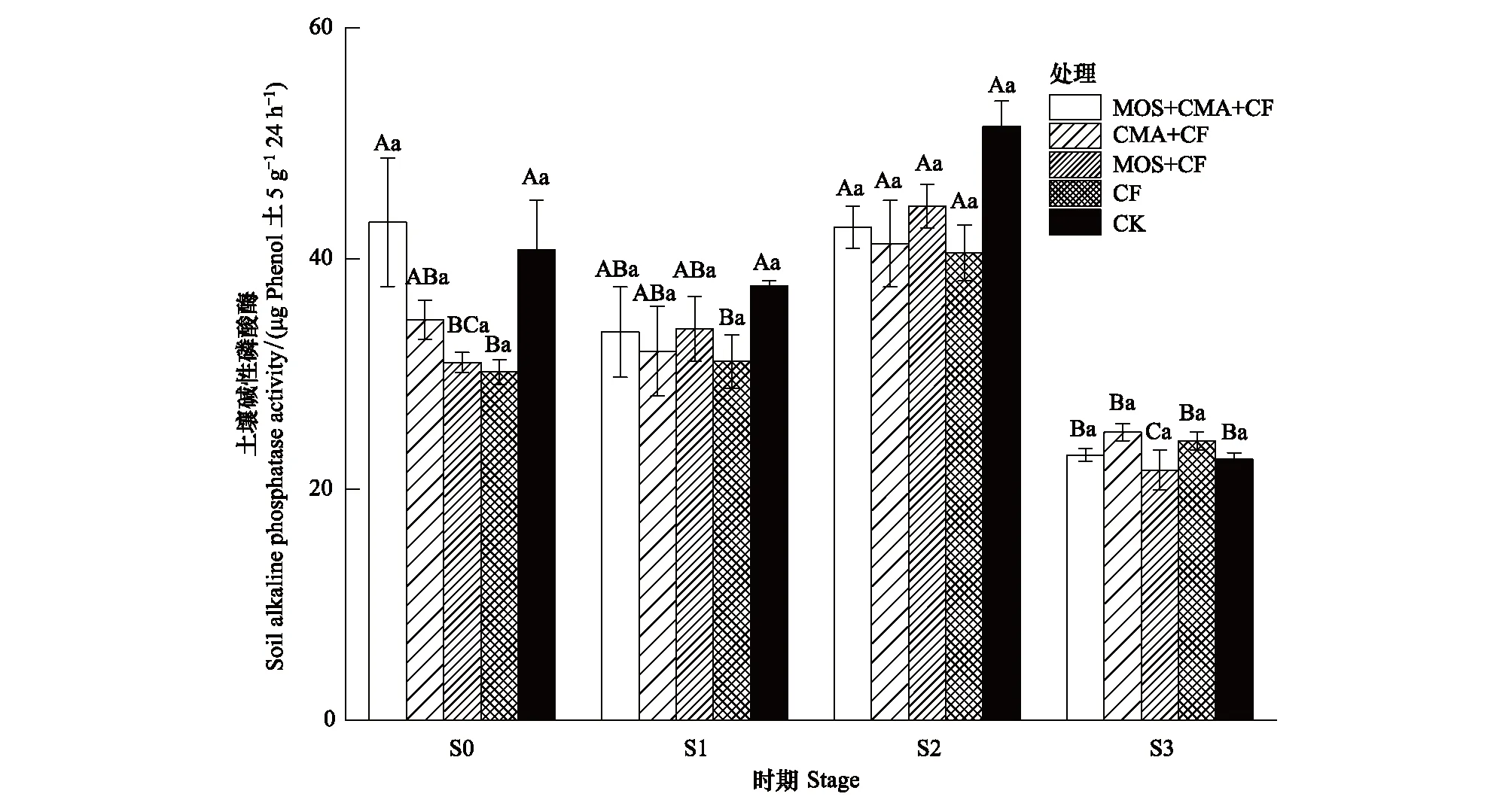
图3 不同处理土壤碱性磷酸酶酶活Fig.3 Soil alkaline phosphatase activity of the different treatments
2.3.4土壤微生物量碳和微生物量氮
土壤微生物量碳在不同小麦生长时期呈先下降后上升的趋势(图4)。S0时期各处理微生物量碳无显著差异;S1时期,MOS+CF处理的微生物量碳含量显著高于CK和CF处理,但与MOS+CMA+CF和CMA+CF之间无显著差异;S2时期,与S1时期相比,整体上所有处理的土壤微生物量碳都出现下降;但MOS+CMA+CF、CMA+CF和MOS+CF处理均显著高于CK和CF,其中MOS+CMA+CF > CMA+CF > MOS+CF;S3时期,与CK和CF相比,MOS+CMA+CF、 CMA+CF和MOS+CF处理的微生物量碳均显著提高,其中CMA+CF处理的微生物量碳含量最高。CF和CK处理的土壤微生物量碳在整个小麦生长时期的土壤微生物量碳含量均较低。
微生物量氮在不同小麦生长时期中呈上升趋势(图4);S3时期,不同处理的土壤微生物量氮含量与S0相比均显著提高,仅CK无显著变化。S2和S3时期,不同处理的MBN含量均有如下顺序:MOS+CMA+CF > CMA+CF > MOS+CF > CF > CK;与CK相比,S3时期的MOS+CMA+CF、CMA+CF和MOS+CF处理分别提高了3.14倍、2.72倍和2.15倍。
2.3.5不同处理土壤微生物多样性的变化情况
DGGE图谱中(图5)可以清晰地看出土壤中的细菌丰度显著高于真菌。根据细菌和真菌条带数目的统计分析显示(图8):S1和S2时期,MOS+CMA+CF和MOS+CF处理的细菌条带数目显著高于CF和CK,但这两个处理之间无显著差异;S2和S3时期,CMA+CF处理的条带数显著低于S1时期;并且S3时期,各处理的细菌条带数无显著差异;此外,在整个小麦生长期间,CK处理土壤细菌DGGE条带和深浅无显著变化。S1时期,CMA+CF的真菌条带数显著高于CK,其他处理的真菌条带数无显著差异;S2时期,CMA+CF和CF处理的真菌条带数显著低于其他处理;S3时期,CMA+CF处理的真菌条带数最少,MOS+CMA+CF和CF的真菌条带数较多。总之,MOS+CMA+CF和CK处理的真菌条带数在整个小麦生长期无显著变化,CMA+CF和MOS+CF处理的真菌条带数在小麦生长后期显著下降。
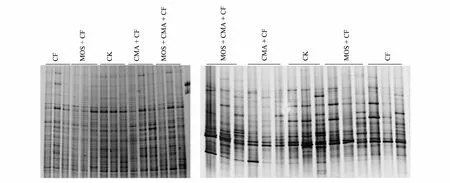
图5 不同处理土壤细菌和真菌DGGE图谱Fig.5 DGGE map of soil bacteria and fungi of the different treatments由于处理较多,时期较多,土壤样品也较多,一张图上无法放满所有重复,为了方便比较分析,将5个处理和3个时期(S1小麦返青期、S2小麦拔节孕穗期、S3小麦成熟期)放在一块胶上,做三块胶,每个样三次生物学重复,选择其中一张作为代表进行分析
接着对细菌和真菌的DGGE图谱进行相似性聚类分析(图6和图7)。真菌(图6)聚类图显示,相同小麦生长期,不同处理之间的真菌相似性较差;而相同处理,不同小麦生长期中的真菌相似性较大,表明导致土壤真菌多样性发生变化的主要原因在于处理不同,不同小麦的生长期对其影响不大。细菌聚类结果与真菌相似的是(图7),相同小麦生长期,不同处理之间的细菌分别属于三个不同分支,而相同处理不同小麦生长期表现为聚集现象,表明不同处理时对土壤细菌多样性变化的影响较大。此外,MOS+CMA+CF和CF处理中土壤细菌组成相似,CMA+CF和MOS+CF处理的土壤细菌组成相似,CK的土壤细菌组成与其他处理均不相似。

图6 真菌DGGE图谱聚类分析Fig.6 DGGE cluster of soil fungi in the test area

图7 细菌DGGE图谱聚类分析Fig.7 DGGE cluster of soil bacteria in the test area

图8 不同小麦生长期各处理真菌、细菌条带数Fig.8 Number of fungi and bacterial bands of all treatments in different wheat growing stages
2.4 不同处理小麦成熟期农艺性状及产量情况
表3显示MOS+CMA+CF和CMA+CF单位面积平均小麦棵数较其他处理显著增加;MOS+CMA+CF 的小麦平均株高也高于其他处理;与CK和CF相比,MOS+CMA+CF和CMA+CF处理的小麦平均穗粒数显著提高。试验区各处理小麦产量顺序为:MOS+CMA+CF > CMA+CF > MOS+CF > CF > CK;与CK相比,MOS+CMA+CF、CMA+CF、MOS+CF和CF 的小麦产量分别提高了149.29%、131.75%、105.58%和87.14%;而与CF相比,CK的产量下降了46.56%,MOS+CMA+CF、CMA+CF和MOS+CF的产量分别提高33.21%、23.84%和9.85%。
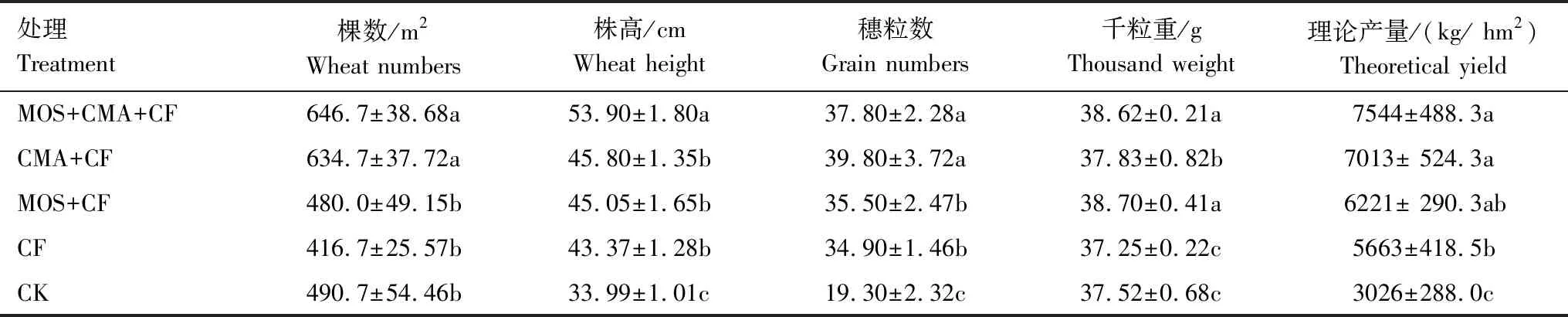
表4 不同处理小麦农艺性状及产量
3 讨论
3.1 不同处理对土壤理化性质的影响
良好的土壤理化状况是土壤肥力提升的重要基础。不同的施肥措施带来的培肥效果也有所差异。王芳[27]等人发现在渭北旱塬耕地上,秸秆中高量还田配施化肥对土壤培肥效果不如秸秆堆肥配施化肥,说明在常规化肥处理下,仅直接进行秸秆还田对于地力提升、提高产量是不够的。在秸秆全量还田的条件下,本文利用能高效降解还田秸秆的复合菌剂与化肥配施,结果表明到小麦成熟期,该处理显著提高了土壤总氮和速效养分含量,这与之前的盆栽研究结果相一致[17],可能由于秸秆中丰富的碳源刺激了土壤微生物活性,加强了土壤微生物对养分的转化[28];但在小麦生长前期,复合菌剂中含丰富的微生物,为了满足自身的生长繁殖,大量消耗了土壤中的即用养分[29],导致小麦生长前期土壤中的养分含量持续偏低。与复合菌剂加速还田秸秆降解不同,土壤改良培肥基质(MOS)中为集中腐熟的混合有机物料,本身有机质含量较高(55%),还含有促进养分转化的有益微生物菌种。与直接还田的秸秆相比,土壤微生物更倾向于优先降解腐熟的有机物料,因此,整个小麦生长期间,MOS+CMA+CF和MOS+CF处理中土壤有机质含量较高。土壤有机质是表征土壤肥力的重要指标,也是土壤培肥的关键[30]。土壤改良培肥基质与复合菌剂联合配施,其土壤速效含量和有机质含量显著高于其他处理,表明该处理能在短期内有效提高土壤有机质含量,能更好地为作物提供速效养分。MOS和CMA中均含丰富的活性微生物,但这两者菌群的主要功能有别:MOS中的微生物主要为固氮、解磷和解钾菌;CMA中的微生物主要是有机物料降解菌。在配施化肥的情况下,复合菌剂优先降解腐熟的有机物料,释放养分的同时通过刺激有机质分解菌群和促进有机质分解酶活性,出现了激发效应[31],因此能够在小麦生长期间有效提高土壤有机质、总磷和速效养分[32]。土壤物理性质的改善对于土壤肥力的提升大有裨益。MOS+CMA+CF、CMA+CF和MOS+CF处理土壤容重均表现出下降趋势,表明土壤开始变得松软。这一结果与土壤孔隙度结果相对应,即CF之外的其他处理土壤空隙度到小麦成熟期均显著提高,只有单独化肥处理的空隙度发生下降,表明长期施用化肥导致土壤板结,这与王娟的研究结果相一致[33]。
3.2 不同处理对土壤酶活和微生物区系的影响
土壤酶主要是由土壤微生物分泌,在催化土壤多种生化反应中扮演重要角色。钱海燕[7]等人研究发现土壤微生物种类和丰度对土壤酶活影响较大,其中细菌丰度主要影响土壤脲酶活性。MOS+CMA+CF处理的土壤脲酶活性显著提高,并且高于其他处理,这可能与该处理中较高的细菌多样性和丰度有关。DGGE图谱显示,CMA+CF处理的真菌条带数在小麦返青期显著高于CK,但在小麦生长后期,该处理土壤中的真菌丰度显著降低,可能是因为复合菌剂中的微生物主要在作物生长早期发挥作用,这与于建光[34]等人的研究结果相一致。小麦生长后期,CMA+CF处理土壤纤维素酶活显著提高,并且土壤微生物量碳含量高于其他处理,表明添加的复合菌剂在前期的生长适应和培育后,在还田秸秆的刺激下能有效降解秸秆并提高土壤微生物活性,增加土壤碳库,具有提高土壤有机碳的潜力[35]。由于MOS和CMA两种产品的功能微生物群存在差异,MOS+CMA+CF处理使整个小麦生长过程中土壤纤维素酶活较低,有研究发现有机肥处理降低了主要秸秆降解细菌门的丰度如厚壁菌门和酸杆菌门[36],这可能是导致联合处理纤维素酶活低于其他处理的原因;而MOS+CMA+CF处理的土壤脲酶活性和土壤微生物量氮含量都是最高的,表明联合处理土壤的养分循环较为活跃。土壤碱性磷酸酶活在各处理之间无显著差异,仅随小麦生长时期变化,这与马晓霞[37]等人的研究结果一致。提高土壤微生物多样性和丰度对于提高土壤肥力至关重要[38]。有研究表明长期化肥处理降低了土壤微生物多样性[39],有机肥通过改变土壤条件而影响细菌群落[32];说明土壤微生物发生改变与不同的施肥措施密切相关,这与本研究的研究结果相一致。由于本文目前仅完成了一季处理,MOS+CMA+CF、CMA+CF和MOS+CF对土壤微生物的改变主要体现在微生物丰度和群落组成的差异上,至于土壤微生物多样性的提高还需要继续进行相同处理再研究。有趣的是,CMA+CF在小麦成熟期的真菌条带数显著低于其他处理,对不同处理小麦赤霉病发病率和呕吐毒素(DON)含量测定结果显示(文中未提供数据),CMA+CF处理的小麦籽粒中呕吐毒素浓度显著低于CK和CF处理,而真菌种类减少可能有利于减轻作物土传病害的发生[40]。
3.3 不同处理对小麦产量影响
有研究表明在施加化肥的基础上增施有机肥或秸秆还田可以提高小麦产量[41],小麦理论产量结果显示,与CF处理相比,MOS+CMA+CF产量提高了33.21%;CMA+CF紧跟其后,提高了23.84%。这可能是由于MOS+CMA+CF处理速效养分高,土壤脲酶活性强,土壤N素的生物转化过程强,环境土壤物理环境提高,土壤微生物丰度提高综合作用的结果[42]。CMA+CF处理的小麦产量仅次于联合处理,由于两种处理均有复合菌剂的添加,表明田间施加复合菌剂,能够通过改善土壤理化状况,提高土壤微生物活性,进而提高了作物产量,这与他人的的研究结果一致[43-44]。MOS+CF处理的小麦产量没有显著高于CF处理的原因可能是MOS中的养分释放需要时间,若长期施用,会有较好的结果[45-46]。
4 结论
总之,从本季田间处理结果来看,土壤改良培肥基质和复合菌剂联合配施对试验区土壤的培肥效果最好。但长期来看,进行技术推广,必要考虑经济效益,此时联合配施的成本太高,收益较低,不利于推广。反观CMA+CF处理,其对试验区土壤的培肥效果在土壤纤维素酶活、土壤微生物量碳以及细菌多样性中优于联合配施,小麦产量与联合配施相比也无显著差异,且复合菌剂用量较少,价格实惠。综上所述,秸秆还田条件下,添加复合菌剂是最优培肥措施,在中低产农田中具有较高的推广价值。

