当归拈痛汤治疗急性痛风性关节炎疗效和作用机制的小鼠实验研究
陈绍华 ,王沁筠 ,吴昌桂 ,赵啸 ,徐浩 ,施杞 ,梁倩倩 *
本研究背景:
急性痛风性关节炎(AGA)并非单一因素致病,多数AGA患者采用常规对症治疗效果不理想且不良反应较多。中药复方以多成分、多靶点作用而在降尿酸、缓解AGA症状等方面具有独特疗效,但具体作用机制尚不完全明确。
本研究创新性:
本研究首次应用C57BL/6雄性小鼠足掌深层跖跗关节周围注射尿酸单钠(MSU)诱导的AGA动物模型而探究当归拈痛汤治疗AGA的疗效和作用机制,初步证实当归拈痛汤可通过多方面作用(抗炎、调节炎性因子的表达、降尿酸)治疗AGA,是能够解决AGA多个核心问题的有效方剂且安全性较高。
本研究局限性:
本研究为小鼠实验,由于目前尚无稳定的高尿酸血症小鼠模型,因此尚不能预估当归拈痛汤对血尿酸的长期控制效果,临床推广尚需进行伦理学审核及大样本量随机对照试验进一步验证。
发生于第一跖趾关节的急性痛风性关节炎(acute gouty arthritis,AGA)是痛风的首要临床表现,男性多发[1-2],通常表现为剧烈疼痛伴红肿[3],呈急性发作性,并会逐步进展为慢性[4-5]。据统计,当前全球痛风患病率为0.1%~10.0%[6];我国男性痛风患病率为1.20%~2.60%,女性痛风患病率为0.01%~0.72%[7-11],近年来我国痛风患病率呈逐年升高趋势。
AGA的发生发展主要涉及以下几个环节:(1)机体尿酸排泄不足引发高尿酸血症[12-13],同时体内浓度较高的尿酸导致尿酸单钠(monosodium urate,MSU)在关节及关节周围沉积;(2)沉积的MSU晶体与驻留的巨噬细胞相互作用而导致NLRP3炎性小体形成、激活;(3)活化的NLRP3炎性小体通过募集胱天蛋白酶1而将促白介素1β加工为成熟的白介素1β(IL-1β)[14],进而通过活化中性粒细胞和肥大细胞放大炎性反应,最终导致一系列炎性因子、趋化因子释放[15]。
对于AGA,若处理不当则可能导致不可逆性组织破坏、骨侵蚀,最终造成关节疼痛、僵硬[2]。目前,临床治疗AGA要求尽快开始消炎止痛、终止急性发作[16],推荐的治疗方案是应用非甾体抗炎药、秋水仙碱及糖皮质激素[17],但上述药物治疗作用单一、长期服用不良反应较大,同时AGA的发生是多种因素作用的结果而非由单一因素所致[1-2],因此消炎止痛并非AGA的最佳治疗方案。对于AGA的治疗,不仅要终止急性炎症发作,还要对尿酸进行有效管理并清除沉积的MSU结晶。中药复方当归拈痛汤是临床治疗湿热蕴结型AGA的常用方剂,但其具体作用机制尚不清楚。本研究为小鼠实验,旨在探讨当归拈痛汤治疗AGA的疗效和作用机制,以期为后续研究提供实验依据。
1 材料与方法
1.1 实验动物 本实验于2020-08-17至2020-10-07实施。2020年8月,笔者所在课题组从上海杰思捷实验动物有限公司购入30只10~12周龄SPF级雄性C57BL/6小鼠,体质量为20~27 g,平均体质量为(24±3)g;实验动物许可证号为SCXK(沪)2018-0004;饲养于上海中医药大学动物房并保证充足的食物和洁净的水。本研究通过上海中医药大学动物伦理委员会审核批准。
1.2 药物、试剂、仪器
1.2.1 药物 当归拈痛汤由羌活15 g、茵陈15 g、猪苓9 g、泽泻9 g、黄芩3 g、苦参6 g、防风9 g、升麻3 g、葛根6 g、白术3 g、苍术6 g、党参6 g、当归9 g、知母9 g、(炙)甘草15 g组成,均购自上海中医药大学附属龙华医院中药房。0.9%氯化钠溶液(安徽双鹤药业有限责任公司,国药准字:H34023609,批号:20010808S,规格:500 ml)购自上海市长宁区天山中医医院药房。
1.2.2 试剂 MSU晶体(Sigma,货号:U2875-25G);磷酸盐缓冲液(PBS)(Servicebio,货号:G0002-2L);尿酸检测试剂盒(微板法)(南京建成生物工程研究所有限公司,货号:C012-2-1);异氟烷(沃瑞德,货号:Batch NO.217140901,规格:100 ml);8分钟RNA快速提取试剂盒(EZBioscience,货号:B0004DP),带gDNA Remover的彩色反转录试剂盒(EZBioscience,货号:A0010CGQ),ROX2 plus彩色实时荧光定量聚合酶链式反应(qPCR)试剂盒(EZBioscience,货号:A0012-R2)。特定基因引物购自华大基因,其中β-actin基因正向引物序列为5'-CGTTGACATCCGTAAAGACC-3',反向引物序列为5'-TAGGAGCCAGAGCAGTAATC-3';IL-1β基因正向引物序列为5'-CTGGTACATCAGCACCTCAC-3',反向引物序列为5'-AGAAACAGTCCAGCCCATAC-3';肿瘤坏死因子α(TNF-α)基因正向引物序列为5'-AGTGACAAGCCTGTAGCCC-3', 反 向 引 物序 列 为5'-GAGGTTGACTTTCTCCTGGTAT-3'; 诱导型一氧化氮合酶(iNOS)基因正向引物序列为5'-AACGGAGAACGTTGGATTTG-3',反向引物序列为5'-CAGCACAAGGGGTTTTCTTC-3'。
1.2.3 仪器 Bio Tek Cytation3细胞成像多功能检测系统,Bio-Rad CFX Connect荧光定量PCR仪,Denovix DS-11超微量紫外可见分光光度计,Thermal cycler block 5020PCR热循环仪,Matrx小动物专用吸入麻醉机,JY88-IIN-超声波细胞粉碎机;Shangping FA1004N电子天平,美耐特高精度电子数字显示游标卡尺,Hamilton 80600微升注射器(100 μl),1 ml无菌注射器(精度10 μl)和灌胃针,Eppendorf微量移液器,Costar96孔酶标板及Bio-Rad 96孔qPCR板等。
1.3 方法
1.3.1 药剂制备方法 按照常规体质量对小鼠(25 g)与人(60 kg)中药剂量进行换算(换算系数为9.01),则小鼠需服中药煎剂浓度为2.56 g/ml。取上述中药1剂,加12倍水浸泡30 min后煮沸,煮沸后继续煎煮30 min,趁热过滤获得煎液1;所余药渣加8倍水,采用同样的煮沸方法而获得煎液2;合并两次煎液并置于通风橱中加热、浓缩至48 ml即为当归拈痛汤中药液,分装后置于-80 ℃冰箱中保存。
1.3.2 动物分组及AGA小鼠模型建立方法 适应性饲养1周后将30只小鼠编号并采用随机数字表法分为对照组、溶剂组和DGNTT组,每组10只。称取MSU晶体30 mg,溶于1.0 ml PBS并置于1.5 ml 微型离心管(EP管)中,充分震荡后使用JY88-IIN-超声波细胞粉碎机(强度25%、运行5 s停10 s)粉碎1 min,使其变为均匀的乳白色MSU悬液(浓度为3%)。使用Hamilton 80600微升注射器在溶剂组和DGNTT组小鼠在双侧足掌深层跖跗关节周围注射MSU悬液,20 μl/次,隔日1次,共注射3次诱导造模;对照组小鼠在双侧足掌深层跖跗关节周围注射PBS,20 μl/次,隔日1次,共注射3次。
1.3.3 治疗方法 三组小鼠于造模完成后同时开始给药,其中对照组和溶剂组小鼠予以0.9%氯化钠溶液灌胃,DGNTT组小鼠予以当归拈痛汤中药液灌胃,均为0.2 ml/次,1次/d;三组小鼠均连续灌胃1周。
1.4 观察指标 (1)体质量:分别于治疗前后测量三组小鼠体质量;(2)足掌厚度增长百分比:注射MSU悬液后6 h通常为AGA小鼠炎性肿胀达到峰值的时间点[18],因此分别于造模前、造模后6 h、治疗后1~7 d固定时间点(每日上午10点)采用美耐特高精度电子数字显示游标卡尺测量小鼠足掌厚度以计算足掌厚度增长百分比,注意选取小鼠足爪肿胀最甚处;(3)IL-1β、TNF-α、iNOS mRNA相对表达量:治疗后7 d取三组小鼠注射足部组织,去皮后采用磁珠研磨,先采用8分钟RNA快速提取试剂盒提取mRNA,再采用ROX2 plus彩色qPCR试剂盒检测IL-1β、TNF-α、iNOS mRNA相对表达量,重复3次取平均值,均严格按照试剂盒说明书进行操作;(4)血尿酸浓度:治疗后7 d摘取三组小鼠眼球并采血约1 ml,静置2 h后采用高速冷冻离心机离心(3 000 r/min、4 ℃)15 min,吸取上层淡黄色血清300~400 μl至新的EP管中并做好标记,放置于-80 ℃冰箱保存,采用尿酸检测试剂盒(微板法)、酶比色法检测血尿酸浓度。
1.5 统计学方法 采用SPSS 24.0统计学软件进行数据分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,组内治疗前后比较采用配对t检验;重复测量数据采用重复测量方差分析。以P<0.05为差异有统计学意义。图的制作采用Graphpad Prism 8.0软件。
2 结果
2.1 体质量 三组小鼠治疗前体质量比较,差异无统计学意义(F=0.988,P=0.386),具有可比性;三组小鼠治疗后体质量比较,差异亦无统计学意义(F=0.534,P=0.592)。三组小鼠治疗后体质量与治疗前比较,差异均无统计学意义(t配对值分别为1.84、1.163、0.714,P值分别为0.10、0.275、0.495),见图1。
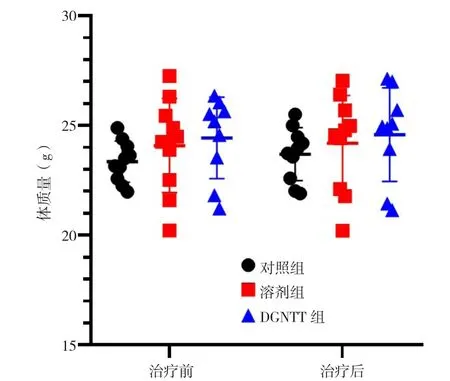
图1 三组小鼠治疗前后体质量比较Figure 1 Comparison of body weight in the three groups of mice before and after treatment
2.2 足掌厚度增长百分比 时间与方法在足掌厚度增长百分比上存在交互作用(F交互=49.83,P交互<0.001);时间、方法在足掌厚度增长百分比上主效应显著(F时间=218.58、P时间<0.001,F方法=332.79、P方法<0.001)。三组小鼠造模后6 h及治疗后1~7 d足掌厚度增长百分比比较,差异有统计学意义(F值分别为 254.53、149.54、113.83、248.63、83.67、239.79、94.85、195.98,P<0.001);溶剂组和DGNTT组小鼠造模后6 h及治疗后1~7 d足掌厚度增长百分比大于对照组,DGNTT组小鼠造模后6 h及治疗后1~5 d、7 d足掌厚度增长百分比小于溶剂组,差异有统计学意义(P<0.05),见图2~3。
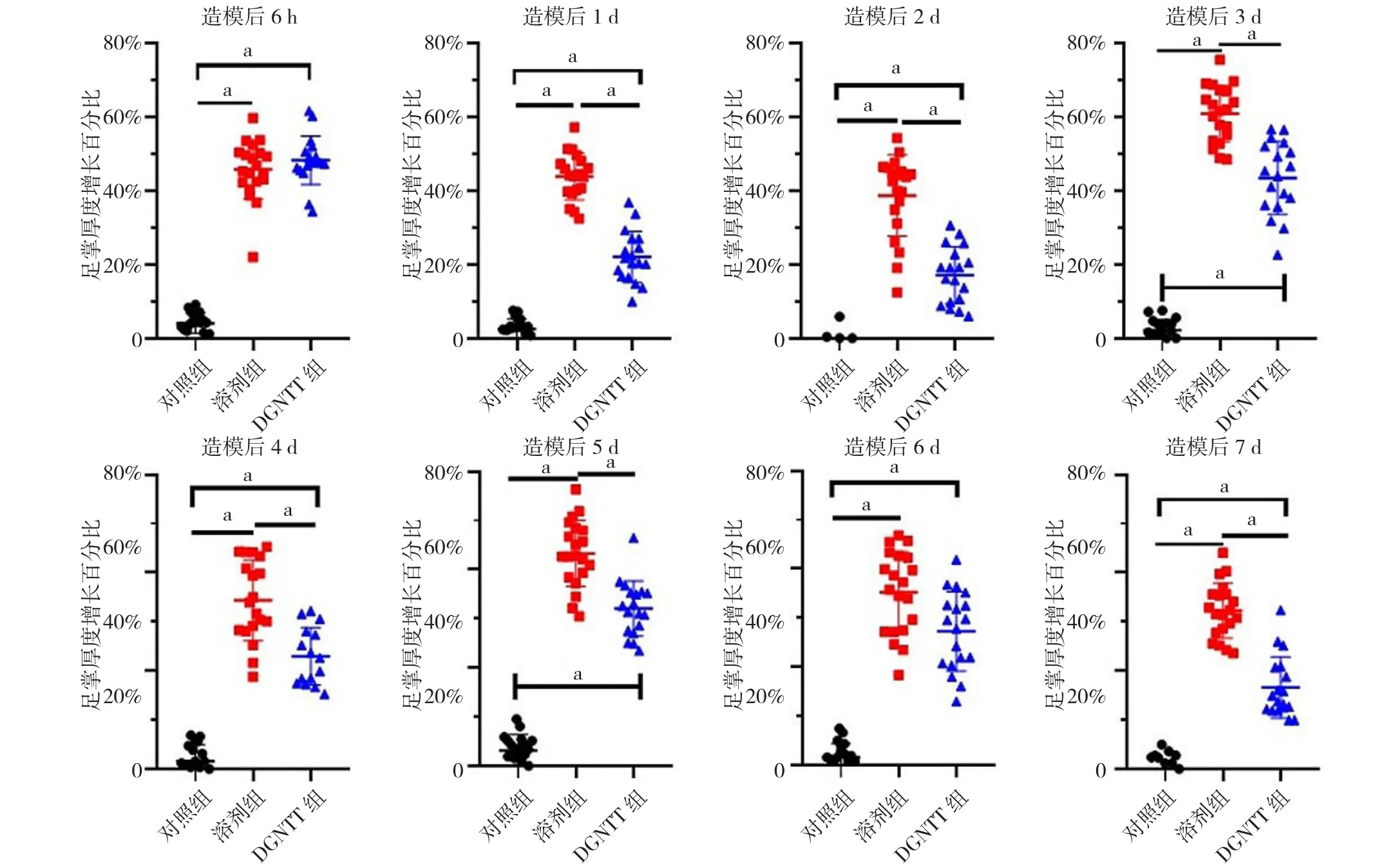
图2 三组小鼠造模后6 h及治疗后1~7 d足掌厚度增长百分比比较Figure 2 Comparison of increased percentage of hind paws thickness in the three groups of mice 6 hours after modeling and 1 to 7 days after treatment
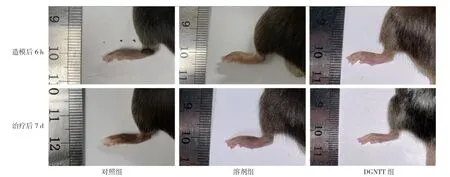
图3 三组小鼠造模后6 h及治疗后7 d足爪肿胀的典型图片Figure 3 Typical pictures of hind paw swelling 6 hours after modeling and 7 days after treatment in the three groups of mice
2.3 IL-1β、TNF-α、iNOS mRNA相对表达量 三组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量比较,差异有统计学意义(F值分别为55.97、341.63、340.88,P<0.001);溶剂组和DGNTT组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量高于对照组(P<0.01),DGNTT组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量低于溶剂组,差异有统计学意义(P<0.01),见图4。

图4 三组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量比较Figure 4 Comparison of relative mRNA expression quantities of IL-1β,TNF-α and iNOS in the injected hind paw tissues in the three groups of mice 7 days after treatment
2.4 血尿酸浓度 三组小鼠治疗后7 d血尿酸浓度比较,差异有统计学意义(F=23.11,P=0.002);DGNTT组小鼠治疗后7 d血尿酸浓度低于对照组、溶剂组,差异有统计学意义(P值分别为0.001、0.003),而对照组与溶剂组小鼠治疗后7 d血尿酸浓度比较,差异无统计学意义(P=0.154),见图5。
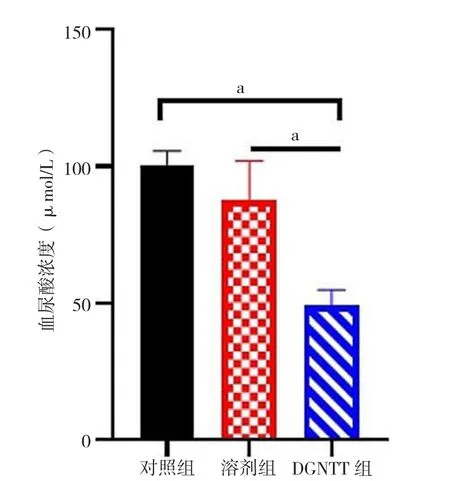
图5 三组小鼠治疗后7 d血尿酸浓度比较Figure 5 Comparison of serum uric acid concentration in the three groups of mice 7 days after treatment
3 讨论
中医学理论认为,AGA属“痹证”范畴,又称“历节”或“白虎历节”,其病因病机为先天禀赋不足,或后天调摄不慎、饮食不节、恣饮琼浆或嗜肥甘无度,或伤于情志饮食致使脾胃功能失调、肾精损伤,加之外感风、寒、湿三气而为病;AGA急性发作期以湿热蕴结型为主[19-20]。当归拈痛汤源自《医学启源》,是清热利湿、疏风清热的代表方,“治湿热为病,肢节烦痛……遍身疼,下注于胫,肿痛不可忍”,方中羌活胜湿透关利节、防风温散经络中湿邪为君药;升麻、葛根引阴中之阳上行而升散,白术和中除湿,苍术去皮肤腠理之湿,为臣药;当归活血散瘀止痛,党参、(炙)甘草补脾益气护胃,苦参、黄芩、知母、茵陈泄湿热、除肢节烦痛,猪苓、泽泻渗湿化饮,共为佐药;(炙)甘草兼调和诸药而为使。临床研究发现,当归拈痛汤是治疗湿热内蕴型AGA的验方,可有效减轻急性炎性反应,疗效与塞来昔布、秋水仙碱相当[21-22]。
现代药理学研究表明,泽泻能降低大鼠血尿酸浓度,其作用机制可能与抑制黄嘌呤氧化酶(XOD)活性、减轻肾脏损伤、下调肾脏中肾脏尿酸盐转运体1的表达有关[23];葛根有效成分葛根素不仅可通过调节免疫细胞、炎性因子、信号通路等发挥抗炎作用,还可通过抑制XOD活性、促进尿酸排泄而降低血尿酸浓度,具有抗AGA作用[24];黄芩有效成分黄芩苷可有效抑制大鼠的XOD活性[25]。
目前,MSU混悬液局部注射诱导是研究AGA最常用的动物造模方法[26],大鼠、鸡、家兔是研究AGA最常用的造模动物。为寻找更为经济和理想的AGA动物模型,笔者所在课题组结合国外文献[18,27]而尝试建立了C57BL/6雄性小鼠足掌深层跖跗关节周围注射MSU混悬液诱导的AGA动物模型,并已证实其外在体征、发病机制、病理改变等与人AGA相似[28]。本研究首次应用上述模型探究当归拈痛汤治疗AGA的疗效和作用机制,结果显示:溶剂组和DGNTT组小鼠造模后6 h及治疗后1~7 d足掌厚度增长百分比大于对照组,DGNTT组小鼠造模后6 h及治疗后1~5 d、7 d足掌厚度增长百分比小于溶剂组,溶剂组和DGNTT组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量高于对照组,DGNTT组小鼠治疗后7 d注射足部组织IL-1β、TNF-α、iNOS mRNA相对表达量低于溶剂组,DGNTT组小鼠治疗后7 d血尿酸浓度低于对照组、溶剂组,表明当归拈痛汤可有效缓解AGA小鼠足爪炎性肿胀程度,下调炎性因子IL-1β、TNF-α、iNOS mRNA的表达,降低血尿酸浓度。此外,本研究还对三组小鼠治疗前后体质量进行了组间和组内比较,但均未发现显著差异,提示造模方法及当归拈痛汤对小鼠体质量无明显影响,安全、可行。因此,笔者认为当归拈痛汤可通过多方面作用(抗炎、调节炎性因子的表达、降尿酸)治疗AGA,是能够解决AGA多个核心问题的有效方剂且安全性较高。
作者贡献:陈绍华负责实验动物的饲养与处理,数据分析,论文撰写与修改;陈绍华、梁倩倩对文章整体负责,监督管理;王沁筠、吴昌桂、赵啸负责实验动物取材、观察指标测定、数据整理;徐浩负责图像采集;施杞、梁倩倩负责研究的设计与可行性分析。
本文无利益冲突。

