PI3K/Akt通路在内吗啡肽-1后处理减轻大鼠心肌缺血再灌注损伤中的作用
吴胜男,张 露,樊红莲,黄艳平,宗巧凤,高 琴,李正红
蚌埠医学院1生理教研室,2药学院,3科研中心,安徽 蚌埠 233030
心肌缺血再灌注损伤(MIRI)是缺血性心脏病冠状动脉血流恢复后心肌和心室功能障碍的主要原因,并导致心肌梗死死亡率显著增加[1]。MIRI的发生机制非常复杂,包括能量缺乏、自由基的产生、炎性细胞浸润、细胞凋亡和钙超载等[2]。研究表明一些经典的阿片类药物(如舒芬太尼[3]、氢吗啡酮[4]等)在心肌缺血再灌注损伤中存在心肌保护作用,内吗啡肽-1(EM-1)作为一种能与μ阿片受体特异性结合的激动剂,具有降低大鼠血压[5]、改善心功能和保护大鼠MIRI心肌的作用[6-7]。再灌注损伤补救激酶通路(RISK)[8]对MIRI具有心肌保护作用,包括细胞外调节蛋白激酶通路(ERK1/2)和磷脂酰肌醇-3-激酶/蛋白激酶B(PI3K/Akt)通路,其中的PI3K/Akt通路参与调控细胞多种生物学活动,如生存、增殖和凋亡等[9],并且在各种药物对MIRI的心肌保护作用中起着重要作用,如舒芬太尼[3]、氢吗啡酮[4]、他克莫司[10]和川陈皮素[11]等。EM-1 通过作用μ阿片受体激活PI3K/Akt 通路,对脂多糖诱导的肺损伤有保护作用[12]。但目前尚不清楚的是,PI3K/Akt通路是否介导EM-1的心肌保护作用,以及EM-1能否通过激活该通路产生抗细胞凋亡效应,为探求基础和临床保护再灌注损伤心肌的新靶点,需要我们进一步研究。
本研究通过构建大鼠MIRI模型并静脉注射EM-1和PI3K/Akt信号通路抑制剂渥曼青霉素(Wort),检测大鼠血流动力学指标心率(HR)和平均动脉压(MAP)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、心肌肌钙蛋白I(cTnI)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α),氧化应激指标超氧化物歧化酶(SOD)和丙二醛(MDA),RT-PCR检测Bax和Bcl-2基因的表达情况,Western blot检测各处理组大鼠心肌组织中磷酸化Akt蛋白和凋亡相关蛋白cleaved caspase-3的表达水平,以探究PI3K/Akt信号通路是否介导EM-1对心肌缺血再灌注损伤的保护作用以及对细胞凋亡的影响。
1 材料和方法
1.1 实验动物及分组
SPF 级SD(Sprague-Dawley)雄性大鼠,体质量250~350 g。购自蚌埠医学院实验动物中心,动物证书编号:SCXK(苏)2017-0001。50只SD雄性大鼠随机分为5组:假手术组(S组)、缺血再灌注组(IR组)、内吗啡肽-1 50 μg/kg 后处理组(EM50 组)、内吗啡肽-1 50 μg/kg+Wort 15 μg/kg后处理组(EM50+Wort组)、渥曼青霉素15 μg/kg后处理组(Wort组),S组在冠状动脉左前降支(LAD)下只穿丝线不结扎维持150 min。其余4组LAD均结扎缺血30 min后再灌注120 min,于再灌注前5 min,分别静脉注射生理盐水0.5 mL、内吗啡肽-1(50 μg/kg)、内吗啡肽-1(50 μg/kg)+渥曼青霉素(15 μg/kg)和渥曼青霉素(15 μg/kg)。
1.2 主要试剂和仪器
试剂:内吗啡肽-1(Sigma);渥曼青霉素(Sigma);肝素钠注射液(天津生化);LDH、MDA和SOD试剂盒(南京建成);CK-MB、cTnI、TNF-α、IL-6酶联免疫分析试剂盒(苏州卡尔文);HRP标记的羊抗兔IgG、HRP 标记的羊抗小鼠IgG(Affinity);小鼠抗大鼠β-actin抗体、兔抗大鼠Cleaved Caspase-3抗体、兔抗大鼠Akt 抗体、兔抗大鼠p-Akt 抗体(Cell Signaling Technology)。
仪器:动物呼吸机(上海奥尔MED-LAB ALCV9);生物信号采集处理系统(南京美易MED-LABU/4C501H);Gel DocTMXR+凝胶成像系统(Bio-Rad);Synergy2多功能酶标仪(Bio-Tek)。
1.3 实验方法
1.3.1 复制在体大鼠MIRI模型 参照Zhang等[4]的方法建立大鼠MIRI模型。结扎LAD后,心电图中显示的ST-T段升高表示造模成功。
1.3.2 测定血流动力学指标 通过MED-LABU/4C501H生物信号采集处理系统,术中持续监测大鼠HR和MAP参数并记录,根据公式:心率-血压乘积(RPP)=HR×MAP,记录各组数据并进行统计学分析。
1.3.3 测定血浆心肌酶、氧化应激指标和炎症因子 再灌注后,经颈总动脉取血置于肝素化抗凝离心管内,3000 r/min,4 ℃离心15 min,严格按照试剂盒说明书测定LDH和SOD的活性及MDA、IL-6、TNF-α、CK-MB和cTnI的含量。
1.3.4 RT-PCR检测Bax、Bcl-2的表达水平 称取0.1 g心肌缺血组织提取总RNA,经逆转录合成cDNA。以合成的cDNA 为模板进行PCR,引物序列参考以下:Bax(464 bp),forward:5'-GGATCGAGCAGAGAGGATG G-3',reverse:5'-TGGTGAGTGAGGCAGTGAGG-3';Bcl-2(228 bp),forward:5'-CTGGTGGACAACATCG CTCTG-3',reverse:5'-GGTCTGCTGACCTCACTTG T-3';β-actin(632 bp):forward:5'-GATGGTGGGTATG GGTCAGAAGGAC-3',reverse:5'-GCTCATTGCCGA TAGTGATGACT-3'。PCR 仪上扩增(95 ℃预变性3 min,95 ℃变性50 s;β-actin:59.4 ℃,Bax:64.5 ℃,Bcl-2:61.5 ℃退火50 s;72 ℃延伸60 s;30个循环后,72 ℃平衡10 min,4 ℃保温)。琼脂糖凝胶电泳后于凝胶成像处理系统进行成像,使用图像分析软件进行灰度扫描以进行半定量分析。表达的半定量值为Bax/β-actin 与Bcl-2/β-actin。
1.3.5 Western blot检测PI3K/Akt、cleaved caspase-3蛋白的表达 称取0.1 g缺血区心肌组织加入1 mL蛋白提取液,在冰上彻底研磨30 min,4 ℃离心15 min,12 000 r/min,收集上清液并测定浓度。上样40 μg蛋白,经电泳后半干转法转膜,用5%脱脂奶粉封闭液室温封闭2 h。一抗稀释后,37 ℃进行孵育30 min,60 r/min 摇床30 min,4 ℃过夜,第2天取出膜,TBST洗涤4次,10 min/次,加入二抗37 ℃孵育60 min,100 r/min 摇床30 min,TBST洗涤4次,10 min/次,浸入显影剂曝光,统计分析灰度值。
1.4 统计学方法
使用SPSS 23.0对所有实验数据进行统计学分析,结果以均值±标准差表示。单因素方差分析(one-way ANOVA)用于组间比较,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血流动力学的变化
HR和MAP反映了大鼠心脏的基本功能,所有大鼠基线时期的基础值无显著差异(P>0.05);与S组相比,IR组、EM50+Wort组和Wort组HR、MAP、RPP均降低(P<0.05);与IR组相比,EM50组HR、MAP、RPP基本都有所升高(P<0.05);与EM50 组比较,EM50+Wort 组HR、MAP、RPP有所下降(P<0.05,图1)。
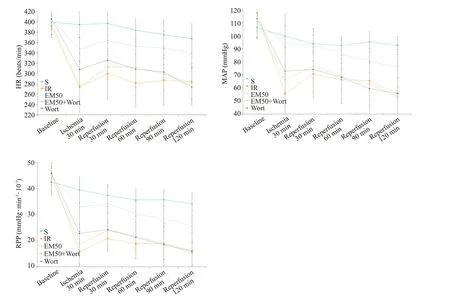
图1 各处理组对大鼠血流动力学的影响Fig.1 Effects of different treatments on hemodynamics of the rats(Mean±SD,n=10).
2.2 EM-1对血浆SOD活性和MDA含量的作用
血浆SOD和MDA反映了大鼠的抗氧化能力。与S 组相比,IR 组大鼠血浆SOD 活性显著降低,MDA含量升高(P<0.05);与IR组相比,EM50组SOD活性升高,MDA 含量降低(P<0.05,图2);与EM50 组相比,EM50+Wort 组和Wort 组SOD 活性降低,MDA 含量升高(P<0.05)。
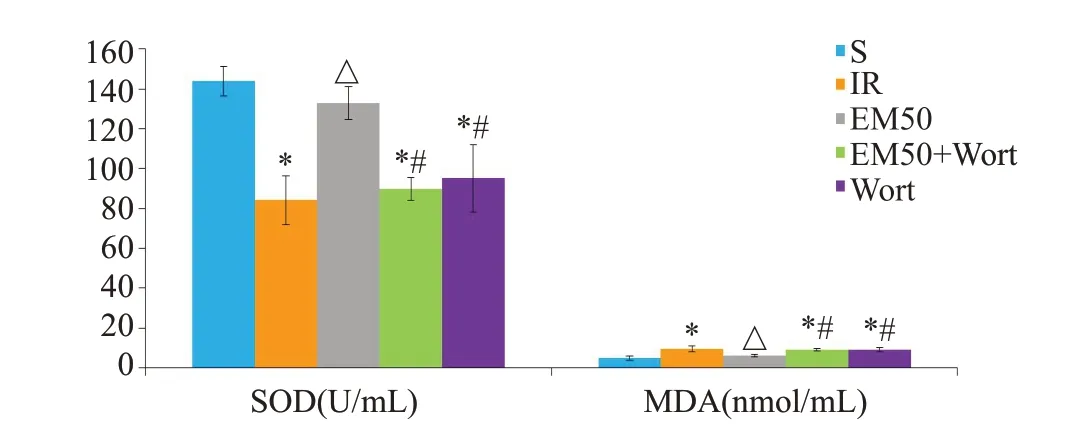
图2 各处理组大鼠血浆SOD和MDA的变化Fig.2 Changes of plasma SOD activity and MDA content in rats with different treatments (Mean±SD,n=10).*P<0.05 vs S group;△P<0.05 vs IR group;#P<0.05 vs EM50 group.
2.3 各组MIRI大鼠心肌酶谱的变化
结果显示,EM50组的LDH活性、CK-MB和cTnI含量显著低于IR组、EM50+Wort组和Wort组(P<0.05,图3)。
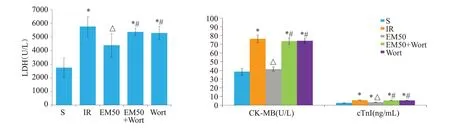
图3 各处理组大鼠血浆LDH、CK-MB、cTnI的含量或活性Fig.3 Plasma levels of LDH,CK-MB,and cTnI in different groups(Mean±SD,n=10).*P<0.05 vs S group;△P<0.05 vs IR group;#P<0.05 vs EM50 group.
2.4 EM-1对MIRI大鼠血浆IL-6和TNF-α含量的影响
结果表明,EM50组血浆中IL-6和TNF-α含量明显低于IR组、EM50+Wort组和Wort组(P<0.05,图4)。
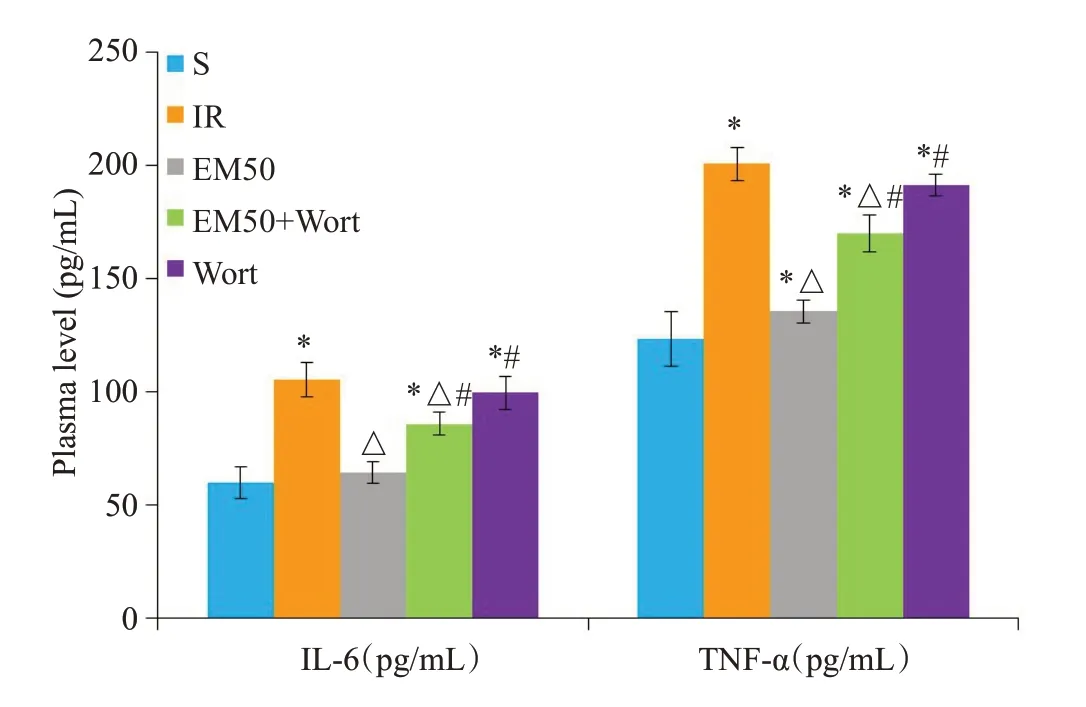
图4 各处理组大鼠IL-6和TNF-α的血浆浓度Fig.4 Plasma levels of IL-6 and TNF-α in different groups(Mean±SD,n=10).*P<0.05 vs S group;△P<0.05 vs IR group;#P<0.05 vs EM50 group.
2.5 EM-1对MIRI大鼠cleaved caspase-3、Bax和Bcl-2的影响
与IR组、EM50+Wort组和Wort组相比,EM50组心肌组织中cleaved caspase-3 的表达明显降低(P<0.05,图5)。RT-PCR的实验结果显示(图6),与IR组比较,EM50 组Bcl-2、Bcl-2/Bax 的比例明显增加(P<0.05),Bax明显降低(P<0.05);与EM50组比较,EM50+Wort 组和Wort 组Bcl-2、Bcl-2/Bax 的比例明显降低(P<0.05),Bax明显增加(P<0.05,图6)。
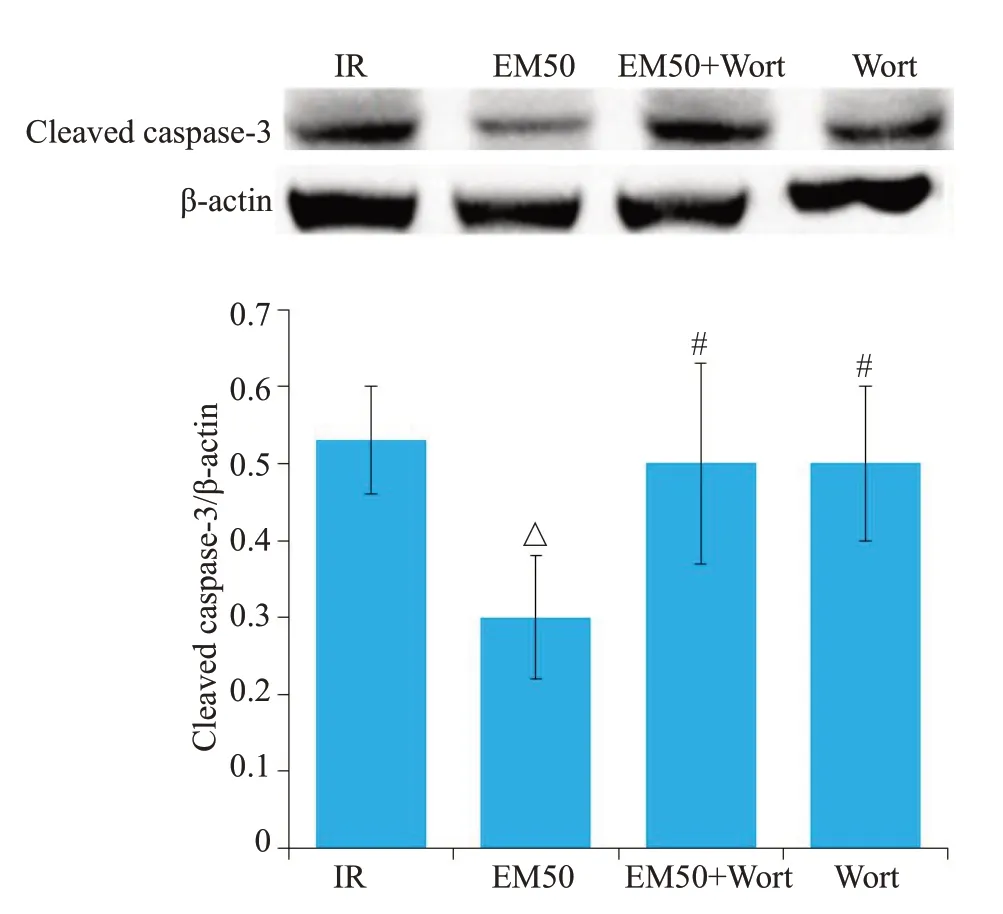
图5 各处理组大鼠心肌中Cleaved caspase-3蛋白的表达情况Fig.5 Expression of cleaved caspase-3 protein in different groups (Mean±SD,n=10).△P<0.05 vs IR group;#P<0.05 vs EM50 group.
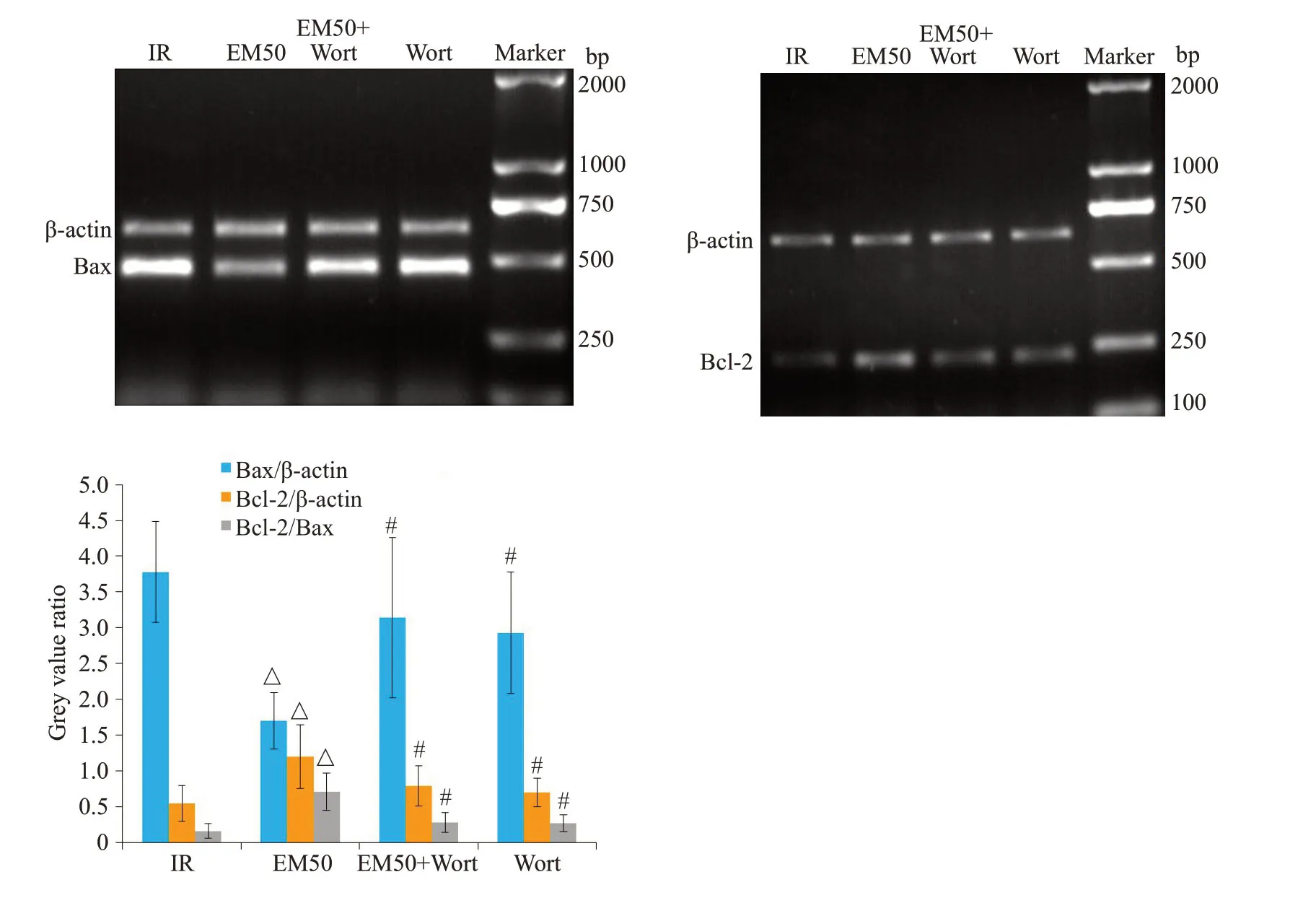
图6 各处理组大鼠心肌中基因Bax和Bcl-2表达情况Fig.6 Expression of Bax and Bcl-2 mRNA in different groups(Mean±SD,n=10).△P<0.05 vs IR group;#P<0.05 vs EM50 group.
2.6 EM-1对大鼠MIRI心肌组织p-Akt蛋白表达水平的影响
与IR组相比,EM50组p-Akt蛋白的表达升高(P<0.05)。与EM50 组相比,EM50+Wort 组和Wort 组p-Akt蛋白表达较低(P<0.05,图7)。
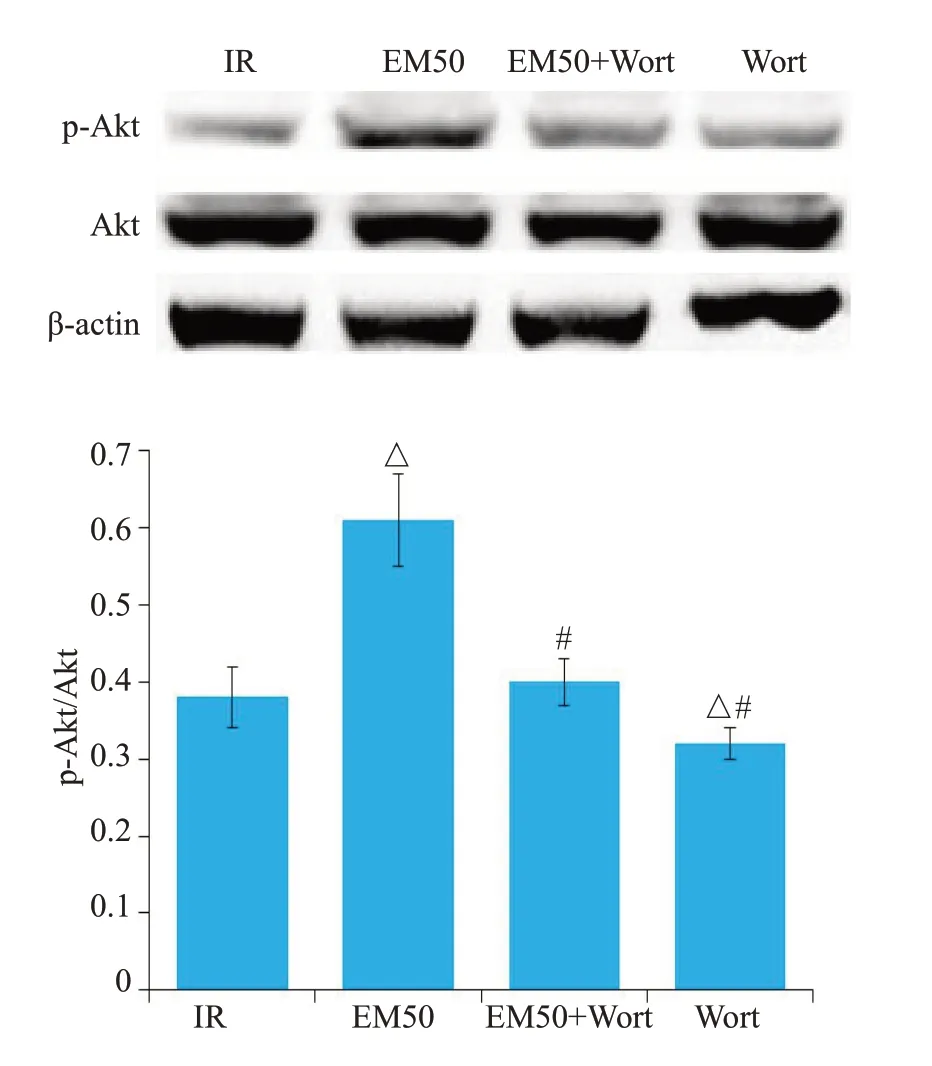
图7 各处理组大鼠心肌组织中p-Akt的表达Fig.7 Expression of p-Akt in the myocardial tissue of the rats in different groups(Mean±SD,n=10).△P<0.05 vs IR group;#P<0.05 vs EM50 group.
3 讨论
EM-1对μ阿片受体具有高选择性高亲和力,在镇痛、炎症[16]等方面发挥重要功能,但对心肌损伤的保护作用及机制研究尚不完善。我们前期的实验已证实,EM-1激活了体内的ERK1/2途径,抑制了线粒体通透性转换孔开放,减轻大鼠MIRI[6-7]。众所周知,RISK通路由ERK和PI3K/Akt二者组成,后者是一类位于细胞内调节多种因子的酶家族,Akt处在PI3K的下游,是该通路发挥生物作用的关键。而PI3K/Akt通路是否参与了EM-1后处理对大鼠MIRI的保护作用尚未见报道。本研究通过复制在体大鼠心肌IR模型,给予PI3K/Akt通路抑制剂预处理,观察EM-1后处理对MIRI的影响,探讨PI3K/Akt通路在EM-1后处理对MIRI的作用。结果表明,与IR组相比,EM50组大鼠的心功能部分恢复,血浆心肌酶浓度降低,氧化应激和炎症反应减弱。提示EM-1对MIRI有一定的保护作用,此结果与王娅[6],黄艳平[7]结果一致。当心肌缺血再灌注时,心肌细胞膜破裂,LDH和CK-MB释放入血,二者的浓度随时间不同程度地增加[14],而cTnI是一种非常敏感的酶,只在心肌组织中表达,其增加与心肌受损程度成正比,是心肌损害的“黄金标准”[15]。但使用抑制剂Wort后,与EM50组相比,EM50+Wort组HR、MAP和RPP的改善减弱,心肌酶LDH、CK-MB 和cTnI 的浓度或活性增加,IL-6、TNF-α和MDA水平升高,SOD活性降低,提示EM-1对大鼠MIRI的保护作用可能与PI3K/Akt通路有关。
PI3K/Akt信号通路是细胞内经典的保护通路,在多种脏器IR损伤的保护中发挥着不可替代的作用,其作用机制一方面是激活细胞内的抗凋亡信号通路,另一方面是抑制促凋亡信号通路[17-19]。Akt位于PI3K/Akt途径的中心,是最重要的PI3K下游靶酶[20],心肌保护作用的机制部分依赖于Akt蛋白的磷酸化[21]。当PI3K被激活时,PI3K将磷脂酰肌醇4,5-二磷酸转化成磷脂酰肌醇3,4,5-三磷酸,从而募集磷酸肌醇依赖性激酶1和磷酸化苏氨酸308(Thr308)[22],Akt蛋白被激活成为p-Akt,磷酸化Akt进一步与多种凋亡和生存相关的调节因子相互作用,从而促进细胞存活和抑制细胞凋亡[23-24]。细胞凋亡本质上是一种程序性细胞死亡,于心肌梗塞发作后不久开始并随着再灌注过程进一步加重[25]。Bcl-2作为Bcl-2家族成员之一,能抑制多种毒素诱发的细胞凋亡而维持细胞存活。相反,Bax基因虽然与Bcl-2基因具有21%的氨基酸同源性,但其拮抗Bcl-2,激活后促进细胞凋亡。依据细胞内Bcl-2/Bax的比例高低[26]能反映凋亡的发生情况[27]。Cleaved caspase-3是caspase家族中的关键蛋白酶,其产生标志着细胞凋亡的发生[28]。实验结果表明,与IR组相比,EM50组p-Akt和Bcl-2的表达上调,Cleaved caspase-3和Bax表达降低,Bcl-2/Bax比例显著升高;与EM50组相比,EM50+Wort组Bcl-2表达降低,Cleaved caspase-3和Bax表达增加,Bcl-2/Bax比例减低,p-Akt蛋白的表达降低。推测EM-1后处理可能通过PI3K/Akt信号通路调节细胞凋亡因子,抑制细胞凋亡,减轻MIRI。
PI3K/Akt不仅与经典的凋亡途径有直接关联,如Bcl-2家族和caspase家族,还参与调节许多凋亡相关的信号分子和细胞器,比如HIF-1α、eNOS、Nrf2和内质网等[29]。文献报道多种药物减轻大鼠MIRI的作用都有PI3K/Akt/eNOS信号通路的参与[30-31],我们推测EM-1也可能是通过激活PI3K/Akt/eNOS 信号通路,上调p-Akt,进而调控其下游靶标分子的表达,减轻MIRI。但EM-1激活PI3K/Akt的下游机制仍需进一步探索。
总之,EM-1 后处理可减少心肌细胞凋亡,减轻MIRI,而PI3K/Akt信号通路可能在EM-1产生的心肌保护效应中发挥了一定的介导作用。