外泌体在乳腺癌微环境中的研究进展
李康迪,李文化
1. 武汉大学生命科学学院(武汉 430072)
2. 细胞稳态湖北省重点实验室(武汉 430072)
乳腺癌是影响女性健康的重大疾病。在2018年全球癌症的发病率和死亡率排名中,乳腺癌分别高居第二和第五位,而在女性癌症患者中,乳腺癌是最常见的癌症类型,全球范围内四分之一的女性新发癌症病例均为乳腺癌[1]。国家癌症中心新发布的2019年全国癌症报告显示,在2014年及2015年我国女性癌症患者中乳腺癌的发病率分别为16.5%和17.1%,均高居第一。研究表明,乳腺癌微环境中的外泌体在乳腺癌的发生发展过程中起着关键作用。本文将对外泌体在乳腺癌微环境中的研究进展进行综述。
1 乳腺癌微环境概述
肿瘤微环境(tumor microenvironment,TME)又被称为癌症微环境,它是肿瘤进展过程中由一群复杂且动态变化的细胞群和非细胞组分共同形成的。对于乳腺癌来说,除了癌细胞以外,其他的细胞组分包括成纤维细胞、癌症干细胞、巨噬细胞、脂肪细胞、内皮细胞等,而非细胞组分则包括细胞外基质和一些细胞因子等(图1)[2-3]。在发生乳腺癌的转移时,首先原发位点要有一个适合癌细胞转移的微环境,以利于癌细胞脱离原位。其次,癌细胞在转移到新的次级生长位点时,这里会形成一个利于癌细胞生长的转移前生态位,这个生态位事实上也是一个适合癌细胞生长的微环境,可见乳腺癌微环境的存在对癌细胞本身的进展十分重要。具体来说,肿瘤相关巨噬细胞通过分泌大量促肿瘤原性蛋白、细胞因子和生长因子支持原发性肿瘤生长、血管生成和侵袭,随着肿瘤的生长,免疫抑制细胞被激活,通过抑制T淋巴和B淋巴细胞的增殖和活化或抑制自然杀伤细胞的细胞毒性帮助肿瘤细胞逃避这些免疫细胞的监视和杀伤[4]。肿瘤微环境中的血管内皮细胞则能通过构建微环境内的新生血管使肿瘤细胞免受缺氧损害,同时也能帮助构建淋巴管以利于肿瘤细胞的转移[5]。肿瘤微环境中的细胞外基质如胶原蛋白和纤连蛋白也能够通过其他细胞分泌的一些酶或整连蛋白而改变自身的收缩力或结构以支撑癌细胞的运动(图1)[6-7]。
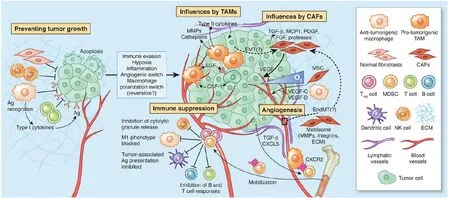
图1 肿瘤微环境的组分[7]Figure 1. Components of the tumor microenvironment[7]
事实上,乳腺癌微环境和乳腺癌细胞本身是相互促进、共同发展的,癌细胞也能够主动改造微环境以适应自身生长,比如产生包括FGF、VEGF、PDGF、TGFβ在内的细胞因子和蛋白酶来改造微环境的细胞组分,产生细胞外基质组分来改造细胞外基质,甚至是诱导血管生成(图2)[8-10]。具体来说,乳腺癌干细胞能够分泌Shh到癌症相关的成纤维细胞中促进其增殖,反过来,癌症相关的成纤维细胞又能够分泌促进乳腺癌干细胞增殖和自我更新的细胞因子[11]。
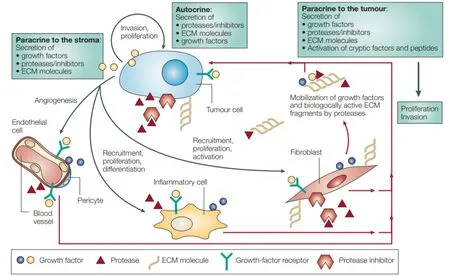
图2 癌细胞对肿瘤微环境的重塑作用[10]Figure 2. The remodeling effect of cancer cells on the tumor microenvironment[10]
大量研究表明,乳腺癌微环境各细胞之间的通讯主要由细胞外细胞因子和外泌体介导的旁分泌信号来完成[12-14],大多数情况下,乳腺癌微环境的细胞组分可以通过旁分泌信号调控癌症进展,例如调节乳腺癌细胞的增殖、上皮间充质转化、干性和化学耐药性[15]。
2 外泌体概述
自2011年György首次将封闭的脂质双层膜的胞外结构定义为细胞外囊泡以来[16],对于细胞外囊泡的认识越来越清晰。细胞外囊泡主要包括凋亡小体、微囊泡和外泌体,这三者在粒径、释放途径以及包涵物上有很大区别[17],因此根据细胞外囊泡的区别,可通过差速离心设定不同的离心力和离心时间来分离不同的细胞外囊泡。另外,无论是真核生物还是原核生物,几乎所有的细胞都能分泌细胞外囊泡[18]。细胞外囊泡能够通过出芽或内吞的形式参与多囊泡结构与质膜的融合中,导致内腔囊泡向胞外的释放,从而产生一种细胞外囊泡的亚型——外泌体[19],其中RAB27A蛋白很大程度上控制了外泌体向胞外释放[20]。外泌体广泛分布于外周血、唾液、尿液、腹水、胸腔积液、母乳和其他体液中[21],其粒径大小一般在40 ~160 nm之间,为茶托状结构,沉降离心力为100 000 g,在蔗糖中的密度为1.13 ~1.19 g /mL,其膜上有着标志蛋白CD81、CD9、CD63等。外泌体中包含着许多细胞成分,主要包括DNA、RNA、蛋白质、脂质等,同时TSG101、Alix也是其特征蛋白(图3)[18]。根据外泌体上述特征,可通过超速离心结合蔗糖密度梯度离心的方法分离到较为纯净的外泌体,并通过电镜观察鉴定分离到的外泌体[22]。细胞分泌外泌体最初被认为是向外排出不必要的细胞成分以维持细胞内环境的稳定性[23-24],然而近年大量研究报道外泌体参与了细胞间的通讯以及多种疾病的发生、发展[25-26]。外泌体通过表面分子如整合素靶向受体细胞,与靶细胞结合后,可通过受体-配体相互作用诱导细胞内信号传导,或被靶细胞内吞,又或者与靶细胞的膜融合以将其内容物传递至其胞质从而达到信息传递的目的[27-28]。
3 外泌体在乳腺癌微环境中的作用
外泌体几乎存在于所有类型的细胞且广泛分布于各种体液中,极大程度参与了细胞间的通讯,为其在肿瘤微环境的重要作用奠定了基础。大量研究报道,外泌体在肿瘤微环境中参与细胞存活、细胞转移、细胞代谢重组以及血管生成等(图3)[18]。具体来说,外泌体能通过运输MMPs对细胞外基质进行重塑[29],也能通过纤连蛋白与整合素帮助癌细胞的粘附和提高其迁移速度[30]。其次,从乳腺癌干细胞中释放的外泌体能影响附近乳腺癌细胞中的信号转导并促进乳腺癌细胞的干性[21]。乳腺癌细胞分泌的miR-105通过外泌体破坏血管内皮屏障以促进自身的转移[31]。胰腺癌细胞的外泌体会迁移到远处的器官,帮助形成富含TGFβ、纤连蛋白和趋化因子的转移前生态位[32]。此外,最新研究表明,肿瘤微环境中的多种细胞都能够分泌表达PDL1的外泌体参与到肿瘤免疫逃逸中[33]。本团队也有大量研究表明,外泌体参与到了乳腺癌相关成纤维细胞与癌细胞,例如异常低表达p85α的成纤维细胞中能够通过旁分泌WNT10B促进乳腺癌细胞的转移[34],乳腺癌细胞能通过分泌含有大量Survivin蛋白的外泌体促进成纤维细胞的活化[35]。

图3 外泌体的标志与功能[18]Figure 3. Signs and functions of exosomes[18]
外泌体作为肿瘤微环境中细胞通讯的重要介质之一,往往能通过其包含的蛋白质、DNA、RNA等物质起到信息交换与物质传递的功能。miRNA是外泌体装载物中的重要组成部分,在原位肿瘤微环境中发挥了关键的作用。例如乳腺癌微环境中,外泌体中的miR-10b可以通过抑制非转移性癌细胞中的靶基因,如HOXD10和KLF4的蛋白质水平来促进其发生侵袭[36]。转移前生态位作为癌症的远端转移位点中适合循环癌细胞的生存和生长的微环境,也能受到外泌体miRNA的作用而进行重塑。例如,乳腺癌外泌体中的miR-186、miR-23a和miR-205能促进癌细胞在肝脏形成小生境,从而为转移癌细胞的生长提供良好的环境[37]。除此之外,乳腺癌微环境中的外泌体miRNA还能够改变癌细胞的代谢水平,例如乳腺癌来源的外泌体miR-122能够转移至脑部和肺部中性粒细胞中的基质细胞来改变其葡萄糖代谢,从而提高乳腺癌细胞的转移效率[38]。
4 外泌体在乳腺癌中的临床应用探讨
为了进一步降低乳腺癌的发生率,提升乳腺癌的治愈率和患者的生存质量,必须加深对乳腺癌的了解,以开发有效的针对性的治疗方法。目前关于乳腺癌的研究大多集中在乳腺癌细胞的发生与发展方面,并且已经发现了许多乳腺癌中易突变的致癌基因,基于此研发了靶向这些基因的抗癌药物,然而,由于乳腺癌细胞的转移性与干性,这些抗癌药物的疗效往往不尽人意。根据Hanahan和Weinberg总结出的几个主要的癌症标志特点以及Paget提出的癌症的“种子与土壤”理论可知,癌症的发生与发展绝不仅仅是由于癌细胞本身造成的,它还需要肿瘤微环境这个丰沃的“土壤”对其生长给予有力的支持。外泌体作为微环境的成纤维细胞、免疫细胞、血管内皮细胞与癌细胞之间重要的交流介质,对癌细胞的转移、免疫逃逸、血管生成以及干性都有着重要的调控作用[39]。目前有研究表明,通过外泌体包裹的有功能的活性miRNA-1142-3p抑制剂能够抑制乳腺癌的成瘤能力[40]。基于已取得的研究成果,有理由相信乳腺癌微环境中的重要调控者——外泌体在临床诊断中的广阔前景。具体来说,基于目前的RT-PCR、微阵列或RNA 测序等技术,已可以实现在飞摩尔范围内对体液中相对微量的RNA分子进行检测[41],再加上外泌体分离技术的迭代更新以及外泌体在人体体液中广泛存在这一重要特性,均为外泌体miRNA 的检测提供了有力的支持[42]。因此,目前外泌体miRNA不仅成为了癌症前期检测的指标之一,同时也成为了指示癌症病人预后情况的指标之一。例如,高水平的miR-185或低水平的miR-133b都与结直肠癌的转移和较差的预后有关[43]。更加重要的是,利用外泌体的载体性质以及能够穿过血脑屏障这一传统药物不具有的优势,可将与疾病相关的miRNA模拟物或抑制剂装载到患者的外泌体中,并重新注入血液中,以使患者体内外泌体miRNA水平恢复正常,从而达到治疗的目的[44-45]。因此,对外泌体的研究和利用或许能对乳腺癌的治疗提供新的方向。
5 结语
与体外培养的贴壁细胞不同,人体内疾病的发生在空间与动态变化上往往呈现较大的复杂性。因此,在肿瘤微环境中的外泌体基础上研究乳腺癌的发生发展,能够阐明乳腺癌细胞与肿瘤微环境其他细胞之间沟通的新的分子机制,以及调控癌细胞功能的新的关键基因,这样一种细胞之间相互调控作用更加真实反应了体内的生理现象。当然,疾病的发生绝不可能只是两种细胞群之间的相互作用,一定是多类群、多方向、多维度的复杂调控网络。因此,未来针对癌症的研究还需要更加全面的把握。

