龙蛭汤对大鼠脑缺血再灌注损伤后Caspase-1和IL-18蛋白表达的影响
范俊逸 陈永斌 刘启华 罗燕萍 李南方 黄显雯
〔摘要〕 目的 通過使用龙蛭汤对大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型大鼠进行干预,观察脑组织中焦亡相关蛋白Caspase-1和IL-18表达情况,探讨其对脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)的保护作用。方法 将48只SD大鼠随机分为假手术组、模型组、龙蛭汤组、丁苯酞组,共4组,每组12只。除假手术组外,其余3组均采用Longa线栓法建立MCAO大鼠模型。造模成功后丁苯酞组、龙蛭汤组分别予丁苯酞[40 mg/(kg·d)]、龙蛭汤[13.6 g/(kg·d)]灌胃,假手术组、模型组均予等量生理盐水灌胃。术后第3天对各组大鼠行神经功能缺损评分;使用TTC染色法对新鲜脑片进行染色,同时行脑梗死体积测定;HE染色法观察脑皮质区病理形态变化;免疫组化法检测脑组织Caspase-1和IL-18蛋白表达情况。结果 神经功能缺损评分结果显示,假手术组为0分;各造模组评分较假手术组升高,差异有统计学意义(P<0.05)。脑梗死体积百分比结果显示,假手术组无梗死灶;模型组最高,龙蛭汤组、丁苯酞组次之,均较模型组明显降低,差异有统计学意义(P<0.05)。脑组织HE染色结果显示,假手术组几乎未见受损细胞;模型组脑组织皮层神经细胞损伤严重,龙蛭汤组、丁苯酞组均较之有明显改善。免疫组化结果显示:假手术组仅见极少阳性细胞表达;与模型组比较,龙蛭汤组和丁苯酞组的Caspase-1和IL-18蛋白明显降低,差异有统计学意义(P<0.05)。结论 龙蛭汤在改善大鼠CIRI后症状和保护大鼠损伤后神经细胞方面有显著的效果,其机制可能与下调Caspase-1和IL-18蛋白表达有关。
〔关键词〕 脑缺血再灌注损伤;龙蛭汤;细胞焦亡;Caspase-1;IL-18
〔中图分类号〕R255.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.04.005
〔Abstract〕 Objective To investigate the expression of Caspase-1 and IL-18 in cerebral artery occlusion (MCAO) model of rats with Longzhi Decoction, and to investigate the protective effect of Longzhi Decoction on cerebral ischemia reperfusion injury (CIRI). Methods 48 SD rats were randomly divided into sham operation group, model group, Longzhi Decoction group and butylphthalide group, with 12 rats in each group. Except for sham operation group, MCAO rat model was established by Longa thread bolting method in the other 3 groups. After successful modeling, butylphthalide group and Longzhi Decoction group were given intragastric gavage of butylphthalide [40 mg/(kg·d)] and Longzhi Decoction [13.6 g/(kg·d)], respectively. Sham operation group and model group were given intragastric gavage of the same amount of normal saline. On the 3rd day after operation, nerve function deficit was scored in each group. TTC staining method was used to stain fresh brain slices and cerebral infarct volume was measured simultaneously. The pathological changes of cerebral cortex were observed by HE staining. The expression of Caspase-1 and IL-18 in brain tissues was detected by immunohistochemistry. Results The neurological deficit score in the sham operation group was 0. The scores of each model group were higher than those of the sham operation group, and the differences were statistically significant (P<0.05). The percentage of cerebral infarction volume showed that there was no infarction in the sham operation group. The highest value was found in model group, followed by Longzhi Decoction group and butylphthalide group, which were significantly lower than model group, with statistical significance (P<0.05). HE staining of brain tissues showed that there were almost no damaged cells in the sham operation group. The damage of cortical nerve cells in brain tissue was serious in model group, but was significantly improved in Longzhi Decoction group and butylphthalide group. Immunohistochemical results showed that only a few positive cells were found in the sham operation group. Compared with model group, the protein levels of Caspase-1 and IL-18 in Longzhi Decoction group and butylphthalide group were significantly decreased, with statistical significances (P<0.05). Conclusion Longzhi Decoction has significant effects on improving symptoms after CIRI and protecting nerve cells after injury in rats, and the mechanism may be related to the down-regulation of Caspase-1 and IL-18 protein expression.
〔Keywords〕 cerebral ischemia reperfusion injury; Longzhi Decoction; pyroptosis; Caspase-1; IL-18
脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI)是由于脑组织在缺血一段时间后恢复血液灌流,其神经缺损症状明显加重的现象[1]。CIRI的病理机制繁多并且十分复杂,近年研究[2-3]发现,细胞焦亡在该病发生发展的过程中扮演着重要角色,起着重要的病理损伤作用,是神经功能修复困难的主要原因之一。Caspase-1和IL-18是在细胞焦亡调节环节中起着重要作用的相关因子[4]。
CIRI属于中医学“中风”范畴,中风恢复期多有气虚,是由于正气抗邪后不足的结果,气虚则血行不畅,多有血络瘀阻的表现,久而久之,瘀血在血管内日益顽固,形成瘀血不去、新血不生的恶性循环。龙蛭汤是广西名老中医陈永斌教授治疗缺血性脑卒中的自拟经验方,该方以益气、活血并重,在脑卒中恢复期的临床运用中收效甚佳[5]。本实验采用大鼠MCAO模型,以龙蛭汤和丁苯酞为干预措施,检测大鼠脑皮质中Caspase-1和IL-18,比较两药对CIRI大鼠的保护机制,进一步完善龙蛭汤在临床应用方面的实验依据。
1 材料
1.1 药物、试剂
龙蛭汤免煎颗粒组成:生黄芪120 g,当归尾6 g,赤芍4.5 g,地龙3 g,川芎3 g,桃仁3 g,红花3 g,水蛭3 g,川牛膝6 g,购于广西中医药大学第一附属医院中药房。加入蒸馏水加热浓缩至1.36 g/mL浓度。丁苯酞软胶囊(批号:118171214,国药准字号:H20050299,石药集团恩必普药业有限公司)。
氯化三苯四氮唑(triphenyl tetrazolium chloride, TTC)染色剂(批号:G3005,北京索莱宝科技有限公司)。Caspase-1(批号:bs-0169R)、IL-18抗体(批号:bs-0529R)均购自北京博奥森生物技术有限公司。0.9%氯化钠(国药准字号:H61020015,西安双鹤药业有限公司)。所有制剂4 ℃保存备用。
1.2 实验仪器与器械
正置荧光显微镜(型号:BX53F+ceLLSensDimension,日本OLYMPUS公司);水浴箱(型号:SUB AQUA12 PLUS,美国Thermo公司);手动轮转式切片机(型号:RM2235,德国Leica公司);电热恒温干燥箱(型号:HGZF-II-101-3,上海跃进医疗器械有限公司);线栓(型号:L3600,广州佳灵生物技术有限公司)。
1.3 实验动物
48只雄性SD大鼠,体质量260~280 g,饲养于广西医科大学动物实验中心SPF级实验室,动物许可证号:SCXK(桂)-2014-0002。所有的动物实验均获得了广西医科大学动物实验中心伦理委员会的批准。
2 方法
2.1 动物分组
将48只雄性SD大鼠随机分为假手术组、模型组、龙蛭汤组、丁苯酞组,每组12只。
2.2 动物造模
均用改良线栓法[6]制备大鼠局灶性CIRI模型:用10%水合氯醛将动物麻醉,备皮后,用眼科剪沿锁骨正中做纵向切口,长度约3 cm,用钝性分离器小心分离肌肉组织,随后分离出右侧颈总动脉(common carotid artery, CCA)、颈外动脉(external carotid artery, ECA)和颈内动脉(internal carotid artery, ICA),形成一“Y”形分叉口。用外科縫合线打结CCA和ECA后用手术镊固定,于CCA下再穿一条线备用。ICA用血管夹夹闭以防血溢出,用显微剪于CCA上做一“V”形小口,插入线栓。缓慢进入ICA,到达动脉夹时,将CCA预留线拉紧以防止出血,后松开动脉夹后继续插入,直到线栓黑色标记点到达“Y”形分叉口附近后,表示线栓已进入大脑中动脉,用预留在CCA上的线将线栓固定后缝合皮肤,造模完成。假手术组造模方法:钝性分离各肌群、各颈动脉之后对切口进行常规缝合。其余3组均采用线栓法进行大脑中动脉梗塞,梗塞2 h后将线栓拔掉造成再灌注损伤。
2.3 动物给药方法
药物组用相应药物灌胃,根据大鼠与成人服药换算公式算得,龙蛭汤:13.6 mg/(kg·d);丁苯酞:40 mg/(kg·d)。假手术组与模型组用生理盐水代替,按每1 mL/100 g算。1 d/次,连续3 d,第一次灌胃于术后5~7 h进行。
2.4 神经功能损伤评分
大鼠造模后1.5 h及用药后3 d,参照Longa神经功能缺损评分法[7]对大鼠进行评分:(1)0分:行走如常;(2)1分:左前肢伸展;(3)2分:有左侧追尾现象;(4)3分:行走困难,摇摆不定;(5)4分:无自主活动。分值在1~4分表明造模成功,可入组进行下一步实验,因大鼠死亡等致样本不足时随机替补。处死前再进行一次评分。
2.5 取材及标本制备
给药3 d后,每组取6只大鼠以10%的水合氯醛腹腔麻醉,正常心脏灌注后断头取脑,从视交叉向后2 cm切取脑组织片,置于4%多聚甲醛中固定3~5 d后进行石蜡包埋及切片备用;每组再取6只大鼠腹腔麻醉后断头取新鲜脑组织,于-20 ℃冰箱冰冻20 min备用。
2.6 检测指标及方法
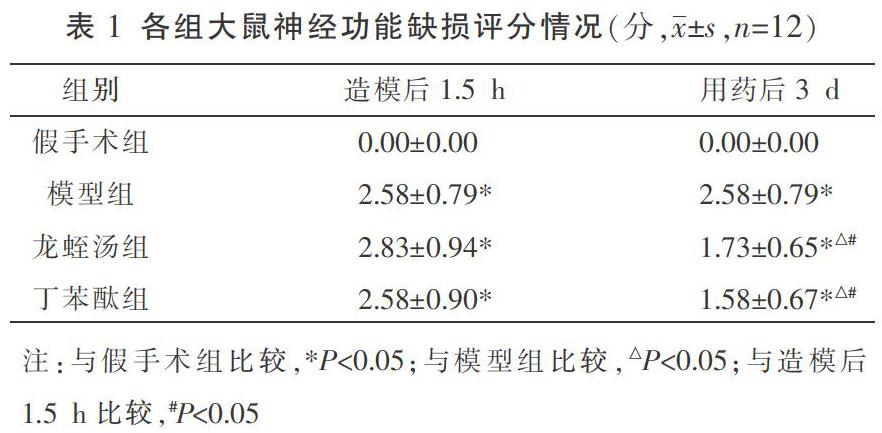
2.6.1 TTC染色测定脑梗死体积 新鲜脑组织在-20 ℃冰箱中冰冻20 min后取出,将其等距、冠状地切成2 mm厚的脑片,将脑片置于2% TTC染液中均匀着色,37 ℃恒温孵育15 min后,进行翻面,再孵育15 min。显色后按切片顺序摆放拍照后用图像分析软件Image J处理,计算各个脑片脑梗死体积及其占大脑半球体积百分比。
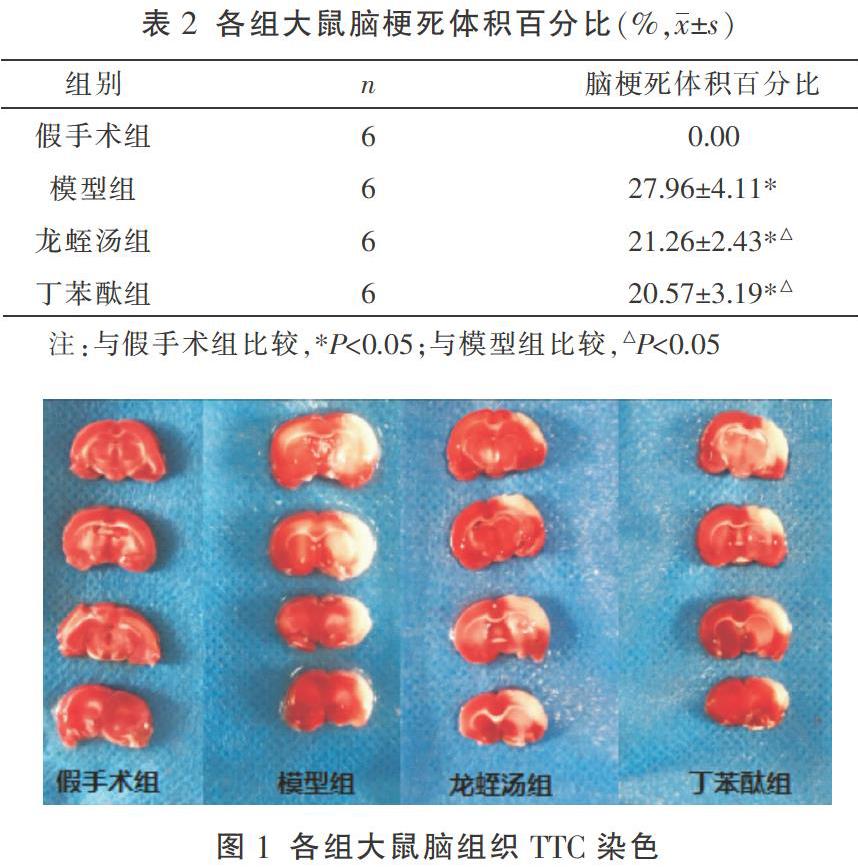
2.6.2 HE染色观察脑组织病理形态 取备用的石蜡切片,脱蜡脱水,依次用苏木精、伊红进行染色,中性树胶封片,高倍镜(×400)下观察皮质区脑组织病理形态。
2.6.3 免疫组化法检测Caspase-1和IL-18蛋白表达水平 取出备用石蜡切片,经脱蜡脱水,修复抗原,双氧水灭活内源性过氧化氢酶之后,分别滴加一抗(稀释度为1∶3 000的兔抗大鼠Caspase-1抗体和稀释度为1∶500的兔抗大鼠IL-18抗体),37 ℃恒温孵育2 h,DAB显色,显色20 min后,用自来水充分水洗,脱水,树胶封片。正置显微镜下观察阳性表达情况,阳性标记物为棕黄色或深棕色。从每张切片中任意选取5个视野,对阳性细胞进行计数,计算得出各个分组的阳性细胞率。
2.7 统计学方法
本实验所得数据均采用SPSS 22.0软件分析处理,计量资料用“x±s”表示,若数据满足正态分布,两组组间比较采用t检验,多组间比较采用单因素方差分析,方差齐者采用LSD检验,方差不齐者用Tamhane T2检验。以P<0.05为差异有统计学意义。
3 结果
3.1 各组大鼠神经功能缺损评分比较
造模后1.5 h,假手术组神经缺损评分为0分,模型组、龙蛭汤组、丁苯酞组3组评分均为1~4分,表示造模成功。用药后3 d,模型组神经功能缺损评分显著高于假手术组,差异有统计学意义(P<0.05);龙蛭汤组和丁苯酞组神经功能缺损评分显著低于模型组,差异有统计学意义(P<0.05);龙蛭汤组与丁苯酞组神经功能缺损评分比较,差异无统计学意义(P>0.05)。与造模后1.5 h比较,用药后3 d龙蛭汤组和丁苯酞组神经功能缺损评分降低,差异有统计学意义(P<0.05)。见表1。
3.2 各组大鼠脑梗死体积比较
假手术组大鼠新鲜脑组织切片的各个区域均呈匀称的鲜红色,无白色梗死灶;模型组切片梗死灶体积最大;龙蛭汤组、丁苯酞组次之。龙蛭汤组及丁苯酞组脑梗死体积百分比较模型组明显减少(P<0.05);龙蛭汤组与丁苯酞组比较,脑梗死体积差异无统计学意义(P>0.05)。见表2、图1。
3.3 各组大鼠脑组织病理改变
假手术组脑组织未见损伤,神经细胞包膜完整, 核大而圆,细胞间隙正常,排列有序、紧密;模型组脑组织损伤严重,神经细胞排列杂乱,松散,间质有明显水肿,包质中有空泡形成;龙蛭汤组和丁苯酞组脑组织结损伤程度较模型组明显减轻,神经细胞形态较规则,排列较有序,仅为轻度缺血改变。见图2。
3.4 腦组织皮质区Caspase-1和IL-18蛋白表达情况
假手术组脑组织中仅见少量Caspase-1和IL-18蛋白阳性细胞,与之相比,模型组阳性细胞率明显升高,差异有统计学意义(P<0.01);与模型组相比,龙蛭汤组和丁苯酞组阳性细胞率明显降低,差异有统计学意义(P<0.01);龙蛭汤组与丁苯酞组阳性细胞率比较,差异无统计学意义(P>0.05)。见表3、图3。
4 讨论
中医在治疗脑梗死方面积累了丰富的经验,长期临床观察表明,中医益气活血法对脑梗死的治疗具有良好的效果。补阳还五汤为益气活血方之杰出代表,具有补气、活血、通络功能,被广泛应用于缺血性中风。龙蛭汤是补阳还五汤基础上加用水蛭、川牛膝而成的经验方,多年来运用于中风急性期的临床治疗,效果甚佳[8]。此方承补阳还五汤之义重用黄芪,旨在通过补元气而达到“气旺则血行、瘀去则络通”的效果。当归尾较当归长于活血,使络通而血不伤,佐活血之品以祛瘀。地龙协诸药走周身,增强全方活血之力。此方创新之处在于水蛭与牛膝的加入。“瘀血不去则新血不生”,水蛭有破瘀而不伤新之功;牛膝逐瘀通经、善条达不畅之血,且卒中多见肝阳上亢、肝风内动之机,牛膝可通过补益肝肾之虚而治疗肝阳亢扰于上之证。二者相配善于攻脑卒中恢复期积久之滞,在缺血性卒中的临床运用中常获良效。从现代药理学研究角度来看,水蛭中含有抗血液凝固、扩张毛细血管、促血栓溶解的物质,如肝素、抗血栓素等,符合方中水蛭活血通络之义[9]。该方在补阳还五汤之基础上加强了活血之效力,弥补了其益气强而活血弱之不足,使得益气、活血相得益彰[10]。有研究[11-12]表明,龙蛭汤可通过调控促血管生成因子(HIF-1α、Ang-2)、自噬相关因子(LC3、Becline-1)等机制来改善缺血性脑损伤大鼠损伤后相关指标及症状。本研究结果表明,与未采取干预措施的CIRI模型大鼠相比,龙蛭汤干预下的模型大鼠神经功能缺损症状明显减轻;脑梗死体积百分比明显降低(P<0.05);HE染色结果表明,使用龙蛭汤干预后的模型大鼠脑组织皮质区细胞状态较模型组好,病理改变较模型组有明显改善,仅仅呈现出轻度脑缺血改变。综上可以看出,龙蛭汤在改善大鼠CIRI后的神经功能症状、维持脑组织神经细胞状态、减少脑梗死灶体积方面均有明显作用。
细胞焦亡可能与缺血性脑损伤的发生发展过程存在密切关联。研究[13-17]表明,激活细胞焦亡相关因子可加重缺血性脑损伤,抑制细胞焦亡相关因子可减轻损伤并发挥保护作用。缺血性脑损伤发生后数小时内,会通过一些途径形成炎症小体,如IL-18、IL-1β,可通过一系列的机制诱导缺血后脑组织中的神经元和神经胶质细胞的焦亡,造成脑损伤[18]。研究[19]证实:炎性小体介导的Caspase-1活化能诱导吞噬细胞焦亡,而在缺血性脑损伤中,它也发挥了重要作用——脑缺血神经元和神经胶质细胞上Caspase-1的表达显著增加,抑制Caspase-1能减轻脑缺血损伤。免疫组化结果显示,与模型组相比,龙蛭汤组Caspase-1和IL-18蛋白阳性细胞率明显降低,说明龙蛭汤下调了焦亡相关蛋白Caspase-1和IL-18的表达从而抑制了细胞焦亡,发挥了对大鼠脑组织的保护作用。
综上,龙蛭汤可以明显改善CIRI大鼠神经功能症状,维持脑组织神经细胞状态、减少脑梗死灶体积,发挥脑保护作用,其机制可能与下调脑组织中Caspase-1和IL-18的表达有关。
参考文献
[1] 张 楠,祁晓媛,潘思培,等.香叶木素对脑缺血再灌注损伤大鼠的保护作用研究[J].中国免疫学杂志,2019,35(24):2996-3000,3007.
[2] 曹冰倩,谭 峰.细胞焦亡对脑梗死神经修复的影响[J].深圳中西医结合杂志,2019,29(5):179-182.
[3] NOBLE M, MAYER-PR?魻SCHEL M. Glial restricted precursors[M]//Neural Development and Stem Cells, 2006: 143-188.
[4] 荣 妍,何 昱,程 兰,等.养阴通脑颗粒有效成分配伍对脑缺血再灌注损伤大鼠保护作用机制的研究[J].中国药学杂志,2018,53(3):199-204.
[5] 蒙家泉,陈永斌,刘启华,等.龙蛭汤对衣霉素诱导人脐静脉内皮细胞内GRP78和CHOP的影响[J].中国中西医结合杂志,2019,39(4):454-459.
[6] 缪 培,张 通,米海霞.基于线栓法大鼠大脑中动脉闭塞的局灶性脑缺血模型的比较研究[J].中国康复理论与实践,2016,22(10):1190-1195.
[7] LONGA E Z, WEINSTEIN P R, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1): 84-91.
[8] 何 泉,刘启华,蒙家泉,等.龙蛭汤含药血清对氧化损伤人脐静脉内皮细胞管型形成的影响[J].辽宁中医杂志,2017,44(12):2636-2639,2703.
[9] 来要水,胡跃强.水蛭治疗中风的研究进展[J].河北中医,2013,35(5):785-787.
[10] 邹 玲,陈永斌,刘启华,等.龙蛭汤对大鼠脑缺血再灌注损伤后Bcl-2和Caspase-3蛋白表达的影响[J].广西医科大学学报,2019,36(4):507-510.
[11] 冯 容,刘启华,陈永斌,等.龙蛭汤促气虚血瘀证急性脑梗死大鼠血管新生的作用及机制研究[J].辽宁中医杂志,2017,44(5): 1084-1087,1120.
[12] 邹 玲.基于细胞自噬探讨龙蛭汤促进脑缺血再灌注损伤大鼠血管新生的作用机制[D].南宁:广西医科大学,2019.
[13] 张伦忠,赵曼丽,韩慧蓉,等.辛温开窍中药对脑梗死大鼠NLRP3炎性反应通路的影响[J].现代中西医结合杂志,2019,28(17): 1838-1842.
[14] SHA R, ZHANG B, HAN X H, et al. Electroacupuncture alleviates ischemic brain injury by inhibiting the miR-223/NLRP3 pathway[J]. Medical Science Monitor, 2019, 25: 4723-4733.
[15] BARRINGTON J, LEMARCHAND E, ALLAN S M. A brain in flame; do inflammasomes and pyroptosis influence stroke pathology?[J]. Brain Pathology, 2017, 27(2): 205-212.
[16] 王 涛,刘宏祥,王 颖,等.清热化痰解毒方預处理对脑缺血再灌注损伤大鼠的保护作用及其对TXNIP/NLRP3通路的影响[J].重庆医学,2018,47(28):3605-3609.
[17] 卞 炜,秦文熠.电针对局灶脑缺血/再灌注模型大鼠大脑缺血皮质区P2X7R与NLRP3炎性小体表达的影响[J].中国组织化学与细胞化学杂志,2018,27(1):23-29.
[18] 孙玉洁,张楠楠,赵 萌.白藜芦醇对大鼠脑组织缺血再灌注过程中细胞焦亡的调控作用及对小胶质细胞NLRP3炎症小体、Caspase-1及ZO-1的影响[J].海南医学院学报,2019,25(17):1291-1294.
[19] 唐 标,邓常清.细胞焦亡与脑卒中[J].生理学报,2018,70(1):93-98.
(本文编辑 匡静之 周 旦)

