单侧前庭毁损引起的中枢平衡代偿
丁大连,徐先荣,李鹏,张建辉,孙虹
(1.Center for Hearing and Deafness, State University of New York at Buffalo,NY 14214,USA; 2. 空军特色医学中心 耳鼻咽喉头颈外科,北京 100142; 3.中山大学附属第三医院 耳鼻咽喉头颈外科,广东 广州 510230; 4.成都市第三人民医院 耳鼻咽喉头颈外科,四川 成都 610014; 5.中南大学湘雅医院 耳鼻咽喉头颈外科,湖南 长沙 410008)
机体内参与平衡感知和调控的中枢神经系统包括前庭通路、眼球和眼肌通路、小脑通路、丘脑通路、脑干网状结构通路、脊髓通路、大脑通路等[1]。上述任何一条神经通路的病变都可造成机体的平衡失调,并导致其他参与平衡感知和控制神经系统发生相应的代偿性改变[2-4]。本文仅综述单侧前庭毁损引起的中枢神经核团的代偿性调节作用。
1 双耳前庭输入信号的不对称是前庭性平衡失调的前提条件
前庭核除了接受来自前庭周边神经的刺激信号之外,还接受视觉和本体感觉信号的输入,因此前庭核不仅是内耳平衡感受器与视眼动神经核之间的中转站,而且是一个感觉运动集成的第一级整合中心[5]。动物实验证实,无论是全身应用耳毒性药物造成双侧前庭感觉毛细胞同时发生相似程度的破坏还是手术破坏双侧内耳前庭,都不会引起明显的眩晕症状和自发性眼球震颤[6]。然而如果仅仅破坏一侧前庭,或造成双侧前庭不同程度的损害,受试动物在麻醉清醒后都会立刻发生朝着前庭毁损侧或前庭损害较严重侧的头位偏斜,同时出现数小时到2 d的自发性眼震和严重的平衡功能障碍[7-8]。这个现象说明单侧前庭破坏所造成的前庭功能障碍要比双侧前庭同时受损严重得多,提示单纯内耳前庭损害导致平衡失调和自发性眼震的前提必须是双耳前庭的输入信号不对称,如果双侧前庭处于相同的损害水平,即使在同一时间彻底丧失双侧前庭器官,机体其他参与平衡感知调控的神经系统仍可有效维持机体的基本平衡状态。
2 前庭神经核在单侧前庭毁损后的代偿性调节作用
单侧前庭毁损之后,患侧前庭神经核的电活动即刻消失,然而健侧前庭核的电活动却显著增强,这显然是由于患侧前庭核的突然“沉默”解除了其对健侧前庭核的抑制[9-10]。随着单侧前庭毁损后时间的推移,健侧前庭核的电活动随着通过中线向患侧前庭核输入来自健侧前庭的刺激而逐渐减弱。大约在单侧前庭毁损后2周左右,健侧前庭核神经元的平均静息电活动降低到与前庭毁损侧前庭神经元静息电活动相等的低下程度[9-10]。术前双侧前庭核自发放电和对平衡刺激反应的活动能力保持在一个正常的平衡水平。单侧前庭毁损术后即刻,患侧前庭核的活动丧失,健侧前庭核由于对侧抑制的解除反而有所增强,此时伴随剧烈的自发性眼震和眩晕症状。单侧前庭毁损术后3 d,健侧前庭核的活动有所减弱,自发性眼震和眩晕症状有所减轻。单侧前庭毁损术后1周,健侧前庭核的活动继续减弱,患侧前庭核开始出现来自健侧前庭刺激的活动,少有轻微眩晕症状或偶见自发性眼震。单侧前庭毁损术后2周或更长时间,健侧前庭核的活动与患侧前庭核的活动达到一个新的低水平的平衡状态,眩晕和眼震症状彻底消失。见图1。这种发生在健侧前庭核的静息电位下调和敏感性降低以及经中线与患侧前庭核分享健侧前庭核信号的现象,可能是通过削弱和分享健侧前庭核使双侧前庭核达到一种新的平衡状态。这或许可以理解为了使双侧前庭的传入信号达到平衡,在永久丧失一侧前庭之后,机体通过主动削弱健侧前庭核以减少对前庭功能的需求,从而使其他平衡相关神经核团有效协调新的平衡感知和调控秩序。这种主动削弱健侧前庭信号的策略也许是机体在单侧前庭毁损之后重新获得平衡代偿的重要先决条件。

图1 单侧前庭毁损前后双侧前庭核对前庭失衡信号的代偿性调节示意图
双侧前庭核之间的间隙连接在单侧前庭毁损后发生的代偿过程中起到促进患侧前庭核恢复自发性电活动的作用[10-11]。单侧前庭的毁损注定患侧前庭核永久丧失来自患侧前庭的传入信息,唯一使患侧前庭核重新参与感受前庭刺激的途径只能是通过前庭联合分享来自健侧的前庭刺激信号。已知单侧前庭切除并不改变前庭联合的中线输出模式,患侧前庭核神经元突触的功效随着时间的延长而发生反应峰值的增加和持续时间的缩短以及突触后电位振幅的增大,从而使患侧前庭核对健侧前庭电刺激也能起反应。然而这种情况却并不发生在双侧前庭正常的动物,说明患侧前庭核神经元的功效增益有赖于突触可塑性的改变[12]。在前庭核平衡代偿过程中,随着患侧前庭核的激活和健侧前庭核的抑制,双侧前庭核最终达到一个低水平的对称状态。这种低水平代偿显然不足以完全替代原先双侧正常前庭对平衡信号的感知和调控,这就迫使机体更多依赖于其他中枢神经核团的代偿性改变。实验证实切断前庭联合并不影响静态平衡障碍的代偿性姿势调整,提示中线活动对前庭核静态障碍的代偿或许并不十分重要[13]。然而切断中线却有效消除了患侧I型神经元对旋转刺激的反应,提示前庭核对动态平衡障碍的代偿离不开中线前庭联合神经活动的参与[12]。
在脑可塑性改变事件中,神经网的数量和着色程度在早期有一个暂时降低的过程,但在平衡代偿之后却可以恢复[14]。在遗传性神经网减少的小鼠,单侧前庭毁损后的平衡代偿过程明显缩短[14]。这或许是因为神经网减少小鼠的前庭核由于缺乏外基质而更容易发生可塑性改变,至少意味着神经网的改变是前庭核代偿的重要相关因素之一。
3 视觉系统在单侧前庭毁损后的代偿性调节作用
前庭损害或眼病及视动障碍之所以都伴随眼震和眩晕,这是由于视眼动通路与前庭眼动通路在脑干存在着共享结构,由此造成视觉与内耳前庭之间的相互影响和交互反应。单侧前庭毁损后,视神经和眼动神经始终在利用视觉维持机体的平衡,从而使机体能够迅速重新确定空间意识[15]。值得注意的是,单侧前庭毁损引起的自发性眼震往往在24 h内消失,然而前庭的代偿却需要至少1周以上,提示视觉代偿的发生要比前庭代偿早得多。实验证实,生活在暗环境单侧前庭毁损动物的前庭-眼反射难以恢复,相反,经历视觉适应却可以使前庭-眼反射很快恢复[16]。单侧迷路切除后在光照下代偿沙土鼠的前庭内侧核很快出现频率响应的改善,而在黑暗环境中代偿动物却未能改善。此外,单侧前庭毁损后在光照下代偿动物的对侧橄榄背下盖和垂体及前庭核中的Fos标记和浦肯野细胞标记均迅速增强,提示这些改变应该归因于视觉的代偿性输入[17]。另外,一位代偿最佳半规管畸形儿童案例虽然学会了游泳,但在闭眼时却无法保持水中平衡,这足以说明视觉代偿的重要性[18]。
为了使物体在视网膜上的成像清晰稳定,凝视本能使正常的前庭-眼反射在向右旋转的前庭刺激条件下会产生一个眼球向左移动的反射。然而,向右旋转形成的固定物体图像左移在反光棱镜测试条件下却是朝着相反的方向,从而使眼球的运动方向不是向左而是向右。受试者因反光镜作用而发生的前庭-眼反射减弱可以保持到第2天,应用反光棱镜数周后,这种反转方向的眼震还可能再次出现[19-20]。 单侧前庭损毁的猫在类似实验条件下表现出的纠正眼球运动方向要比正常动物缓慢的多[21]。上述结果不仅说明了视觉适应的可塑性,而且还证明了前庭失衡与视觉纠正的密切关系。实验证实,对前庭外周受损病例进行必要的视眼动训练有助于提高前庭-眼反射的增益,因此,视动眼练习被认为是替代性前庭康复的有效训练方法之一。
4 小脑系统在单侧前庭毁损后的代偿性调节作用
单侧前庭毁损在导致患侧前庭输入丧失和患侧前庭核功能减弱的同时也削弱健侧前庭核的神经活动。随着双侧前庭核的失衡,小脑不得不强制抑制甚至暂时关闭来自前庭核的信息,在小脑水平把因前庭失衡的感觉降低到最低水平的过程被称之为“小脑钳”效应。即术前双侧小脑神经核团对头位转动刺激保持在一个相对平衡的反应水平。单侧前庭毁损术后即刻,患侧小脑神经核团因来自患侧前庭核的信号丧失而几乎丧失了对头位转动的反应活动,健侧小脑神经核团的活动却相对有所增强。单侧前庭毁损术后24 h健侧小脑神经核团的活动明显减弱,患侧小脑神经核团开始对头位转动出现反应活动。单侧前庭毁损术后48 h,双侧小脑的神经核团活动对头位转动刺激产生相对平衡的反应活动。见图2。将前庭核代偿过程(图1)与小脑神经核团代偿过程(图2)做一个对比,不难看出在单侧前庭毁损之后,在前庭核水平实现代偿的时间超过1周,而在小脑水平实现代偿的时间仅需48 h。由此可见,小脑钳效应可以迅速屏蔽来自前庭核的失衡信息。这是否意味着前庭核的代偿性功能下调有赖于小脑钳效应?还有待进一步研究。动物实验发现,单侧前庭神经切断后,小脑和前庭核的浦肯野细胞内的信号转导酶-蛋白激酶C及其异构体从前庭毁损后6 h的表达显著不对称,但在24 h内可转变到完全对称,提示浦肯野细胞内蛋白激酶C及其异构体很可能关系到最早出现在小脑和前庭核的突触可塑性变化[22-23]。鉴于下橄榄核和后蚓前腹膜神经元在单侧前庭毁损后也迅速发生代谢改变,提示小脑的代偿性调节对前庭脑干也会产生反馈性影响。另外,双侧脑干、小脑和下橄榄体的多胺,如亚精胺、精胺、腐胺等在单侧前庭毁损后也都迅速提高到一个新的平衡状态,提示多胺水平的明显改变对脑干、小脑和下橄榄体等中枢神经系统的代偿性平衡具有重要的作用[24]。做为研究神经激活和中枢可塑性的分子标志物,在单侧前庭毁损之后,c-Fos mRNA及其相关Fos蛋白质被发现在前庭核、下橄榄、小脑皮质和尾状核均呈现明显的不对称表达,证实这些神经核团都因平衡障碍而发生了可塑性改变[25]。
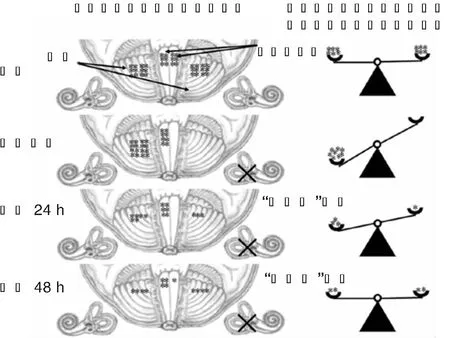
图2 单侧前庭毁损前后双侧小脑对前庭失衡信号的代偿性调节示意图
单侧前庭毁损但小脑结构正常的动物表现出有效的动态平衡适应性,然而将小脑切除的动物却完全丧失了这种适应性恢复,说明小脑前庭反射的自适应增益控制在平衡代偿中至关重要[26-27]。Aleisa等[28]发现,具备小脑浦肯野细胞的Lurcher野生型小鼠的静态平衡障碍和动态平衡障碍在单侧前庭损坏后都可完全恢复正常,但在不具备小脑浦肯野细胞的Lurcher突变小鼠则不能实现静态平衡代偿,其动态平衡代偿性恢复也十分有限,这就再次说明小脑浦肯野细胞在单侧前庭永久性损害后的平衡康复过程中所具有的重要作用。与此不同的是,单侧前庭神经切断而小脑正常的狒狒却使其姿势障碍得到了完全的纠正[29]。上述现象足以说明,即使机体还有其他参与平衡感知和调整的神经核团存在,但小脑的丧失却将使前庭永久损害造成的平衡障碍难以代偿。
5 下橄榄体在单侧前庭毁损后的代偿性调节作用
下橄榄体的主要功能是协调小脑和脊髓之间的信号传递并参与机体运动的平衡调节和运动学习。因此下橄榄核关系到小脑和脊髓对平衡代偿。在单侧前庭毁损后6~24 h的分子事件发生的最活跃阶段,对侧下橄榄核的BDNF mRNA发生了明显增强,这种改变被认为与下橄榄核早期发生的c-Fos快速诱导存在密切关系[25, 30]。在单侧迷路切除小鼠的前庭内侧核、脊髓前庭核、对侧前臂下动脉核以及对侧下橄榄核都发现了类似的c-Fos改变,说明下橄榄核在平衡失调和代偿期间确实发生了明显的可塑性改变[31]。在单侧前庭毁损早期的沙土鼠橄榄背下盖也呈现出c-Fos表达增强,说明下橄榄核在平衡失调的开始阶段就参与了平衡的代偿[17]。单侧化学性迷路切除大鼠在损害发生的急性期同样立刻表现出下橄榄核中的Fos不对称分布,进一步证实下橄榄核是最早开始发生代偿性改变的中枢神经核团之一[32]。Kaufman在单侧迷路切除后第4天大鼠身上发现下橄榄核中的促肾上腺皮质素释放因子的寡核苷酸水平发生明显变化,提示这些神经化学物质可能是下橄榄核代偿性改变的重要物质基础[33]。
6 丘脑对前庭失衡的代偿性调节
作为第三级感觉运动整合中心之一的丘脑,在单侧前庭毁损后因输入信号混乱而产生错误丘觉。随着前庭核和小脑及其他神经核团的代偿性改变,传入丘脑的体位平衡信号会逐渐趋向于对称。虽然平衡丘觉的恢复离不开所有参与平衡感知神经核团的共同代偿性调控,但丘脑本身在平衡代偿期间也会发生一系列代偿性改变。Zwergal等[34]证明单侧迷路破坏动物的前庭核、丘脑、多感觉皮层、海马及杏仁核在损害即刻就发生了脑葡萄糖代谢的显著不对称,在随后的1~2 d逐渐恢复并在双侧前庭核和下丘脑保持持续增长趋势,说明丘脑和脑干前庭核对机体平衡失调的感觉同样敏感并且在病变发生后即刻就做出相应改变。单侧前庭毁损后,N-乙酰-L-亮氨酸的表达在丘脑下部明显减少而在前庭小脑却显著增加[35]。值得特别注意的是,由小脑3个中央核团和前庭复合体发出新的神经纤维投射到同侧丘脑。说明丘脑在单侧前庭毁损后不仅促进自身的可塑性改变而且与其他神经核团建立起新的神经联系[4]。
前庭功能被认为有助于空间信息处理和海马空间记忆。研究证实,丘脑可将前庭信息通过前额叶皮层直接传递到海马,刺激前庭也可以通过影响丘脑前核神经元间接构成对海马的刺激,提示丘脑-海马之间的相互作用很可能在单侧前庭毁损后的平衡代偿中也起到重要作用[36]。
7 脊髓神经束对前庭失衡的代偿性调节
来自中枢各个参与感知和调控平衡的神经核团发出的神经指令直接或间接抵达脊髓,在直接调节脊髓牵强反射的同时,又被间接下达到各个神经-肌肉接头终端,从而通过控制相应的肌肉群张力协调以纠正体位姿势。脊髓神经束在单侧前庭毁损后的平衡代偿作用过去被认为仅仅是把中枢各个神经核团的指令下达到运动神经的终端以纠正体位平衡。虽然一侧前庭神经切断立刻表现出脊髓反射的不对称,但是大都被归因于是多个中枢神经核团因前庭失衡所发出的错误指令而排除了脊神经单独代偿的可能性。然而,Azzena等[37]在单侧脊髓传入神经切除后又施行一侧迷路切除而最终实现平衡代偿的兔子身上发现,前庭皮层场电位和刺激健侧前庭神经从前庭皮层诱发的单神经纤维响应均发生了对侧增强而同侧减弱的明显改变。这些不对称反应提示,来自脊髓的信号干预很可能影响到前庭脊髓代偿和前庭眼动功能补偿以及大脑皮层功能。
前庭外侧脊髓束被认为是脊椎动物进化最早出现的前庭脊髓控制途径。Di Bonito等[38]研究了基因Hoxb1从前庭核投射到脊髓的发育模式,Hoxb1纯合子突变使起源于小鼠后脑的前庭内外侧脊髓束和前庭眼束及网状脊髓神经元在小鼠出生早期阶段均无法形成,这种缺陷造成的前庭外侧脊髓束介导的后肢前庭脊髓反射消失虽然在出生后第2周可以得到代偿性恢复,但成年小鼠始终还是存在肢体运动的不协调缺陷。上述现象不仅说明Hoxb1基因对前庭脊髓束发育的重要性,同时也提示反射性肢体运动失调具有其自主可塑性。
8 脑干网状结构对前庭失衡的代偿性调节
脑干内的神经核团包含多种内脏和躯体的感觉核团和运动核团。尤其是特殊躯体感觉核中的耳蜗核和前庭核,分别在听觉功能和平衡功能起到决定性重要作用。脑干网状结构除了包括脑干界内的那些神经核团和神经纤维之外,还包括从脊髓到丘脑底部所有的神经细胞和由神经纤维交织而成的网状结构,其上行投射到大脑皮层,其下行投射到脊髓,因此脑干网状系统在平衡感知和调控方面起到举足轻重的作用。
前庭核位于脑干的桥脑和延髓,所以,发生在前庭核的代偿性调节实际上也就是发生在脑干及其网状系统内[10,12]。大部分视觉和眼动神经传导通路都是通过脑干,因此视觉和眼动代偿也关系到脑干网状结构对平衡的代偿性调节[17,20,39]。脑干具备参与调节骨骼肌张力和内脏活动的功能,做为机体运动调节中枢的小脑更是通过调节骨骼肌运动维持着体位平衡,特别是古小脑,其主要职责就是接受来自前庭核的感应信息,因此脑干与小脑在平衡失调和平衡代偿期间始终保持着同步协调性改变[22-25]。下橄榄核做为延髓的感觉运动整合中心位于脑干延髓橄榄的深层,担负着脑干与小脑和脑干与大脑之间联系的重任,因此下橄榄核的平衡代偿实际上属于脑干代偿的一部分[17, 25, 30-31]。从脑干直接投射到丘脑的平衡觉信号经丘脑整合成平衡丘觉,因此丘脑的平衡代偿也有赖于脑干网状结构的信息输入[4, 34-35]。脑干延髓的尾端直接连接脊髓,从而使脊髓平衡代偿与脑干及其网状结构的代偿性调节密切相关[37]。
Fos被认为是代偿性改变的神经元激活模式,亦可视为代偿触发器[40-41]。Kaufman等[32]发现单侧前庭切除大鼠脑干神经元中Fos蛋白的表达变化,从而认定表达Fos蛋白的神经元是产生反应的特定神经核团。Cirelli等在单侧迷路切除后3、6、24 h分别观察了大脑中基因c-Fos表达水平的改变,从而确定了最早发生可塑性改变的神经元的位置,其中脑干网状系统的神经元和其它参与感知调控平衡的神经核团一样,最早进入了激活模式[42]。
9 大脑系统在单侧前庭毁损后的代偿性调节作用
虽然大脑不与前庭直接联系,但是所有参与感知和调控平衡的神经核团都通过各自的投射系统把信息传送到大脑前庭皮层[43]。因此,单侧前庭毁损的信息自始至终都被及时传送到大脑。
实验发现单侧前庭神经炎患者的脑局部葡萄糖代谢在前庭皮层和皮质下区域在急性期显著加强,但在视觉皮层和听觉皮层却明显减弱,说明单侧前庭的损坏立刻启动了大脑皮层的激活模式[39]。据报道,前庭神经炎患者的大脑前庭皮层的灰质体积显著增大[3,44],单侧听神经瘤切除患者的大脑初级体感皮层和运动敏感区的灰质体积也明显增大[3],证明大脑皮层在接收到平衡失调信息后确实立刻发生了相应的结构改变。由此可见,发生在大脑皮层灰质的结构改变可能是实现大脑皮层可塑性改变的物质基础[3]。
大量脑损伤实验结果证实,脑结构的可塑性改变主要表现在可塑性轴突和树突的发芽及突触数量的增加,脑功能的可塑性改变主要表现在脑功能的重组、潜伏神经通路的启用、神经联系效率的增强以及突触传递的可塑性变化。目前对单侧前庭毁损引起的大脑可塑性变化的发生和发展及其改变机制,还有待更深入的实验研究。

