基于ITS2序列的竹叶花椒及其近缘种药材鉴别△
齐景梁,高必兴,2,苟琰,2,耿昭,卿艳,周娟,姜卫东*
1.四川省药品检验研究院/国家药品监督管理局 中成药质量评价重点实验室,四川 成都 611731;2.成都中医药大学,四川 成都 611137
除历版《中华人民共和国药典》(以下简称《中国药典》)收载的花椒品种外,芸香科花椒属植物竹叶花椒ZanthoxylumarmatumDC.是收载标准最多的花椒属药材,药用部位多为果皮,具有温中止痛、杀虫止痒之功效[1-4]。其主要分布于我国西南、华南、华东和华中地区[5],川渝地区多有栽培。竹叶花椒具有较长的药用历史,《证类本草》《本草纲目》《植物名实图考》等均有记载[6-8]。竹叶花椒又被称作“青花椒”“藤椒”,常与《中国药典》2020年版收载的花椒来源之一青花椒Z.schinifoliumSieb.et Zucc.相混淆(花椒的另一来源为花椒Z.bungeanumMaxim.)[9-10]。《贵州省中药材、民族药材质量标准》2003年版野花椒(山花椒)品种项下除竹叶花椒外还收载了野花椒Z.simulansHance[1]。以上3种植物均为花椒属植物,其果皮与竹叶花椒相近,不易区分。
作为中药分子鉴定学上的创新,DNA条形码技术可为动植物来源中药材的鉴定提供快捷方法[11]。自Hebert等[12]于2003年首次正式提出DNA条形码的概念以来,DNA条形码技术发展迅速。《中国药典》2020年版收载了中药材DNA条形码分子鉴定法指导原则[13]。陈士林团队[14-15]通过比较研究多个候选DNA条形码序列,提出将内转录间隔区2(ITS2)作为药用植物鉴定的标准DNA条形码。目前,关于竹叶花椒的研究多集中于化学成分、药理作用等方面,而分子生物学方面的研究多以花椒为重点。本研究选取ITS2序列,对竹叶花椒及其近缘种进行鉴别,从分子生物学角度区分竹叶花椒及其近缘种,为合理开发竹叶花椒提供参考。
1 材料
C1000型聚合酶链式反应(PCR)仪、PowerPac Basic型电泳仪、Gel Doc XR+型全自动凝胶成像系统(Bio-Rad公司);XP205型电子分析天平(Mettler Toledo公司);MM400型球磨仪(Retsch公司);MiniSpin型高速离心机(Eppendorf公司);Milli-Q Advantage A10型纯水仪(Millipore公司);植物基因组DNA提取试剂盒、2×M5 HiPer plusTaqHiFi PCR Mix、Gene Red核酸染料(天根生化科技有限公司);Taq酶PCR扩增试剂盒(北京聚合美生物科技有限公司);琼脂糖(Biowest公司);ITS2引物(ITS2F:5′-ATGCGATACTTGGTGTGAAT-3′;ITS3R:5′-GACGCTTCTCCAGACTACAAT-3′)由上海捷瑞生物工程有限公司合成。
从四川、重庆、宁夏、安徽、辽宁等地收集了13批竹叶花椒、4批花椒、4批青花椒药材,均经四川省药品检验研究院黎跃成主任中药师进行性状鉴定,分别为竹叶花椒ZanthoxylumarmatumDC.、花椒Z.bungeanumMaxim.、青花椒Z.schinifoliumSieb.et Zucc.的干燥成熟果皮,标本保存于四川省药品检验研究院标本馆。另从GenBank数据库下载22条ITS2序列(5条竹叶花椒、7条花椒、5条青花椒、5条野花椒)用于比较分析。样品信息见表1,GenBank下载序列信息见表2。

表1 花椒属药材样品信息
表2 花椒属药材样品GenBank下载序列信息
2 方法
2.1 提取DNA
依次用75%乙醇1 mL、灭菌超纯水1 mL清洗样品表面,晾干水分,用球磨仪研磨成粉末;取粉末约30 mg,按照DNA提取试剂盒说明书进行操作,提取DNA,-20 ℃保存备用。
2.2 PCR扩增及测序
扩增所用引物为通用引物[16],扩增条件及参数参照文献[16-17]方法及扩增试剂盒的说明。PCR反应体系为25 μL,包含2×TaqMasterMix缓冲液12.5 μL、上下游引物各0.6 μL、DNA模板1 μL,加灭菌超纯水至25 μL。阴性对照为无模板DNA的反应体系。以10 000 r·min-1离心(离心半径为3 cm)5 s后,置于PCR仪中。反应程序为95 ℃预变性4 min;94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸45 s,35个循环;72 ℃延伸5 min。PCR产物用1.5%琼脂糖凝胶电泳检测以确定目的条带片段大小,扩增产物送Thermo Fisher公司进行测序。
2.3 数据分析
应用Codon Code Aligner V7.0.1对测序获得的数据进行校对拼接,去除引物及低质量区,基于隐马尔科夫模型的Hmmer注释方法去除5.8S和28S区段,即可获得ITS2序列信息[18]。
分别进入美国国家生物技术信息中心(NCBI,https://blast.ncbi.nlm.nih.gov/Blast.cgi)和中药材DNA条形码鉴定系统(http://barcode.ndctcm.org/china/),应用相似性搜索法对实验样品的不同单倍型序列进行Basic Local Alignment Search Tool(BLAST)鉴定分析。
采用MEGA 7.0软件对ITS2序列进行比对,计算种内、种间Kimura 2-parameter(K2P)遗传距离,利用邻接法(NJ)构建系统聚类树,同时以Bootstrap自展支持率(1000次)重复检验各分支的支持率[19-20]。
登录Internal Transcribed Spacer 2 Ribosomal RNA Database(http://its2.bioapps.biozentrum.uni-wuerzburg.de/),对不同物种的主导单倍型进行ITS2二级结构的预测[21-23],并采用Pseudoviewer(http://pseudoviewer. inha.ac.kr/WSPV_quickSender.asp?)查看预测所得二级结构。
3 结果与分析
3.1 ITS2序列分析
不同来源的18条竹叶花椒ITS2序列比对后长度为227~228 bp,鸟嘌呤和胞嘧啶(GC)占比为70.0%~70.9%,种内变异位点6个,分别为68位点的C-T变异、96位点的C-T变异、125位点的A-T变异、167位点的C-T变异、180位点的C-T变异、181位点的C-T变异,形成5个单倍型。主导单倍型A1有9条序列,其中实验样品单倍型为A1~A3。不同来源的11条花椒ITS2序列比对后长度为223~224 bp,GC占比为66.1%~67.3%,种内变异位点10个,形成5个单倍型,主导单倍型B1有7条序列,其中实验样品单倍型为B1、B2、B4、B5。不同来源的9条青花椒ITS2序列比对后长度为224 bp,GC占比为71.0%,无种内变异位点,全为单倍型C1。5条野花椒ITS2序列比对后长度为224 bp,GC占比为68.8%,无种内变异位点,全为单倍型D1。竹叶花椒与其近缘种间的变异位点见图1,种间变异程度较为丰富。

图1 竹叶花椒及其近缘种ITS2序列的种内、种间变异位点
3.2 相似性搜索法分析
基于NCBI和中药材DNA条形码鉴定系统的BLAST鉴定结果见表3。BLAST结果与性状鉴定结果一致。

表3 竹叶花椒及其近缘种BLAST鉴定结果
3.3 遗传距离分析
竹叶花椒种内平均K2P遗传距离为0.005,小于其与花椒(0.042)、青花椒(0.113)、野花椒(0.024)的种间平均K2P遗传距离。竹叶花椒种内最大K2P遗传距离(0.018)小于其与花椒的种间最小K2P遗传距离(0.033);小于其与青花椒的种间最小K2P遗传距离(0.108);接近其与野花椒的种间最小K2P遗传距离(0.018),见表4。
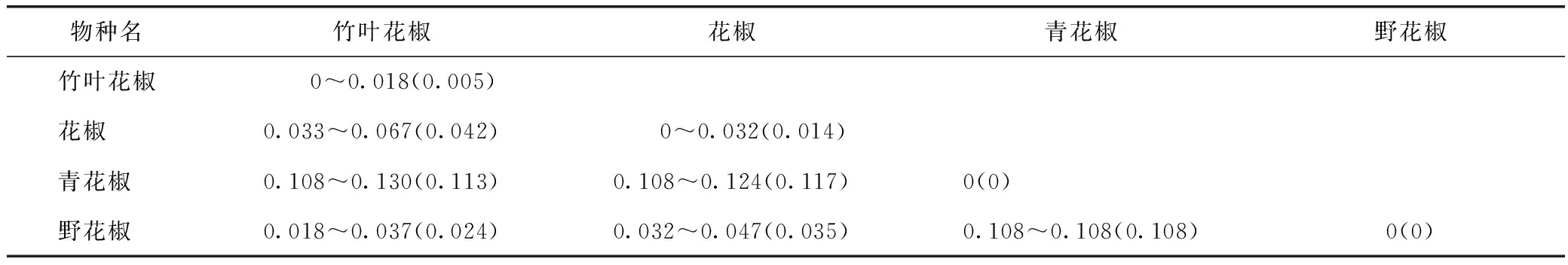
表4 竹叶花椒与其近缘种的种内、种间K2P遗传距离
3.4 NJ系统聚类树分析
从NJ系统聚类树可以看出,各物种均能以大于50%的自展支持率各自聚为1支,表现出了良好的单系性。其中青花椒单独聚为1支,与竹叶花椒、野花椒、花椒相区分,见图2。

注:支上数值仅显示自展支持率≥50%。图2 基于ITS2序列构建的竹叶花椒及其近缘种的NJ树
3.5 ITS2二级结构分析
在进行ITS2二级结构预测时,数据库网站有与青花椒、野花椒主导单倍型相同的或高度相似的二级结构模型;竹叶花椒、花椒主导单倍型可直接生成二级结构。竹叶花椒及其近缘种ITS2二级结构见图3。其二级结构均为典型的1环4臂结构,即1个大的多分支环和4个螺旋(helix),每个螺旋上有数目不等的茎环,其中螺旋Ⅲ最长;基序(sequence motifs)为U-U mismatch (Ⅱ,left) U-U mismatch (Ⅱ,right) with AAA (btw.Ⅱ,Ⅲ) UGGU (Ⅲ,5′side)。竹叶花椒螺旋Ⅰ有3个凸环、1个发卡环;螺旋Ⅱ有2个内环、1个发卡环;螺旋Ⅲ有5个凸环、2个内环、1个发卡环;螺旋Ⅳ有3个凸环、1个发卡环。竹叶花椒近缘种可以从每个螺旋的长度、螺旋之间的反转角度及螺旋上的茎环数目等方面与竹叶花椒进行区分。花椒、野花椒螺旋Ⅳ比竹叶花椒短,少1个茎环;青花椒螺旋Ⅲ比竹叶花椒多2个茎环;花椒、青花椒、野花椒螺旋Ⅰ与螺旋Ⅲ间的反转角度与竹叶花椒均不相同。ITS2二级结构可以直观地对竹叶花椒及其近缘种进行区分。
4 讨论
中药鉴定往往是多个方法的综合运用和相互验证。中药材原植(动)物鉴定、性状鉴定、显微鉴定和理化鉴定的传统方法存在一定局限性,而DNA条形码技术不受个体形态特征和完整性的影响,方法易于统一、标准化,是传统鉴定方法的有效补充[17,24]。但同时,DNA条形码鉴定实验取材极少,取样误差对实验结果影响较大。加之市售中药材情况较复杂,可能存在混杂甚至掺伪情况。因此,如何从量较大的中药材中取样,特别是从掺伪的样品中取样十分关键。这就需要借助性状鉴别、显微鉴别等手段对实验样品进行甄别,判断样品是否掺伪。若存在掺伪,就需分别进行取样、实验。本研究中的样品均经过性状鉴定,确定了样品的单一性及其基原。最终ITS2条形码鉴定结果与性状鉴定结果一致。
与侯典云等[25]研究结果比较,本研究获得了竹叶花椒、花椒ITS2序列的新单倍型;获得的青椒单倍型与文献中GU247238单倍型相同。但本研究中样品批次及代表性仍有局限,各品种所获得的单倍型还无法囊括自然界的所有单倍型。
花椒的最大种内遗传距离为0.032,接近其与竹叶花椒的最小种间遗传距离0.033;竹叶花椒最大种内遗传距离为0.018,接近其与野花椒的最小种间遗传距离0.018。花椒与竹叶花椒间、竹叶花椒与野花椒间不存在较宽的“barcoding gap”,即遗传变异没有形成明显的间隔区。Meyer等[26]的研究也表明,理想的“barcoding gap”并不会经常出现。但通过比较种间平均遗传距离,同时结合BLAST结果、NJ系统聚类树及ITS2二级结构也可以对其进行区分。
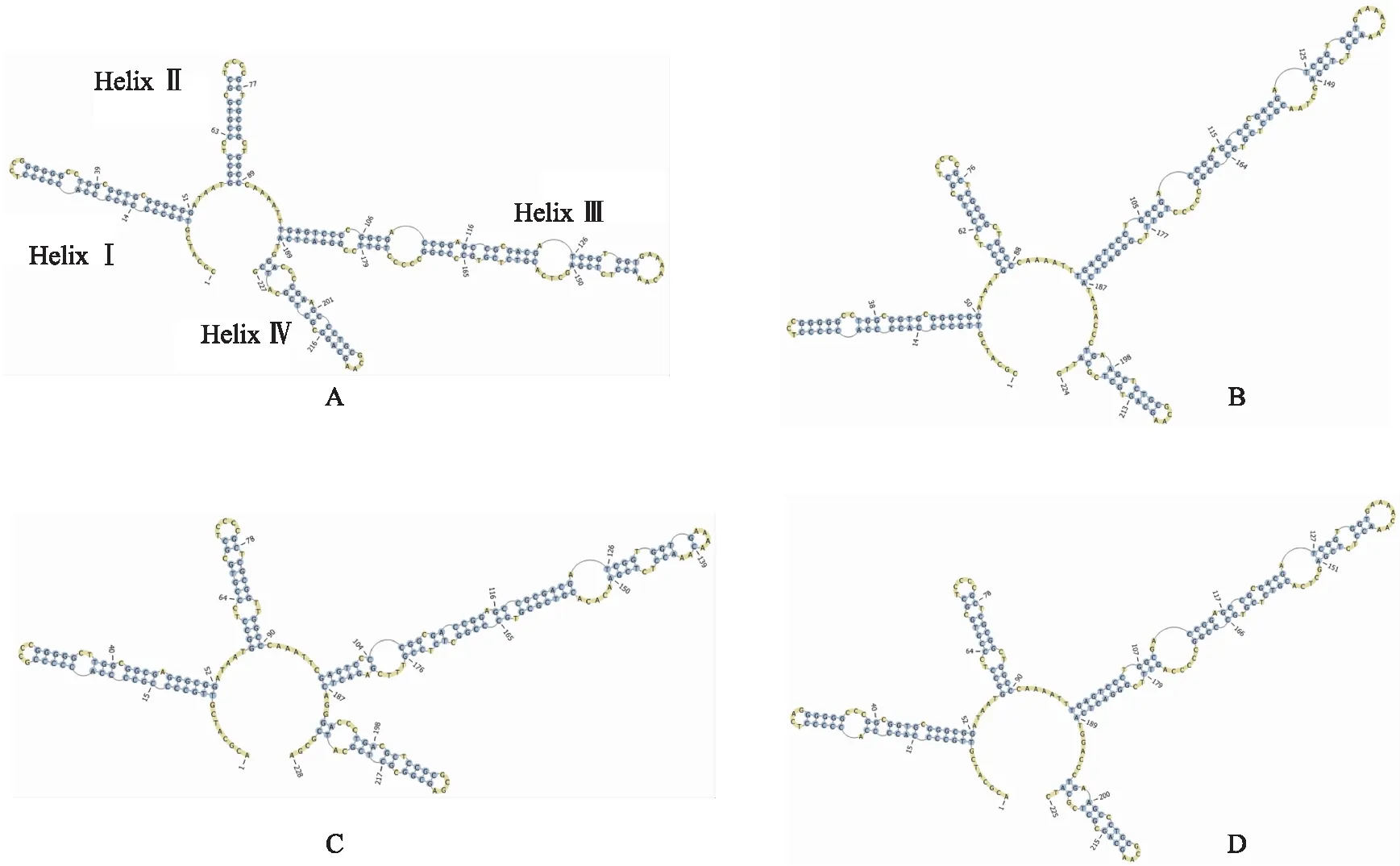
注:A.竹叶花椒;B.花椒;C.青花椒;D.野花椒。图3 竹叶花椒及其近缘种的ITS2二级结构
ITS2二级结构是由RNA中的核苷酸在氢键作用下发生碱基互补配对,导致自身回折形成的茎环结构,是实现细胞功能的结构基础,包含着额外的系统发育信息[27-29]。因此,ITS2二级结构可以作为DNA条形码鉴别中药材的辅助手段。目前基于ITS2二级结构对中药材进行的鉴别研究已见报道,如刘新星等[30]采用ITS2二级结构能将当归与其混伪品和近缘属药材区分开,特别是在NJ聚类树中独活与当归聚为一大支的情况下,通过分析两者的ITS2二级结构能够将其进行区分。高婷等[31]的研究表明,黄芪属4个物种的ITS2二级结构在细节上存在差异。杨烁等[32]通过研究茄属药用植物的ITS2二级结构,表明ITS2二级结构可以提高鉴定效率。邵婧等[33]通过比较ITS2二级结构可以将茅苍术与菊科近缘种药材区分开来。本研究构建并比较了竹叶花椒及其近缘种药材的ITS2二级结构,通过比较其茎环结构的细节差异可以将竹叶花椒及其近缘种进行区分。
通过K2P遗传距离和NJ聚类树可以看出,竹叶花椒、花椒、野花椒三者之间的遗传关系较接近,而青花椒与三者间的遗传关系较远。这与植物形态分类学的观点是一致的:竹叶花椒、花椒、野花椒同属花椒亚属(Subgen.Zanthoxylum),而青花椒属崖椒亚属(Subgen.Fagara)。结果表明,DNA条形码技术也可以为植物形态分类学服务。

