蜘蛛香环烯醚萜类成分对急性脊髓损伤大鼠神经细胞焦亡的影响
王静怡,尹杰,刘建成,庞日朝,王文春
1.西南交通大学医学院,四川成都市 610031;2.中国人民解放军西部战区总医院康复医学科,四川成都市610083
脊髓损伤是一类极具危害的神经系统疾病,生活中常由高处跌落、摔倒和车祸等外界因素造成,一旦发生,会在损伤部位产生瞬间损害,继而引发损伤节段以下神经感觉传导受阻或缺失以及运动功能障碍的产生[1-2]。脊髓损伤极高的致残率,对患者的身心健康、生活质量及其家庭乃至社会带来严重影响[3-4]。同时,脊髓损伤在全世界范围内发病率较高,每百万人口中约有10.4~83例[5]。目前临床上仍未找到适用于脊髓损伤的确切、安全及有效的治疗方法[6]。因此,寻找有效的药物用于脊髓损伤治疗意义重大。
中草药蜘蛛香的应用历史极为久远,其环烯醚萜类主要成分已被发现在抗焦虑[7-8]、抗抑郁[9]、抗氧化[10]和神经保护[11]等方面有积极作用。蜘蛛香环烯醚萜类可促进伤后大鼠运动功能的恢复,改善继发性炎症反应以及氧化应激等病理程度[12-13]。而对急性脊髓损伤继发性损害的减轻一直是研究的要点,炎症反应作为继发损害的关键因素之一,会产生大量促炎因子白细胞介素(interleukin,IL)-1β、IL-18,以及蛋白酶等加速神经细胞的死亡[14]。焦亡是目前细胞炎性死亡的研究热门方向,在脊髓继发性损伤发生后,细胞内外的毒性分子会诱导炎性体的形成,其中报道较多的炎性小体是NLRP3,一旦被激活可触发下游分子的活化,引发细胞焦亡,释放更多的炎性因子,放大炎症效应[15]。蜘蛛香环烯醚萜类在脊髓损伤后对继发性炎症的抑制,是否与减轻神经细胞焦亡有关是个值得探讨的问题。
本研究旨在观察蜘蛛香环烯醚萜类在急性脊髓损伤后对神经细胞焦亡的影响,以发现该药物在神经保护方面的更多可能机制,为蜘蛛香药物在脊髓损伤的临床应用提供更多基础理论依据。
1 材料与方法
1.1 实验动物及分组
健康雄性Sprague-Dawley 大鼠24 只,体质量250~280 g,购于成都达硕生物科技有限公司,动物生产合格证号SCXK(川)2015-030。保持饲养环境清洁及通风,室温(22±2)℃,空气相对湿度为60%,12 h 明暗交替,自由饮食。
随机数字法将大鼠分为假手术组、模型组和治疗组,每组8只,每笼4只分笼饲养,适应性喂养1周后造模。本实验所有操作均遵循中国人民解放军西部战区总医院伦理委员会的相关标准。
1.2 主要试剂及仪器
1.2.1蜘蛛香药物
于贵州省遵义市药材市场进行采购,由西南交通大学生命科学学院宋良科副教授鉴定为蜘蛛香药材,储存在阴凉通风处[16]。
1.2.2主要试剂
一步法TUNEL检测试剂盒(绿色荧光):江苏凯基生物技术股份有限公司。大鼠IL-1β和IL-18 ELISA 检测试剂盒:上海江莱生物科技有限公司。重组GSDMD 抗 体(ab219800)、NLRP3 抗 体(ab214185)、pro Caspase1+p10+p12 抗体(ab179515)、HRP 标记羊抗兔IgG 抗体(ab6721):美国ABCAM 公司。GAPDH 抗体(10494-1-AP):武汉三鹰生物技术有限公司。
1.2.3主要仪器
医用动脉瘤夹:德国贝朗。施夹钳:德国雷伯公司。精密电子天平:瑞士PRESRCA。冰冻切片机:美国ThermoFisher 仪器有限公司。酶标仪:日本SANYO 公司。高速冷冻离心机:美国THERMO 公司。荧光显微镜:德国ZEISS。DYY-6C 电泳仪、UVTransilluminator 化学发光凝胶成像仪:美国BIORAD公司。
1.3 方法
1.3.1药物制备
药物提取方法参考孙勇[9]的文献。称取蜘蛛香药材初步研磨为粉,经70%乙醇作两次浸提处理:粗粉8 倍量乙醇浸泡1 d,收集浸液;换6 倍量乙醇继续浸泡粗粉残渣12 h;收集全部浸液进行减压浓缩处理得粗浸膏。纯化过程利用大孔树脂进行,所得洗脱液进一步减压浓缩,40 ℃真空干燥处理得浸膏。高效液相色谱分析法测得蜘蛛香环烯醚萜类成分的纯度为71.5%。
药物溶液(1 mg/ml)配制:称取上述提取物0.5 g,以0.5%羧甲基纤维素钠(CMC-Na)溶液作为溶质进行超声震荡溶解,使蜘蛛香药物在其中均匀混悬,继续加入CMC-Na 溶液定容到500 ml,得到青黄色混悬液。4 ℃密封避光保存。
1.3.2模型制备
采用标定闭合力为70 g 的医用动脉瘤夹钳夹大鼠T10脊髓制备急性脊髓损伤模型。
模型组和治疗组麻醉后,剔除周围体毛,在操作台上将大鼠俯卧固定。先确定T10棘突位置,再沿背部中线做纵向切口约3 cm,逐层分离皮肤及皮下肌肉组织,暴露T9~T11脊椎,去除椎板,将T10脊髓背侧硬脊膜完全暴露出来。手持施夹钳装固好动脉瘤夹,从垂直于大鼠脊髓的方位由T10脊髓侧边置入,使完全横跨T10脊髓,松开施夹钳,钳夹10 s 后撤出动脉瘤夹。手术部位经常温生理盐水冲洗后用棉球吸除溶液,缝合消毒。
假手术组除脊髓不做钳夹损伤,其他操作同前。
造模成功的标志为钳夹脊髓时出现大鼠双后肢抽搐,尾部痉挛性摆动,且术后观察大鼠后肢为完全瘫痪状态,伴有膀胱功能障碍。
1.3.3术后护理及干预
术后密切关注大鼠生命体征,大鼠自主排尿功能丧失,需每天人工辅助导尿3 次,至膀胱功能恢复。前3 天每天腹腔注射青霉素20 万U。整个饲养期间注意勤换垫料,清洗擦拭大鼠腹部及后肢,保持干燥。
术后4 h 待大鼠苏醒,生命体征稳定,进行灌胃给药,每天1次,连续7 d。治疗组灌胃配置好的蜘蛛香环烯醚萜类溶液10 mg/kg[12]。模型组和假手术组灌胃同等剂量CMC-Na溶液。
1.3.4观察指标及检测
1.3.4.1HE染色
每组选取4 只大鼠采集脊髓组织制备病理切片。选用经心灌注固定取组织的方法[17],10%水合氯醛3.5 ml/kg 腹腔注射麻醉,仰卧固定在手术台上,打开胸腔使心脏完全暴露,由左心室剪开一小口插入灌注针,先以生理盐水约150 ml快速灌流15 min左右,再换用4%多聚甲醛固定液继续灌注固定,调整流速先快后慢直至大鼠躯干四肢及尾部僵硬时停止。取材时以T10损伤处为中心,截取其前后0.5 cm 范围脊髓组织,总长约1 cm,放置于固定液中,4 ℃过夜。待组织梯度脱水完毕后,OCT包埋,冰冻切片机切片,厚15 μm,后行HE 染色。于台式显微镜下观察组织全貌,再换病理显微镜20、40倍物镜下观察损伤区病理情况。使用Image-Pro Plus 6.0 图像分析系统计算每张切片上脊髓组织损伤空洞部分单位面积占比。
残存面积所占百分比=(1-损伤部位空洞面积占比)×100%
1.3.4.2TUNEL荧光染色
选取制备好的切片,TUNEL 染色实验步骤根据试剂盒产品说明书进行。切片经固定通透等预处理后,按照说明书配制反应混合液,依步骤进行滴加。染色封片后在荧光显微镜下进行镜检,在高倍镜下,每张切片选取6 个视野用于测定TUNEL 阳性(绿色)和细胞核(DAPI,蓝色)数。

1.3.4.3ELISA
每组取4 只大鼠用于取血,麻醉后,促凝管心尖取血3 ml左右,离心取上清进行检测。具体实验步骤按照ELISA 试剂盒产品说明书进行。血清及试剂恢复至室温后,在包被IL-1β、IL-18 抗体的96 孔板中分别加入相应反应试剂及样品,反应完毕后立即使用酶标仪测量其吸光度,于450 nm 波长下读取记录相应数值,制作标准曲线,计算浓度。
1.3.4.4Western blotting
选取4只取新鲜脊髓。麻醉后,快速截取以T10脊髓损伤处为中心的1 cm长组织,根据蛋白提取试剂盒说明加入裂解液及相应蛋白酶抑制剂,剪碎后用匀浆器进行匀浆,涡旋10 s静置5 min,重复3次,全过程在冰上进行,之后离心取上清。BCA试剂盒测定蛋白浓度。将蛋白上样缓冲液按稀释比例加入蛋白上清中,混匀后煮沸10 min,按20 μg上样进行SDS-PAGE蛋白凝胶电泳,以初始电压80 V 进行电泳,大约30 min 后蛋白迁移到分离胶时转120 V 电压继续电泳,直至分离出目标蛋白或蛋白电泳至凝胶底部。之后根据目标蛋白大小,使用PVDF 膜以恒流300 mA 进行转膜,5%脱脂牛奶封闭1 h,加入一抗(NLRP3 1∶1000;Caspase-1 1∶1000;GSDMD 1∶1000),室温下摇床孵育1 h 后,转入4 ℃静置过夜。隔天取出,摇床复温1 h,TBST 洗去多余一抗,10 min 3 次,之后加入二抗(1∶1000),继续在摇床上孵育1 h,洗去多余二抗后ECL显影。在凝胶成像系统中测定目标条带的光密度值,目的蛋白相对表达含量为其积分光密度值比内参(GAPDH)积分光密度值。
1.4 统计学分析
采用SPSS 22.0 进行统计学分析。计量资料采用Shapiro-Wilk 检验进行正态分布检验,服从正态分布以()表示,采用单因素方差分析,并用LSD-t检验进行两两组间比较。不服从正态分布或方差不齐则采用秩和检验,并对结果进行校正。显著性水平α=0.05。
2 结果
2.1 HE染色
假手术组脊髓组织未见病变,其结构完好,内部无坏死空洞产生,灰白质结构正常,神经元结构完整,形态及分布正常,无显著的炎性细胞浸润出现。模型组脊髓组织发生一定程度的组织结构病变,出现大量神经元坏死及组织空洞,部分灰白质结构模糊,神经元构造分布紊乱,伴有大量炎性细胞浸润,与假手术组相比,残余组织面积减少(P<0.05)。与模型组比较,治疗组脊髓组织的坏死程度及空洞范围相对较小,伴有少量炎性细胞浸润,脊髓组织残余面积增加(P<0.05)。见表1、图1。
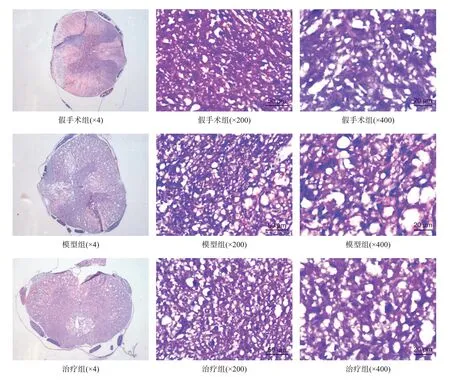
图1 各组术后7 d脊髓组织HE染色

表1 各组脊髓组织残余面积比较(%)
2.2 TUNEL荧光染色
假手术组绿色荧光强度极弱。与假手术组比较,模型组TUNEL 染色阳性率增加(P<0.05);与模型组比较,治疗组TUNEL 染色阳性率减少(P<0.05)。见表2、图2。

图2 各组术后7 d脊髓组织TUNEL染色(×400)

表2 各组脊髓组织TUNEL染色细胞阳性率比较(%)
2.3 ELISA
与假手术组比较,模型组IL-1β 和IL-18 含量增加(P<0.05);与模型组比较,治疗组IL-1β和IL-18含量减少(P<0.05)。见表3。

表3 各组血清中IL-1β、IL-18含量比较(μg/ml)
2.4 Western blotting
与假手术组比较,模型组NLRP3、Caspase-1 和GSDMD 蛋白水平增加(P<0.05);与模型组比较,治疗组NLRP3、Caspase-1 和GSDMD 蛋白水平降低(P<0.05)。见图3、表4。
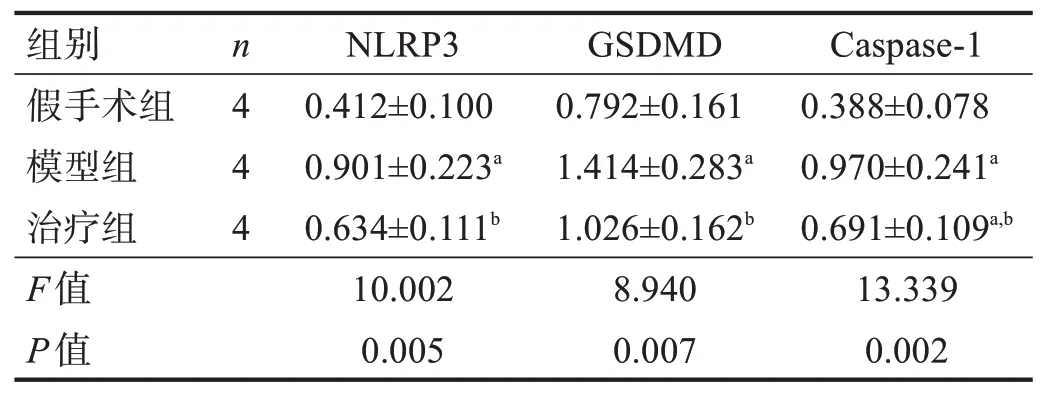
表4 各组焦亡蛋白的相对含量(/GAPDH)

图3 各组术后7 d脊髓组织三种焦亡蛋白的表达(Western blotting)
3 讨论
脊髓损伤的病理过程通常可分为原发性损伤和继发性损伤两个阶段[18]。原发性损伤是创伤暴力实施的瞬间直接对组织产生的破坏,导致血管破裂、轴突断裂和神经细胞死亡等,是一不可逆过程[19]。继发性损伤以原发性损伤为基础,是在其后即刻诱导发生的一系列细胞和分子的生物学级联反应,可在受创最初的数分钟内发生,根据病理进程分为急性期(数分钟~14 d)、中期(14 d~6 个月)和慢性期(>6 个月)[20]。在急性期内,受损细胞释放胞内离子、活性蛋白及细胞因子等引发氧化应激、兴奋性中毒、炎症级联反应等,加速受损部位神经细胞死亡[21]。细胞死亡的形式有多种,常见有自噬、凋亡、坏死和焦亡等,但哪个起主导作用尚未明确[22]。目前研究表明焦亡在细胞死亡中可能有较重要的作用[21,23]。在脊髓损伤中主要表现在继发性损伤阶段,此过程中产生触发机体免疫反应的损伤有关分子模式(damage-associated molecular patterns,DAMP),可由胞膜上特异性识别这些模式的受体(pattern recognition receptors,PRRs)所识别,如NLRP3 炎性小体的C 端结构域具有重复的赖氨酸序列即为DAMP的识别位点,一经结合活化,可触发下游以Caspase-1为主导的细胞焦亡产生。
细胞焦亡为近年来提出的一种新型细胞程序性死亡的方式,直观表现为DNA 片段化,核固缩,细胞器变形解体,胞膜穿孔,细胞不断胀大直至细胞膜破裂,导致胞内的内容物释放进而引起强烈的炎症级联反应。该概念于2001 年由Cookson 等[24]首次定义提出。细胞焦亡的发生发展需要依赖Caspase 的参与,主要分为两个途径:依赖Caspase-1 的经典细胞焦亡途径和Caspase-4/5/11介导的非经典途径[25]。在经典途径中,各种内源或外源性因素刺激细胞产生DAMP或病原相关分子模式(pathogen-associated molecular patterns,PAMP),导致胞浆中的PRRs,如核苷酸结合寡聚化结构域样受体(NOD-like receptors,NLRs)被激活。其中NLRP3 作为典型的NOD 样受体,激活后可通过其特定结构域与募集的细胞凋亡相关斑点样蛋白(apoptosis-associated speck-like protein,ASC) 和Caspase-1 前体分子结合,组装为炎性小体,进一步使得Caspase-1前体活化[26-27]。在胞内活化的Caspase-1分子一方面能够裂解IL-1β 和IL-18 前体使其加工成熟为具有活性的分子,另一方面能将GSDMD 切割为N 末端和C 末端两个结构域(N/C-terminal domain of GSDMD,GSDMD-NT/GSDMD-CT)。有活性的GSDMD-NT 通过与磷脂分子结合从而锚定在细胞膜上,在膜上形成10~15 nm 的小孔,具有活性的炎症因子如IL-18、IL-1β等通过膜孔释放,水分子通过膜孔进入,细胞肿胀破裂,最终发生焦亡[28-29]。在焦亡过程中释放的细胞促炎因子IL-1β、IL-18,能诱导炎性细胞的浸润以及激活NF-κB 炎症通路,会加重继发性炎症反应,引发大量神经细胞死亡[14],对脊髓组织的病理结构产生严重损害。
细胞焦亡与癌症[30]、自身免疫性疾病[31]、神经系统疾病[32-33]等的发生发展密切相关。NLRP3 作为细胞焦亡的重要分子,在脊髓损伤后可被活性氧、组织蛋白酶等神经毒性分子激活[34-35]。在有关大鼠脊髓损伤的研究中发现[36],小胶质细胞可表达大量NLRP3炎性小体。Dai 等[37]发现雷公藤红素可作用于NLRP3/Caspase-1 通路抑制神经细胞焦亡,利于脊髓损伤大鼠的后肢运动功能改善和恢复,并减少脊髓组织的空洞面积和神经细胞丢失。这些研究说明NLRP3 相关通路在脊髓损伤后的细胞焦亡中发挥关键作用。前期有关大鼠脊髓损伤研究中,蜘蛛香环烯醚萜类灌胃治疗3 d可激活Nrf2/ARE通路减轻脊髓损伤氧化应激反应,一定程度上降低体内活性氧含量[38],提示蜘蛛香环烯醚萜类药物可能通过减轻脊髓损伤后活性氧的过量累积对炎性小体NLRP3 的激活作用,在一定程度上抑制细胞焦亡。
目前,蜘蛛香环烯醚萜类成分已被证实在脊髓损伤中能发挥神经保护作用[12-13],涉及相关机制的研究较少,仅发现可能与调控Nrf2/ARE 通路减轻氧化应激有关[38],更多机制仍待进一步探讨。本研究从细胞焦亡的角度出发,证实蜘蛛香环烯醚萜类成分可抑制脊髓损伤后细胞焦亡,减轻炎症,发挥神经保护作用,且与NLRP3/Caspase-1 这一经典细胞焦亡通路的调控相关,但具体的调控方式、抑制神经细胞焦亡的类型以及该药物影响焦亡的途径是否主要依赖此通路还需进一步研究。
利益冲突声明:所有作者声明不存在利益冲突。

