大鼠良性前列腺增生模型的建立及评估
王文地,郑玉婷,马 允,张玥辉,崔 洁,侯俊玲,3*,王文全,,3*
(1.北京中医药大学中药学院,北京 102488;2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193;3.中药材规范化生产教育部工程研究中心,北京 102488)
良性前列腺增生(BPH)是中老年男性常见疾病,且随着年龄的增长发病率逐渐增加,80岁以上发病率高达69.2%[1-2]。前列腺增生临床表现为梗阻性或刺激性症状,严重时会导致血尿、膀胱结石和肾功能衰竭[3-4]。目前用于体内研究的BPH模型有异种移植模型、转基因小鼠模型、激素诱导模型、自发(猩猩/狗)模型[5],其中外源性丙酸睾酮(TP)诱导的BPH大鼠模型由于其操作方便,在国内外研究中广泛使用,但目前仍缺少对TP注射量的相关研究。本文旨在针对外源性激素诱导大鼠BPH模型进行探讨,明确其对前列腺产生的影响,以血清双氢睾酮(DHT)、胰岛素样生长因子-1(IGF-1)、表皮生长因子(EGF)和BCL-2相关X蛋白(Bax)表达水平作为判断是否建模成功的指标,补充TP注射量的相关研究;同时考虑到泌尿系统病变是前列腺增生的潜在并发症,在传统BPH模型成功因素的基础上增加了肾功能检测,观察外源性睾酮诱导模型对大鼠肾功能的影响,以补充验证该模型是否同样具备这一临床症状。本研究还以建模完成后1个月为时间节点,探索该模型维持时间及造模对大鼠体质量、脏器指数的影响与机体自行恢复情况。
1 仪器与材料
1.1仪器 3K15型台式离心机(德国Sigma公司);FA2004N型电子分析天平(北京赛多利斯科学仪器有限公司);120型全自动生化仪(日本东芝公司);TEK-Ⅱ mini型血细胞分析仪(江西特康公司);Multiskan FC型酶标仪(上海赛默飞世尔仪器有限公司);JJ-12J型脱水机和JB-P5型包埋机,均购自武汉俊杰电子有限公司;RM2016型病理切片机(上海徕卡仪器有限公司)。
1.2试药 丙酸睾酮注射液(批号080231055),哈尔滨三马兽药业有限公司;尿素氮(UREA)、肌酐(CREA)和血糖(GLU)(批号分别为20190701、20190901、20190901),北京北检新创源生物技术有限公司;双氢睾酮(DHT)、表皮生长因子(EGF)、胰岛素样生长因子-1(IGF-1)和BCL-2相关X蛋白(Bax)试剂盒(批号分别为ml002998、ml003029、ml202807、ml2544569),上海酶联生物科技有限公司;水合氯醛(批号20181017),天津市福晨化学试剂厂;100 mL·L-1中性甲醛溶液(批号20181212),北京益利精细化学品有限公司。
1.3实验动物 SPF级SD大鼠40只,雄性,体质量为280~320 g,由斯贝福(北京)生物技术有限公司提供,许可证编号:SCXK(京)2019-0010,动物被安置在(22±2) ℃、相对湿度为55%±5%的层流气流室中。在12 h明暗交替的循环中,给大鼠提供标准的实验室饮食和随意饮水,所有SD大鼠均于常规条件下适应性饲养1周后用于实验。
2 方法
2.1TP诱导模型的成模剂量考察实验 将24只雄性SD大鼠适应性饲养1周后随机分为对照组以及TP低、中、高剂量组,每组6只,分笼喂养。造模期间,对照组皮下注射大豆油(0.001 mL·g-1),TP低、中、高剂量组分别皮下注射16.7、33.3、50.0 mg·kg-1的TP,2 d 1次,连续4周。在最后1次治疗后禁食24 h,腹主动脉取血,处死大鼠。切除前列腺,称定质量,用100 mL·L-1中性甲醛溶液固定,进行常规组织处理和HE染色。所有血样静置2 h后以4 000 r·min-1离心10 min,收集血清,于-80 ℃条件下储存,根据DHT、EGF、IGF-1和Bax的Elisa试剂盒说明书检测各组大鼠血清中各指标的表达水平,并用全自动生化仪检测血清中CREA、UREA和GLU的表达水平。
2.2大鼠BPH模型评价实验 将16只雄性SD大鼠,适应性饲养1周后随机分为对照组(处理方法同2.1项下)和TP高剂量组,每组8只,分笼饲养。造模4周,每组随机选取4只大鼠于末次给药后禁食24 h,处死,将此时间节点记为实验第4周。其余4只大鼠留置28 d恢复期,期间记录每周体质量,处死,将此时间节点记为实验第8周。仔细采集各组大鼠前列腺、肝脏、肾脏、睾丸、脾脏和胸腺,称定质量,计算脏器指数(脏器指数=脏器质量÷体质量×100%)。大鼠血清处理方法同2.1项下。
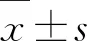
3 结果与分析
3.1TP诱导大鼠前列腺组织变化 前列腺指数是判断BPH造模成功与否的重要指标。注射4周后,TP高、中、低剂量组的前列腺指数均显著高于对照组。BPH的临床病理学特征是前列腺基质细胞和上皮细胞增殖[6-8],不同剂量TP诱导对前列腺形态的影响见图1。由图1可知,对照组前列腺组织学表现正常,上皮细胞呈立方或柱状。TP高、中、低剂量组前列腺均显示腺体结构较差,有严重的细胞增生和坏死病变;TP低剂量组上皮细胞层和基质细胞间隙均大于对照组,前列腺内可见空泡;TP中剂量组腺体中度增生;TP高剂量组前列腺组织的组织结构被破坏,上皮细胞及组织间隙严重增生。3个不同剂量组间比较,TP高剂量组间质细胞增殖程度高。

图1 TP对大鼠前列腺组织病理学变化的影响 (HE染色,×200)
3.2不同剂量TP诱导的大鼠血清生化因子变化情况 以血清DHT、EGF、IGF-1和Bax表达水平为指标,对TP低、中、高剂量组大鼠进行比较研究,筛选适宜成模剂量,见表1。由表1可知,BPH与体内性激素的代谢密切相关,特别是与雄激素受体结合的DHT,可刺激前列腺间质和腺体的增生[9-10]。与对照组相比,TP高剂量组血清DHT水平显著升高,而TP中、低剂量组则无显著差异。有研究认为,DHT能够调节生长因子并通过旁分泌信号诱导增殖[11-12]。研究发现,IGF-1可促进前列腺上皮细胞有丝分裂[13],EGF也可通过作用于前列腺细胞膜上的受体促进细胞分裂[14]。TP高、低剂量组的IGF-1和EGF的水平均显著高于对照组,而TP中剂量组则显著低于对照组。除了生长因子的作用外,研究发现BPH与细胞凋亡异常减少也有一定关联[15-16]。与对照组相比,TP高、中剂量组的Bax表达水平明显较低,而与TP低剂量组比较则无明显差异。综上所述,皮下注射50.0 mg·kg-1TP是制备非去势大鼠BPH模型的适宜剂量。

表1 TP低、中、高剂量组血清检测指标对比结果
3.3造模对大鼠肾功能的影响 基于BPH造型成功性考察中相关生化因子结果,对比TP高剂量组大鼠与对照组间肾功能因子表达水平,观察DHT诱导对肾脏的影响,见表2。在临床检验中,血清GLU、UREA和CREA的表达水平常作为肾功能是否异常的评价指标[17]。由表2可知,TP诱导4周后,TP高剂量组肾脏指数显著高于对照组,CREA和GLU表达水平显著低于对照组,UREA表达水平与对照组比较差异无统计学意义。结果表明,在50.0 mg·kg-1剂量下制备BPH模型对大鼠肾脏功能有一定影响。

表2 TP高剂量组对肾功能的影响
3.4模型维持时间的评价 见表3。由表3可知,实验第4周,TP高剂量组大鼠的前列腺指数和DHT表达水平均显著高于对照组。实验第8周,TP高剂量组大鼠前列腺指数仍明显高于对照组,但DHT表达水平与对照组比较差异无统计学意义。TP高剂量组大鼠DHT表达水平在28 d后恢复正常,表明该模型维持时间少于28 d。

表3 2个不同时间点前列腺指数与DHT检测结果
3.5造模对大鼠体质量影响的评价 见表4。由表4可知,在皮下注射期间,从实验第2周开始,TP高剂量组大鼠体质量显著低于对照组;实验第8周,TP高剂量组大鼠体质量仍显著低于对照组,但差异逐渐减小。结果表明,TP诱导的BPH模型对大鼠体质量下降有影响,停药后逐渐恢复。

表4 模型评价研究的各周体质量变化
3.6造模对大鼠各脏器指数的影响 见表5。由表5可知,实验第4周,TP高剂量组肾脏指数和睾丸指数均明显高于对照组,胸腺指数和肝脏指数显著低于对照组,2组间脾脏指数比较差异无统计学意义。实验第8周,TP高剂量组肾脏指数仍显著高于对照组,而胸腺、睾丸、脾脏、肝脏指数与对照组比较差异无统计学意义。结果表明,注射TP使大鼠肾脏和睾丸指数增加,胸腺和肝脏指数降低,实验第8周,胸腺、睾丸、肝脏指数恢复正常,但肾脏指数并未恢复。

表5 2个不同时间点各脏器指数检测结果
4 讨论
建立完善的BPH大鼠模型可以为有效药物的选择奠定基础[18]。在本研究中,TP高剂量组的前列腺上皮细胞增厚,表现为前列腺增生,前列腺指数及血清中DHT、EGF和IGF-1的表达水平均明显高于对照组(P<0.05),Bax的表达水平显著降低(P<0.05),可能通过抑制细胞凋亡而延长细胞存活时间,表明皮下注射50 mg·kg-1TP可成功建立大鼠BPH模型。TP中剂量组与对照组比较差异无统计学意义(P>0.05),TP中、低剂量组血清Bax及DHT水平均与对照组比较差异无统计学意义(P>0.05),不能认为造模成功。BPH的发生被认为是雌激素和雄激素比例变化的结果[19-20],Mbaka G等[21]用交错剂量的外源性睾酮和雌二醇诱导大鼠前列腺增生。结合上述研究和本研究中TP低剂量组数据,考虑是否为内源性激素反馈效应。这一研究结果也进一步证实了剂量研究的必要性[22-24]。
有研究发现,雄激素及其受体通过激活肾素血管紧张素系统(RAS),导致炎症加重,对肾脏产生不利影响[25-26],而肾脏作为泌尿系统的重要器官,与前列腺增生密切相关,目前较少研究将肾功能作为参数之一。本研究检测了肾功能指标的变化,有助于更好地理解BPH的发病机制,并为解决其并发症制定新的策略[27]。此外,许多研究者设计药效学实验来筛选BPH药物,考虑到药物的肝肾毒性,但常常忽视模型本身可能引起的肝肾功能不全。本研究数据显示,TP诱导的BPH模型大鼠肾功能不全,肾脏指数较对照组显著升高(P<0.05),也会引起GLU、CREA水平异常降低(P<0.05)。
本研究结果显示,TP会引起大鼠体质量及胸腺、睾丸和肝脏指数异常(P<0.05),在实验第8周,该异常逐渐恢复,但肾脏指数仍高于对照组(P<0.05)。在实验第8周,检测大鼠前列腺指数及DHT表达水平,DHT表达水平已恢复正常(P>0.05)。因此,基于该模型进行药效学研究时,药物的治疗周期应尽量与造模同期进行,以降低造模后的机体自我恢复能力对实验结果产生假阳性影响。

