基于DNA “Y”型结构的指数型核酸恒温扩增策略检测microRNA
郑旭玲,殷 文,陈 俊,李 裕,戴 宗,邹小勇
(1.中山大学 化学学院,广东 广州 510275;2.中山大学 生物医学工程学院,广东 广州 510006;3.南方医科大学 药学院,广东 广州 510515)
成熟的microRNA(miRNA)是一类长度约为19~23个碱基的非编码RNA[1]。诸多证据表明,miRNA在包括细胞分化、早期发育、增殖、凋亡等众多生命活动过程中均发挥重要的调控作用[2-3],其表达水平与许多疾病密切相关,可作为疾病标志物和用于基因治疗以及作为潜在的药物靶点[4]。开发可靠、简单、高效的miRNA检测方法对于疾病的早期诊断具有重要意义。
近年来,基于核酸恒温扩增策略的miRNA检测方法获得极大发展,如滚环扩增[5]、杂交链反应[6]、环介导等温扩增技术[7]等线性扩增反应被成功应用于miRNA定量分析和细胞成像分析。相比之下,指数扩增反应(EXPAR)是一种在短时间可获得高扩增效率(106~109)的核酸恒温扩增方法,为miRNA的快速有效检测带来了便利[8]。EXPAR方法通常采用一个含两段重复序列的对称DNA模板,目标序列与模板的3′端互补杂交后,在聚合酶的作用下沿着模板延伸;延伸出的双链DNA包含切口酶识别序列,被切口酶切割,并在DNA聚合酶的链置换作用下被释放出来,进一步与另一条模板的3′端进行杂交和扩增,形成指数形式的扩增[9]。但这些方法存在如下问题:(1)扩增特异性和扩增效率仍有待提高。miRNA的准确分析有赖于扩增方法的效率和特异性。当前的扩增方法,指数扩增的效率很高,但更高阶的扩增方法很难获得;为提高扩增效率,往往需要复杂的设计和多扩增模板共同参与,且易产生非特异性扩增。(2)扩增反应的序列依赖性问题有待解决[10-11]。在大多数核酸扩增反应中,扩增模板序列不同,往往导致靶标与模板的结合力改变,引起扩增效率改变。这一缺陷限制了方法的通用性,不利于对多目标物的同时检测。
针对上述问题,本文提出了一种基于“Y”型结构驱动的低序列依赖恒温指数扩增方法(Y-EXPAR)。根据目标miRNA的识别序列设计两个模板,两部分互补的模板与目标miRNA形成Y型结构,在DNA聚合酶和Nt.BstNBI内切酶作用下,引发双向恒温指数扩增,实现miRNA的快速检测分析。let-7b在细胞过程和人类疾病中扮演着重要角色,在肺癌、乳腺癌等几种人类恶性肿瘤组织中呈低水平表达,且与其他let-7家族成员仅存在1~4个碱基差异[12-13]。本研究以let-7b为目标miRNA模型,探究了Y-EXPAR方法的检测灵敏度、特异性和抗干扰性,以及在检测不同CG含量的目标miRNA时的序列依赖性,并将本策略应用于A549细胞裂解液中let-7b表达量的检测。相比于传统线性和恒温指数扩增方法,本策略能有效解决序列依赖性问题,且提高了扩增效率。
1 实验部分
1.1 试剂与材料
DEPC处理水(Diethyl pyrocarbonate)、dNTPs、蛋白酶K和RNA酶抑制剂(上海生工生物工程公司);寡聚核苷酸链的合成(序列如表1所示,上海生工生物工程公司);Vent(exo-) DNA聚合酶、Nt.BstNBI限制性内切酶、10×Nt.BstNBI buffer(25 mmol/L Tris-HCl,pH 7.9,50 mmol/L NaCl,5 mmol/L MgCl2,0.5 mmol/L EDTA)、10×ThermoPol buffer(10 mmol/L KCl,10 mmol/L (NH4)2SO4,20 mmol/L Tris-HCl,pH 8.8,2 mmol/L MgSO4,0.1% Triton X-100)(北京纽英伦生物技术有限公司);SYBR Green I(北京百泰克生物技术有限公司);胎牛血清、链霉素、青霉素、胰蛋白酶和RPMI 1640培养基(美国Gibco);人类肺癌细胞(A549,中国科学院上海生命科学研究院细胞资源中心)。

表1 本实验中所用的核酸碱基序列*Table 1 Sequences of the oligonucleotides used in this work*
1.2 实验方法
1.2.1Y-EXPAR方法的建立取离心管置于冰上,分别配制A和B溶液。A溶液包含目标miRNA、扩增模板T1和T2、dNTPs、RNA酶抑制剂和Nt.BstNBI buffer。B溶液包含ThermoPol buffer、Vent(exo-) DNA聚合酶、Nt.BstNBI限制性内切酶和SYBR Green I。A和B溶液准备好后立即混合,加入适量DEPC处理水使溶液总体积为10 μL。体系中有0.5×Nt.BstNBI buffer,1×ThermoPol buffer,0.1 μmol/L T1,0.075 μmol/L T2,1 000 μmol/L dNTPs,0.06 U/μL Vent(exo-) DNA聚合酶,0.4 U/μL Nt.BstNBI 内切酶和 0.4 μg/mL SYBR Green I。将混合溶液放在CFX Connect Real-Time System 实时定量PCR仪(Bio-Rad,USA),温度设置为45 ℃,实时荧光强度的检测时间间隔为30 s。
1.2.2EXPAR方法检测miRNA 参考相关文献[8],本实验基于EXPAR检测miRNA的步骤如下:取离心管置于冰上,分别配制C和D溶液。C溶液包含目标miRNA、扩增模板T7、dNTPs、RNA酶抑制剂和Nt.BstNBI buffer。D溶液包含ThermoPol buffer、Vent(exo-) DNA聚合酶、Nt.BstNBI限制性内切酶、SYBR Green I和DEPC处理水。C和D溶液准备好后立即混合,溶液总体积为10 μL。体系中有0.5×Nt.BstNBI buffer、1×ThermoPol buffer、0.1 μmol/L T7、250 μmol/L dNTPs、0.05 U/μL Vent(exo-) DNA聚合酶、0.4 U/μL Nt.BstNBI内切酶和0.4 μg/mL SYBR Green I。将混合溶液放在CFX Connect Real-Time System实时定量PCR仪(Bio-Rad,USA),温度设置为55 ℃,实时荧光强度的检测时间间隔为30 s。
1.2.3细胞培养使用含有10%(体积比)胎牛血清(FBS)、100 μg/mL链霉素和100 U/mL青霉素的RPMI 1640 培养基,并在37 ℃含5% CO2的湿润环境中培养A549细胞。
1.2.4细胞收集和裂解使用胰蛋白酶消化,以1 000 r/min离心5 min除去培养基收集A549细胞系。将细胞用RPMI-1640彻底清洗3次,加入RPMI-1640得到细胞浓度约1 000个/μL的重悬液,用RPMI-1640将悬浮的细胞溶液逐级稀释至所需浓度。取1 μL细胞溶液放入置于冰上的0.2 mL PCR管,管中装有0.9% NaCl溶液和40 U/mL RNase抑制剂,将细胞样品迅速放入液氮中冷冻2 min后在98 ℃下热处理3 min,再浸入液氮中,反复3次,使细胞膜破裂。为消化与miRNA结合的蛋白,将样品与1 U蛋白酶K和10 U RNase抑制剂于53 ℃下孵育1 h,再于85 ℃下孵育20 min使蛋白酶解。处理后的细胞裂解液放在液氮中保存。
2 结果与讨论
2.1 实验原理
本文以let-7b为目标miRNA模型,Y-EXPAR方法的原理如图1所示。设计两个DNA单链模板,模板T1的c序列和模板T2的c′互补,T1的b′与目标miRNA(let-7b)中的b互补,T2的a′与目标miRNA中的a互补。当目标miRNA存在时,T1、T2和目标miRNA三者的互补序列杂交形成“Y”型结构。在DNA聚合酶和dNTPs作用下进行双向延伸,目标miRNA沿T1从5′端向3′端延伸形成DNA双链,T1则沿T2延伸,两个方向延伸形成的双链DNA中均产生Nt.BstNBI内切酶的识别位点,引导内切酶进行剪切后,具有链置换活性的DNA聚合酶从切口的3′端继续延伸,置换释放与d互补的寡核苷酸d′。第一轮扩增,1个目标miRNA理论上产生2个d′序列;第二轮扩增,“Y”型结构重复“扩增-剪切-释放”的过程,同时,2个d′序列与体系中剩余的模板T1和T2结合,在DNA聚合酶和Nt.BstNBI内切酶作用下理论上扩增产生2个d′,共产生4个d′;依次类推,第三轮扩增将释放8个d′,第n轮扩增释放2n个d′,实现d′序列的指数扩增。利用荧光染料SYBR Green I与双链DNA的特异性结合,可定量体系中生成的双链DNA,通过实时荧光变化检测扩增过程积聚的产物。该Y-EXPAR方法操作简便,可在45 ℃的恒温下进行;相比传统EXPAR方法,扩增效率更高,可快速对目标miRNA进行检测;“Y”型结构的设计将目标miRNA的扩增转化为以已知序列为触发剂的扩增,摆脱目标序列不同对扩增反应的影响,有效避免序列依赖性,提高对不同miRNA检测的适用性。方法有望在miRNA以及短链核酸分析方面提供高效快速的通用分析方法。
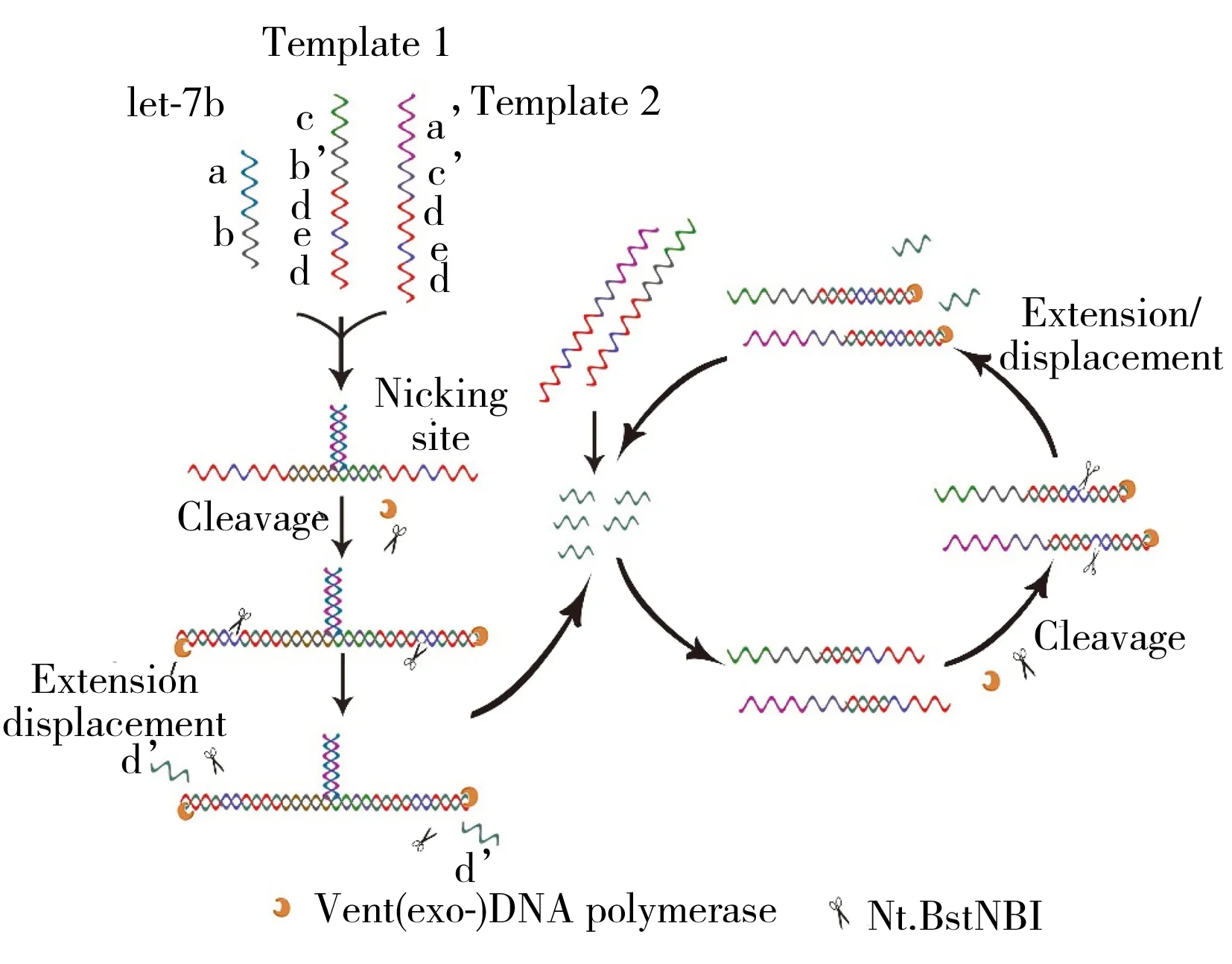
图1 Y-EXPAR方法的原理图Fig.1 Principle scheme of Y-EXPAR method
2.2 “Y”型结构对扩增速率的影响
配制相同浓度的let-7b溶液,以T1和T2为模板进行Y-EXPAR反应,使用T7为模板进行EXPAR反应。如图2所示,EXPAR反应和Y-EXPAR反应的荧光强度均随时间增加而指数升高。不同的是,相比EXPAR,Y-EXPAR能够更快进入指数扩增阶段,显著缩短反应所需总时间。指数扩增反应的扩增速率可以用POI值(Point of inflection,POI)表示,即实时荧光曲线的最大斜率处(拐点)所对应的时间。
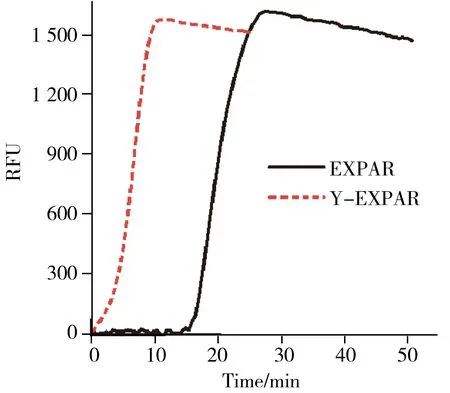
图2 EXPAR和Y-EXPAR方法响应1 pmol/L let-7b的实时荧光曲线图Fig.2 Real-time fluorescence curves of EXPAR and Y-EXPAR in response to 1 pmol/L let-7b,respectively
Y-EXPAR反应的POI值为7,EXPAR的POI值为18.5,表明Y-EXPAR具有更高的扩增效率。因为在EXPAR方法的第一轮扩增中,let-7b与单链模板T7结合后,DNA聚合酶以dNTPs为底物,使let-7b沿着模板T7延长形成双链,内切酶剪切后产生等量寡核苷酸。相比之下,Y-EXPAR反应在第一轮扩增中,let-7b与两个模板T1、T2共同形成“Y”型结构,从两个方向同时进行扩增,经过内切酶的识别和切割,能够释放双倍数量的寡核苷酸d′序列,引发更多的指数扩增反应,促使反应速率增高。
2.3 Y-EXPAR方法的可行性分析
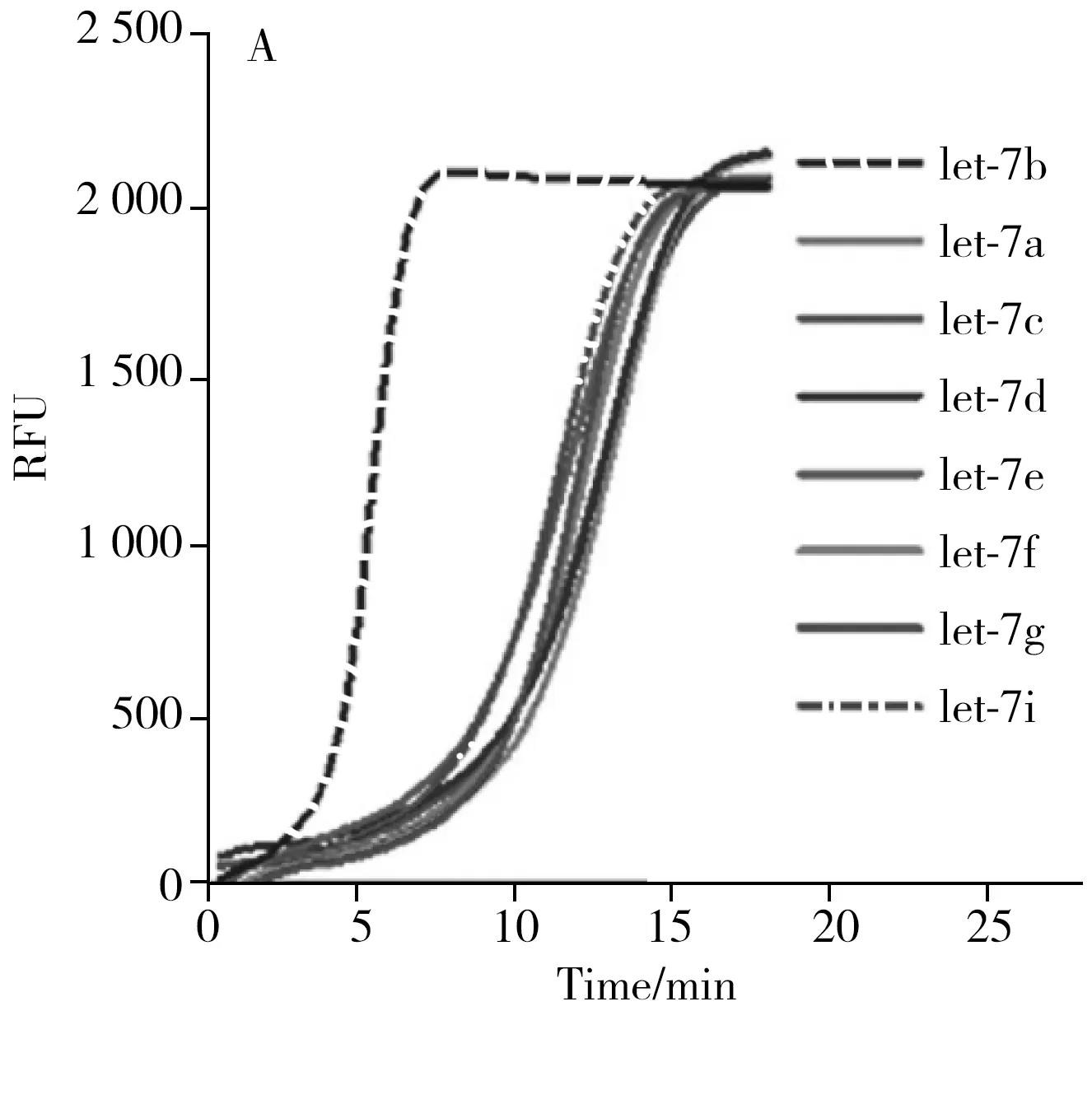
miRNA同源家族中的成员序列相似度高[14],因此,对miRNA的检测需方法具有高特异性。为探究Y-EXPAR的特异性,本文使用let-7家族的不同成员进行测试。let-7家族成员的序列高度相似,let-7b与let-7c之间仅相差1个碱基,与let-7a、7d~7g、7i之间相差2~4个碱基。图3A以T1和T2为模板,Y-EXPAR方法分别响应浓度为100 pmol/L的let-7b,以及let-7x(let-7a、7c~7g、7i)所获得的实时荧光曲线。结果显示,响应let-7b的实时荧光曲线强度增速远快于响应let-7x的荧光曲线,表明let-7家族成员间虽然具有序列高度相似性,但Y-EXPAR方法仍能够有效区分let-7b与其他let-7家族成员,显示了较强的特异性。
POIx为let-7x实时荧光曲线的POI值,根据POI值与let-7b浓度的相关方程:POI=-2.10-0.710lgclet-7b(mol/L),可得到POIx对应的let-7b浓度。将该相对浓度记为Alet-7x。通过系数(I%)评估本方法的特异性,计算公式如式(1)[15]。浓度相同时,相比let-7b,let-7x产生的信号非常微弱,其中,let-7i对应的I最大,但也仅为3.54×10-7%,表明Y-EXPAR方法具有优异的特异性,可区分目标miRNA和相似序列。
(1)
Y-EXPAR方法还展现了良好的抗干扰性。将let-7b与let-7a、7c~7g、7i分别混合配制7种混合样品。混合体系中目标miRNA浓度为10 fmol/L,干扰miRNA浓度为其1 000倍,即10 pmol/L。利用Y-EXPAR方法对混合miRNA样品进行检测。如图3B所示,10 fmol/L的let-7b样品所对应的POIlet-7b约为8.00,含有干扰miRNA(let-7x)的混合样品对应的POIlet-7x在6.67~9.00之间。与前述方法相同,根据POI=-2.10-0.710lgclet-7b(mol/L),由POIlet-7b和POIlet-7x分别计算相对浓度Alet-7b和Alet-7x。通过计算系数(S%)评估let-7x对let-7b浓度检测产生的干扰,计算公式如式(2),系数越小特异性越强[15]。计算得S%为0.064%~7.47%。其中,let-7d和let-7g引起的干扰极小,分别为0.074%和0.064%,这是因为二者与let-7b相比均存在4个碱基错配。总体而言,Y-EXPAR方法具有良好的抗干扰性。
(2)
2.4 Y-EXPAR方法序列依赖性研究
EXPAR方法在检测不同miRNA时,扩增性能差别较大,其扩增效率在一定程度上依赖于模板序列[11]。Y-EXPAR中“Y”型结构的设计可降低目标miRNA序列变化对扩增效率的影响,改善序列依赖性问题。当目标miRNA不再是let-7b时,Y-EXPAR方法只需改变模板T1中的b′序列和模板T2中的a′序列,而T1中的c、d、e、d和T2中的c′、d、e、d无需变换。
CG的比例会影响双链的稳定性。模板/触发双链中CG含量低,熔解温度Tm值小,触发剂与模板结合力弱;反之,CG含量高,熔解温度Tm高,触发剂与模板容易结合,但新形成的触发剂难以解离[11]。使用CG含量不同的miRNA检验Y-EXPAR方法的序列依赖性。由let-7b的序列计算得知,let-7b的CG含量为45.5%。根据miRBase的数据[16],本文对48 885种miRNA的CG含量进行统计,筛选出CG含量较低和较高的miRNAs,并选择与人类相关的两种miRNAs:miR-374a和miR-762(CG含量分别为22.7%和90.9%,碱基数目均为22个,与let-7b相同)进行考察。
作为对照,本文根据EXPER方法的原理为let-7b、miR-374a、miR-762分别设计模板T7、T8、T9,其扩增结果如图4A所示。可以看到EXPER方法检测浓度为10 fmol/L的miR-374a、let-7b、miR-762时,获得的POI值差别明显,分别为7.00、18.8和34.5,说明即使是扩增原理相同,对于不同GC含量的核酸,扩增效果差异依然很明显。该差异会导致分析性能的明显变化。在10 fmol/L~100 pmol/L浓度范围内,let-7b的POI值随浓度增加逐渐下降,而miR-374a和miR-762的POI值则无明显变化。
相比之下,根据Y-EXPAR方法的测定原理,为miR-374a设计了模板T3和T4,为miR-762设计了模板T5和T6。如图4B所示,随着miRNAs浓度的增加,Y-EXPAR的扩增速率提高,let-7b、miR-374a和miR-762三种目标miRNA所对应的POI值均下降;在相同miRNA浓度下,let-7b、miR-374a和miR-762的POI值接近。实验结果表明,Y-EXPAR方法检测不同miRNA时,即使目标miRNA序列改变较大(GC值变化大),模板仍能保持良好的扩增性能。DNA聚合酶将核苷酸整合到延长链中的速率与DNA模板的序列相关[11]。在Y-EXPAR方法中,目标miRNA与两个模板形成“Y”型结构,扩增释放d′,接下来的指数扩增反应由触发剂d′引发。检测不同目标miRNA时,d′的序列无需改变,避免了DNA聚合酶和不同DNA序列相互作用时的差异,降低了Y-EXPAR的序列依赖性。

2.5 Y-EXPAR反应条件的优化
2.5.1反应温度Y-EXPAR方法中,反应温度不仅能影响Nt.BstNBI内切酶和Vent(exo-) DNA聚合酶活性,还影响目标miRNA与模板杂交形成“Y”型结构,触发剂与模板的结合,以及新合成的触发剂从模板上的解离等。因此,需要对Y-EXPAR的反应温度进行优化。由图5A可知,当温度为45 ℃时,实验组和空白对照组的实时荧光曲线的POI差值(ΔPOI)最大。因此,将45 ℃作为Y-EXPAR的最佳反应温度。
2.5.2Nt.BstNBI内切酶用量在Y-EXPAR方法中,Nt.BstNBI内切酶切割新生链,产生更多触发剂进入扩增循环。本文探究了Nt.BstNBI内切酶用量对Y-EXPAR方法检测性能的影响(图5B)。当Nt.BstNBI内切酶为0.04 U/μL时,let-7b与空白对照间的荧光响应区分最为明显,二者之间的ΔPOI最大,同时,Y-EXPAR方法保持较高反应效率;当Nt.BstNBI内切酶浓度增至0.05 U/μL时,Y-EXPAR方法的效率进一步提高,但let-7b与空白对照之间的荧光响应差异减小。因此,将0.04 U/μL作为Y-EXPAR反应中 Nt.BstNBI 内切酶的最佳酶量。
2.5.3Vent(exo-)DNA聚合酶用量根据实验原理可知,DNA聚合酶在Y-EXPAR方法中能够沿着模板延长互补链,并将切割后的DNA链置换下来。因此,DNA聚合酶用量将影响Y-EXPAR方法对miRNA的检测能力。如图5C可知,当Vent(exo-) DNA聚合酶浓度为0.04 U/μL时,Y-EXPAR的反应速度最慢;随着DNA聚合酶浓度增至0.06 U/μL,Y-EXPAR的反应效率加快,空白对照的非特异性信号也增强;继续增加Vent(exo-) DNA聚合酶浓度至0.08 U/μL和0.10 U/μL,Y-EXPAR的反应效率变化较小。根据ΔPOI和DNA聚合酶浓度的关系图,当DNA聚合酶为0.06 U/μL时,ΔPOI最大,表明let-7b产生的荧光信号与空白对照的非特异性信号相差最大,Y-EXPAR方法能更好地区分let-7b和空白对照。因此,将0.06 U/μL作为Y-EXPAR反应中Vent(exo-) DNA聚合酶的最佳酶量。

2.6 Y-EXPAR分析能力研究
本文以T1和T2为模板,在反应温度为45 ℃,Nt.BstNBI内切酶浓度为0.04 U/μL,Vent(exo-) DNA聚合酶浓度为0.06 U/μL的最佳实验条件下,对不同浓度的let-7b进行Y-EXPAR扩增。图6展示了各浓度let-7b产生的实时荧光曲线。随let-7b浓度的增加,扩增速率加快。如图6插图所示,在1 amol/L~10 nmol/L浓度范围,实时荧光曲线的POI值与let-7b浓度的对数值存在线性关系,线性方程为:POI=-2.10-0.710lgclet-7b(mol/L)(r2= 0.969)。本方法的检出限为0.3 amol/L,相当于10 μL溶液中约有1.8拷贝的let-7b;且在保持良好检测能力的同时,所需检测时间仅为10 min,比常规EXPAR所需时间更短。Y-EXPAR方法能够有效进行生物样品中miRNA的检测。
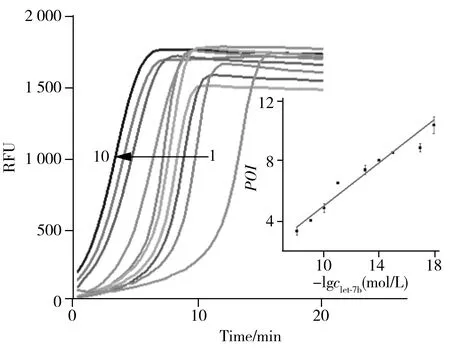
图6 Y-EXPAR响应不同浓度let-7b的实时荧光曲线图Fig.6 Real-time fluorescence curves of Y-EXPAR in response to different concentrations of let-7b let-7b concentration(1-10):blank,1 amol/L,10 amol/L,1 fmol/L,10 fmol/L,100 fmol/L,10 pmol/L,100 pmol/L,1 nmol/L,10 nmol/L;insert:plot of corresponding POI value and logarithm of let-7b concentration
2.7 细胞裂解液中let-7b的检测分析
miRNA被认为是临床上重要的生物标志物[17]。研究表明,let-7b能够抑制几种参与肺癌发展的蛋白质翻译[13,18],且肺癌患者的肿瘤组织和周围组织中的let-7b表达显著降低[13]。本文应用Y-EXPAR方法检测了人类肺癌细胞A549中let-7b的表达量。在100个肺癌细胞的细胞裂解液中加入足量let-7b的反义核苷酸,以此作为阴性对照,运用Y-EXPAR方法进行检测,计算实时荧光曲线最大斜率对应的反应时间,阴性对照的POI为13,缓冲溶液空白对照的POI为13.5,二者非常接近,表明Y-EXPAR方法可以在细胞裂解液的环境中进行目标miRNA的检测分析。
运用Y-EXPAR方法对细胞裂解液进行检测,如图7所示,随着细胞数目减少,细胞裂解液所对应的实时荧光曲线强度增长减慢,反应时间增加。且细胞数目在1~1 000范围内时,细胞裂解液所对应实时荧光曲线的POI值与细胞数目的对数值存在线性关系,回归方程为POI=10.2-1.30lg(Number of cells)。结果表明Y-EXPAR方法在检测细胞中的miRNA方面具有较好效果,在临床诊断中具有应用潜力。
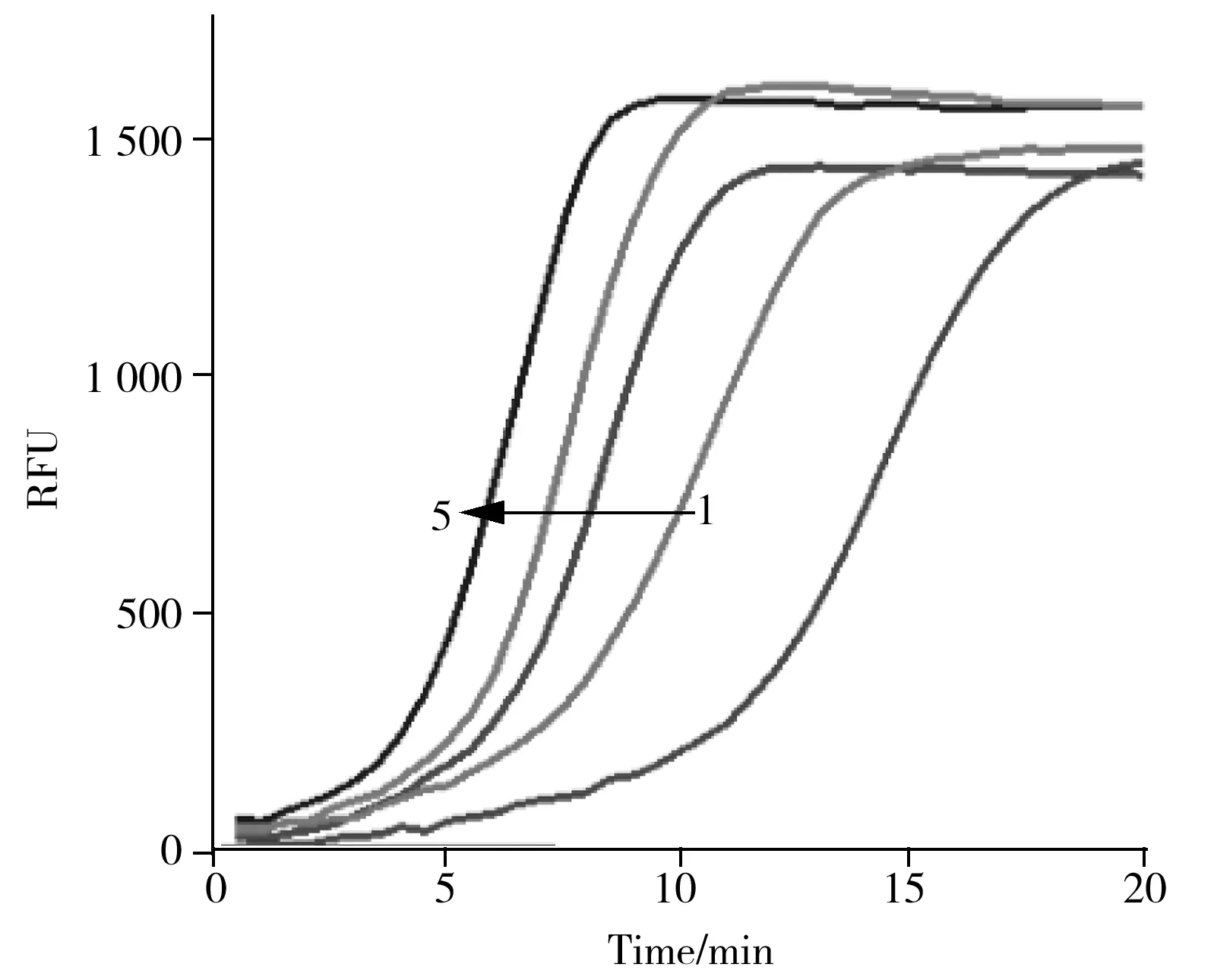
图7 Y-EXPAR响应不同数目A549细胞裂解液的实时荧光曲线图Fig.7 Real-time fluorescence curves of Y-EXPAR in response to cell lysates from different numbers of A549numbers of A549(1-5):blank,1,10,100,1 000 cells
3 结 论
本文提出了一种基于DNA“Y”型结构的高扩增效率、低序列偏好的指数型核酸恒温扩增方法——Y-EXPAR,并将其应用于miRNA的灵敏特异检测。该方法延续了传统EXPAR方法的主要优点,如反应可在恒温下进行,操作简便,同时在检测let-7b和其它let-7家族时表现出良好的选择特异性和抗干扰能力。此外,“Y”型结构还实现了双向指数扩增,进一步提高扩增效率,缩短了分析时间。对于引发指数扩增反应的触发剂而言,“Y”型结构能够保证扩增反应的相对独立性,有效克服扩增序列依赖性问题。本扩增方法为miRNA的快速检测提供了新思路,在miRNA相关的疾病研究和临床诊断方面具有良好应用前景。

