金银花离体快繁体系的建立
钱晶晶 王宁
(安徽科技学院,安徽 滁州 233100)
引言
金银花(Lonicera japonica Thunb.)为忍冬科(Caprifoliaceae)忍冬属(Lonicera)植物,多年生缠绕木本[1],作为我国历史悠久的中药材[2],其主要有效成分为绿原酸和类黄酮等[3],具有清热(尤其儿童退烧)、解毒、抗氧化、增强免疫力[4,5]等功效,巨有极大的市场需求。目前金银花的主要栽培方式为大田种植,而绿原酸等有效物质的提取又需从植物花中提取,费时费力[6],利用组织培养技术能够建立金银花离体快繁体系,避免时间、空间、气候等条件的限制[7],提高目标化合物产率,可以更好地控制金银花种苗质量,为金银花药用化学物质的商业化生产打下基础。
本研究以金银花茎段为外植体,建立离体快繁体系,为金银花种苗生产,以及有益物质的简单、快速大规模提取建立基础。
1 材料和方法
1.1 试验材料
试验材料来源于安徽科技学院种植园,秋季选取生长健壮、无病虫害、种质优良的金银花嫩枝作为外植体。
1.2 培养条件
培养条件为温度25±2℃,相对湿度保持在70%左右,光照2500lux,光照周期12h·d-1。
1.3 金银花离体快繁体系的建立
1.3.1 外植体接种
选取金银花约1cm嫩枝茎段(带有1个腋芽),先用清水冲洗,放在超净工作台中,用75%的乙醇浸泡30s,再用无菌水冲洗5遍,用0.1%HgCl2加2滴吐温消毒9min,最后用无菌水冲洗5遍。接种到培养基内,培养35d。
1.3.2 培养基的选择
选取MS、1/2MS、WPM、B5 4种基本培养基,每种培养基内加入3%的蔗糖和0.55%的琼脂,pH调至6.5,加入1.0mg·L-1的6-BA。每种培养基作为一个处理,共4个处理,每组处理共做15个重复。将接种后的金银花放入培养室内,培养35d,观察金银花组培苗增殖及植株生长情况并记录数据,计算出平均增殖量和平均生长量。
平均不定芽增殖量(n)=不定芽增殖总量(n)/接种数(n)×100%
平均生长量(cm)=(生长总长度(cm)-接种长度)/接种数
1.3.3 培养激素的选择
以MS培养基为基本培养基,培养基内加入3%的蔗糖和0.55%的琼脂,pH调至6.5,分别加入0mg·L-1、0.5mg·L-1、1.0mg·L-1、1.5mg·L-1、2.0mg·L-1的6-BA,然后放入高压灭菌锅(美国,致微,GR60DA)内121℃灭菌20min。在超净工作台(中国,苏州净化,SW-CJ-1D/1G)中把金银花茎段接入培养基内,每个茎节上都要保留1~2个腋芽。共5组处理,每组处理做15个重复。培养35d,观察金银花出芽数及不定芽增殖数量并记录数据,计算不定芽诱导率和平均增殖量。
不定芽诱导率(%)=出芽数(n)/接种数(n)×100%
平均增殖量(n)=增殖总量(n)/接种数(n)
以MS培养基为基本培养基,培养基内加入3%的蔗糖和0.55%的琼脂,pH调至6.0±0.2,分别加入0mg·L-1、0.5mg·L-1、1.0mg·L-1、1.5mg·L-1、2.0mg·L-1的IBA,然后放入高压灭菌锅(美国,致微,GR60DA)内121℃灭菌20min。在超净工作台(中国,苏州净化,SW-CJ-1D/1G)中把金银花茎段接入培养基内,每个茎节上都要保留1~2个腋芽。共5组处理,每组处理做15个重复。培养35d,观察生根数量,测量根长并记录数据,计算出生根率和平均根长。
生根率(%)=生根数(n)/接种数(n)×100%
平均根长(cm)=总根长(cm)/生根总数(n)
选用MS培养基为基本培养基,培养基内加入3%的蔗糖和0.55%的琼脂,pH调至6.0~6.5,分别加入NAA浓度0.2mg·L-1、0.4mg·L-1、0.6mg·L-1、0.8mg·L-1、1.0mg·L-1和6-BA浓度为0.2mg·L-1、0.4mg·L-1、0.6mg·L-1、0.8mg·L-1、1.0mg·L-1的激素配比,如表1所示,然后放入高压灭菌锅(美国,致微,GR60DA)内121℃灭菌20min。在超净工作台(中国,苏州净化,SW-CJ-1D/1G)中将金银花的幼叶,切成1cm×1cm的方形,在叶片背面叶脉处用手术刀轻划2个伤口,背面朝下接种到培养基上。共25组处理,每组处理做4个重复。培养21d后,观察愈伤生长情况,统计愈伤诱导数、愈伤质量,计算出愈伤诱导率和增长倍数。
愈伤诱导率=愈伤诱导数/接种数×100%
愈伤诱导平均质量=愈伤诱导总量/接种数
2 结果
2.1 不同培养基对金银花幼苗生长的影响
金银花腋芽经过7d的培养开始生长,茎节开始膨大逐渐增高,10d左右丛生芽开始产生。由图1可以看出,不同类型的培养基诱导幼苗平均增殖量从多至少依次为B5、MS、1/2MS、WPM,诱导幼苗平均伸长量从高至矮依次为MS、1/2MS、WPM、B5。B5培养基其大部分长出来的幼苗茎比较细且植株矮小,叶片黄绿色且蜷缩多,因此B5培养基不利于金银花的生长。MS培养基中金银花长势高、叶片大且颜色翠绿。由此可得,金银花在MS培养基中的长势比在WPM、1/2 MS、B5 3种基础培养基中长势好。
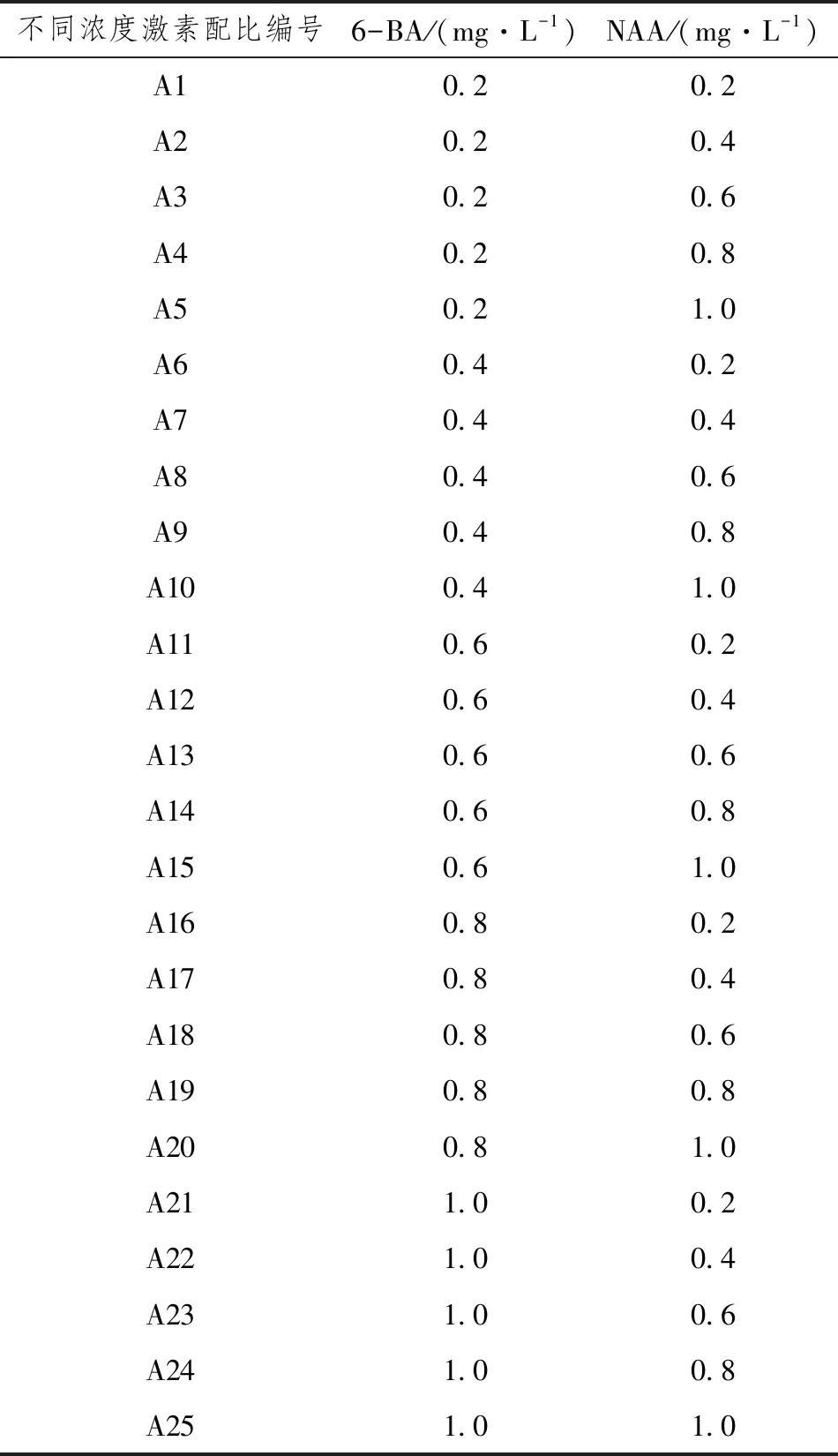
表1 不同浓度激素配比情况
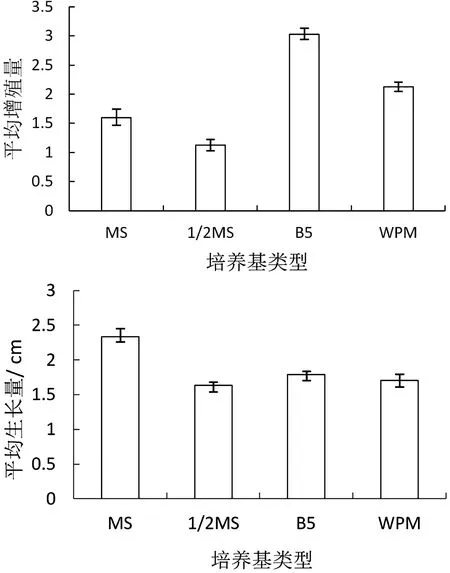
图1 不同类型培养基诱导不定芽的平均增殖量和平均生长量
2.2 不同培养激素对金银花幼苗生长的影响
2.2.1 诱导不定芽生成激素的筛选
从图2可以看出,在同一种基础培养基中加入不同浓度的细胞分裂素(6-BA),使植株的成长状况产生了很大的变化,细胞分裂素加快了细胞的分化及调节植株的生长。试验结果表明,不定芽诱导率最高的为MS加6-BA 0.5mg·L-1,不定芽率达到93.3%,MS加6-BA 2.0mg·L-1、MS加6-BA 1.5mg·L-1和MS加6-BA 1.0mg·L-1的不定芽诱导率为85%,不加6-BA不定芽的诱导率为0。金银花平均生芽数由多到少的培养基依次为MS加6-BA 2.0mg·L-1、MS加6-BA 1.5mg·L-1、MS加6-BA 0.5mg·L-1、MS加6-BA 1.0mg·L-1。6-BA在一定浓度范围,不定芽的数量随着激素浓度的升高而增加,当6-BA浓度为0.5~1.0mg·L-1时不定芽的诱导量增加,6-BA浓度在1.0~2.0mg·L-1时不定芽的诱导量逐渐减少。因此,诱导不定芽增殖的最佳6-BA浓度为1.0mg·L-1。

图2 不同浓度激素对不定芽诱导率和平均增殖量的影响
2.2.2 生根激素的筛选
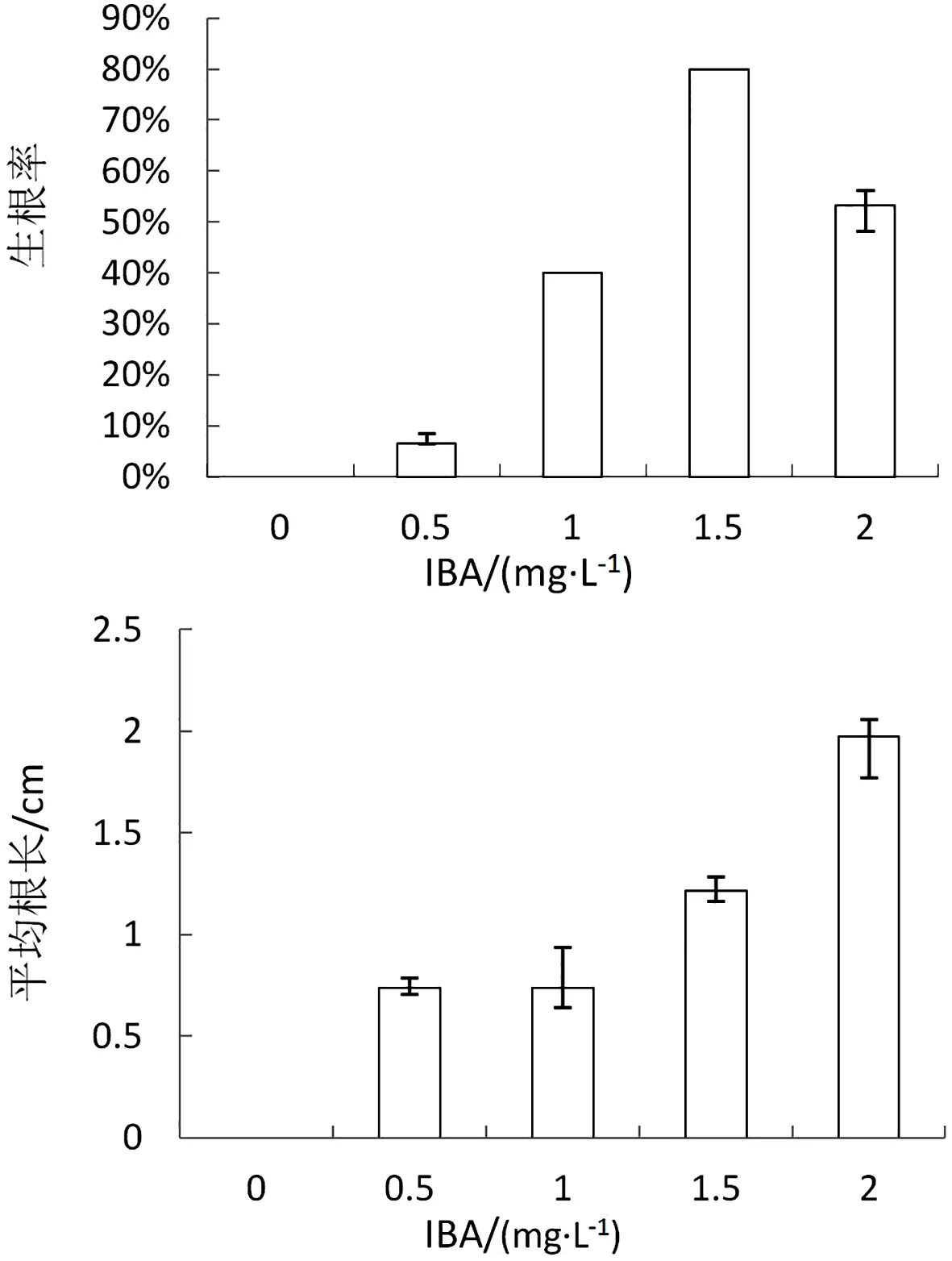
图3 不同浓度激素对生根率和平均根长的影响
从图3可以得出,不同浓度的IBA诱导金银花生根的状况不同。试验结果表明,诱导金银花平均生根率最高的培养基为MS加IBA 1.5mg·L-1,生根率达到80%,其次为MS加 IBA 2.0mg·L-1,生根率为53.3%。金银花平均根长从长至短培养基依次为MS加IBA 2.0mg·L-1、MS加IBA 1.5mg·L-1、MS加IBA 1.0mg·L-1、MS加IBA 0.5mg·L-1。虽然MS加IBA 2.0mg·L-1的培养基培养出的金银花根系最长,但根系不够粗壮。生产中所需要的组培苗根系比较健壮、根系较多,这样更有利于植株的成活。综合试验结果得出,筛选出MS加IBA 1.5mg·L-1的培养基更有利于植株生根,并且根系健壮发达,种苗成活率能够大大提高。
3 结论与讨论
组培过程中,由于植物基因型及生长特性不同,对于各种条件的需求存在着很大差异,培养基类型、植物生长调节剂、营养成分等都对植物生长有一定的影响[8],进行针对性分析研究是非常必要的。本试验通过对金银花组织培养,初步建立了金银花离体快繁及细胞悬浮培养的基本体系。
金银花离体快繁体系的建立,最适金银花生长的基本培养基为MS;不定芽诱导最适培养基为MS加6-BA 1.0mg·L-1;根系生长最适培养基为MS加IBA 1.5mg·L-1。与传统繁殖方式相比,金银花离体快繁体系的建立,提高了金银花的繁殖系数,缩短了培育时间,为其种质资源保存、基因工程育种及推广应用奠定基础,同时也可促进我国优质金银花的培育,为金银花的工厂化快速繁殖优质种苗奠定了基础。

