1株产GES-1型碳青霉烯酶铜绿假单胞菌的全基因组测序分析*
郭庆昕,蔡加昌,周宏伟,张嵘,蒋华蔚,胡燕燕(.泉州市正骨医院检验科,福建泉州362000;2.浙江大学医学院附属第二医院 a.检验科,b.血液科,杭州30009)
铜绿假单胞菌是重要的医院感染菌之一,可引起重症肺炎、败血症、烧伤伤口感染等。产碳青霉烯酶铜绿假单胞菌(carbapenem resistantPseudomonasaeruginosa, CRPA)可水解几乎所有可用的β-内酰胺类抗菌药物,对全球公众健康构成了严重威胁[1]。β-内酰胺酶可分A、B和D三大类,A类包括KPC、BEL、CTX-M、GES家族的成员,B类包括NDM、IMP家族和VIM家族,D类主要是OXA家族。GES类型的β-内酰胺酶在20世纪后期被发现,因其含有丝氨酸碳β-内酰胺酶的结构特征(即Cys69和Cys239之间的二硫键),故与KPC型一起被分在A类中[2]。blaGES基因容易发生突变,目前已鉴定出40个亚型[3],GES酶水解谱也不断扩大,从原先的超广谱β-内酰胺酶逐渐进化为碳青霉烯酶[4]。为充分阐明耐药菌的传播动态,本研究对1株产GES-1型碳青霉烯酶铜绿假单胞菌进行全基因测序分析,采用生物信息技术分析本菌的多位点序列分型(multisite sequencing typing, MLST)、毒力基因和耐药基因,并分析blaGES-1基因所处的周围环境。
1 材料与方法
1.1研究对象 研究菌株来自浙江大学医学院附属第二医院重症医学科1例重症肺炎患者,该患者住院期间多次发热,曾先后使用哌拉西林钠/他唑巴坦钠、比阿培南、左氧氟沙星等抗感染治疗。该菌株于患者入ICU 13个月后从合格痰标本中分离,经基质辅助激光解吸/电离飞行时间(MALDI-TOF)质谱及微量肉汤稀释法确定为CRPA,此后7个月中反复从痰标本中检出。应用哌拉西林/他唑巴坦、比阿培南等抗菌药物治疗,但患者肺炎持续加重,呼吸功能衰竭,最终死亡。
1.2主要仪器与试剂 MALDI-TOF质谱仪(德国Bruker公司),PCR扩增仪、凝胶成像系统(Bio-Rad公司),Illumina HiSeq X10测序平台(美国Illumina公司),3730测序分析仪(美国ABI公司),电泳仪(北京六一仪器厂);血琼脂平板(郑州安图生物公司),铜绿假单胞菌药敏试剂盒(珠海迪尔公司),引物(上海生工生物公司),dNTP mix、10×Buffer、Taq酶、加样缓冲液(大连宝生物公司),细菌全基因组提取试剂盒(广州Magen公司)。
1.3细菌鉴定 标本接种于血琼脂平板培养过夜,分离菌采用MALDI-TOF质谱进行菌种鉴定。
1.4抗菌药物敏感性试验 采用微量肉汤稀释法检测庆大霉素、阿米卡星、哌拉西林、哌拉西林/他唑巴坦、头孢他啶、头孢吡肟、氨曲南、亚胺培南、美罗培南、环丙沙星、左氧氟沙星、黏菌素、多黏菌素、头孢哌酮/舒巴坦的敏感性,以铜绿假单胞菌ATCC 27853作为质控菌株,结果判读参照据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M100-S28标准[5]。亚胺培南和/或美罗培南的最低抑菌浓度≥8 μg/mL时判定为CRPA,头孢哌酮/舒巴坦敏感性判读参照CLSI-M100-S28中头孢哌酮方案进行。
1.5全基因组测序及分析 使用细菌基因组提取试剂盒提取DNA,用TE缓冲液洗脱,用紫外分光光度计对所提取的DNA进行浓度测定,测定后的合格样品送北京安诺优达基因科技公司,经DNA片段化、末端补平、3′端加A、连接测序接头、PCR扩增与纯化等完成文库制备,然后采用Illumina HiSeq X10测序平台通过双末端150 bp测序读长策略进行高通量测序。原始序列通过SPAdes v3.11.1[6]进行组装,“cov-cutoff”参数选为“auto”,“phred-offset”参数选为“33”,并用RAST[7]和Prokka[8]进行注释,Prokka软件的“kingdom”参数选择“Bacteria”并且选用“metagenome”参数提高基因预测能力。然后,通过Kleborate和ResFinder[9]分析菌株的MLST、毒力基因和耐药基因,参数均采用软件默认的设置(threshold for ID%为90%,minimum length为60%)。该铜绿假单胞菌的全基因测序原始数据已提交NCBI网站(http:∥www.ncbi.nlm.nih.gov/sra),BioProject登记号:PRJNA648026,Biosample登记号:SAMN15616709。
1.6blaGES-1基因环境分析 全基因组测序分析显示blaGES-1基因位于NODE_219片段中,长度3 150 bp,上游为整合子1(intl1)部分序列,下游为插入序列(ISPa21e)的部分序列。为呈现intl1和ISPa21e的完整序列,各设计了3对引物对这2个基因进行PCR扩增,引物序列见表1,产物送上海生工生物工程公司采用3730测序分析仪测序,结果用DNAMAN软件拼接。

表1 intl1和ISPa21e扩增延伸引物
2 结果
2.1抗菌药物敏感性试验 根据CLSI-M100-S28判读标准,该菌对美罗培南、黏菌素和多黏菌素B敏感,对其他抗菌药物均为耐药。见表2。
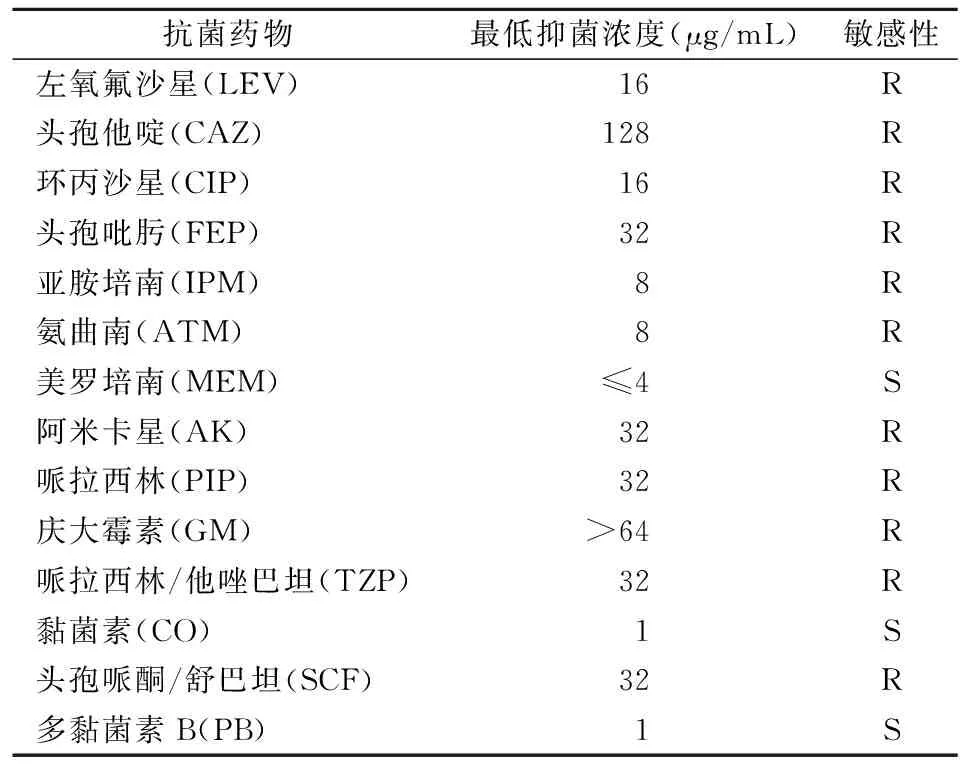
表2 抗菌药物敏感性试验结果
2.2全基因组测序结果 该菌全基因组测序分析结果显示,测序深度75×,基因组覆盖度100%。
2.2.1MLST及血清分型结果 经全基因组测序对7对管家基因(acsA、aroE、guaA、mutL、nuoD、ppsA、trpE)[10]进行分析,经https:∥cge.cbs.dtu.dk/services/MLST/查询,结果为(38-11-3-13-1-2-4),经比对,MLST分型为ST235型,血清分型为O11型。
2.2.2耐药基因测序结果 经ResFinder数据库比对,本株分离菌共携带有12个抗菌药物耐药基因,见表3。

表3 耐药基因测序结果
2.2.3blaGES-1基因比对结果及基因环境 全基因组测序分析发现,blaGES-1基因位于长度为3 150 bp的 NODE_219片段中。该基因片段与GenBank中的 KY860573菌株的72068—75217一致率为99.94%。blaGES-1基因上游1—192为整合子1(intl1)部分序列;372—1235为β-内酰胺类耐药基因blaGES-1,长度为864 bp,经ResFinder数据库比对,与登记号为HQ170511的菌株100%一致;下游依次为:1374—1928为氨基糖苷类/氟喹诺酮类耐药基因aac(6′)-Ⅰb3,长度为558 bp;2009—2253为无功能基因gcuE15,长度为245 bp;2261—3055为氨基糖苷类耐药基因aph(3′)-XV,长度为795 bp;3077—3150为插入序列ISPa21e部分序列。采用PCR扩增加测序对整合子intl1和插入序列ISPa21e进一步延伸,intl1全长为1 014 bp,ISPa21e全长为1 297 bp。blaGES-1基因环境见图1。

注:整合子1(intl1)长度1 014 bp,β-内酰胺类耐药基因(blaGES-1 )长度为864 bp,氨基糖苷类/氟喹诺酮类耐药基因[aac(6′)-Ⅰb3]长度为558 bp,无功能基因gcuE15长度为245 bp,氨基糖苷类耐药基因[aph(3′)-XV]长度795 bp,插入序列ISPa21e长度为1 297 bp。
2.2.4毒力基因测序结果 全基因组测序分析共查询到该菌包含有357个毒力基因,其中胞外酶3种,T3SS转录因子5种,胞外多糖20种,外毒素1种,溶血磷脂酶C 3种,溶血磷脂酶D 1种,鞭毛蛋白14种,鞭毛丝蛋白15种,菌毛蛋白25种,主要毒力基因见表4,该菌为exoU+/exoS-基因型。
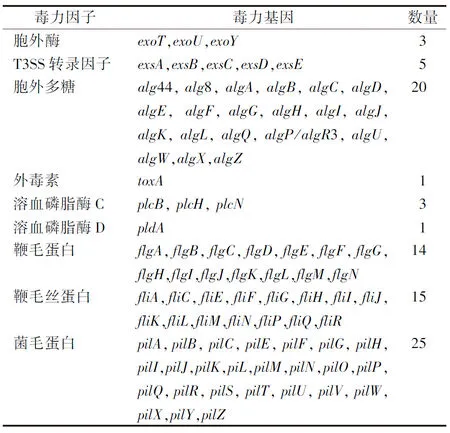
表4 本菌携带的主要毒力基因
3 讨论
铜绿假单胞菌的碳青霉烯酶编码基因(carbapenemase-encoding genes,CEGs)并非来源于其本身,而是水平基因转移获得的外源基因[11]。尽管其获得性CEGs的起源尚不清楚,但最有可能是来源于具有相同生态位的环境细菌[12]。以往认为GES酶水解碳青霉烯的能力很低,可被碳青霉烯类抗菌药物亚胺培南抑制,但GES酶的独特之处在于能通过单点突变将其水解谱扩展至碳青霉烯类[13]。
综合全球的多项研究,发现ST235、ST175和ST111是CRPA 3个主要的高风险克隆,而ST235分布最广,遍布全球五大洲,且ST235与O11型血清型相关[14]。Mulet等[15]研究了可能导致铜绿假单胞菌高风险克隆成功的生物标记,发现其在运动和产生色素上存在缺陷,但生物膜形成水平和自发突变频率增加,这些特征与高风险克隆引起的慢性感染互相印证。高风险克隆的耐药性与转移耐药和自发突变机制有关,其中ST235型中报道了近100个水平获得耐药元素,绝大多数产生金属β-内酰胺酶或超广谱β-内酰胺酶,其中GES酶最为多样化[16]。
本菌基因环境分析显示,在blaGES-1上游为Ⅰ类整合子(intl1),下游为耐药基因aac(6′)-Ⅰb3和aph(3′)-XV,右侧翼的插入序列(ISPa21e)。有研究发现CRPA中获得性碳青霉烯酶大多数存在于染色体位置tn402类转座子内的Ⅰ类整合子上[17]。整合子是编码产生整合酶,介导位点特异性重组,负责获得或切除载有抗菌药物耐药基因的基因盒,多个基因片段可能被同一整合子捕获到可变区域[18],这解释了本菌blaGES-1基因环境中3 150 bp的片段中集聚着3个重要的耐药基因,对β-内酰胺类、氟喹诺酮类、氨基糖苷类等抗假单胞菌抗菌药物耐药的原因。下游为IS110家族中的插入序列ISPa21e,该插入序列属于高度可移动性转座因子,是对基因组一个或多个靶位点具有插入能力的小分子片段,并可以移动邻近的基因[19]。该序列在染色体上的特定位置在不同的ST235分离株之间有所不同,表明在该克隆谱系的进化过程中发生了染色体重排[20]。在医院环境中,非发酵革兰阴性菌是这些元素的主要贮藏库,当转移到铜绿假单胞菌高风险克隆中时,会发生垂直扩增,导致CRPA的发生[21]。
经比对,本菌含有357个毒力基因,这些因子在细菌黏附、运动、生物膜形成、抗菌药物耐药和细胞毒性等不同环节中起作用。Ⅲ型分泌系统(T3SS)在铜绿假单胞菌生物膜形成、细胞毒作用中起重要作用,在感染过程中铜绿假单胞菌将毒素ExoS、ExoT、ExoU、ExoY注入到靶真核细胞的胞浆中,其中ExoU是一种磷脂酶效应细胞毒素,可致呼吸道、尿道、角膜和软组织等急性上皮损伤[22]。大多数铜绿假单胞菌均可检出ExoY和ExoT,而ExoS和ExoU则相对立,exoU-/exoS+基因型通常与侵袭表型相关,会导致宿主细胞的缓慢死亡;exoU+/exoS-基因型与细胞毒性高的菌株相关,导致宿主细胞快速而稳定的裂解,经常与慢性感染相关。高风险克隆ST235均为exoU+/exoS-基因型,与其他克隆相比,其临床效果差,预后不良[23]。ExsA、ExsB、ExsC、ExsD、ExsE特别是ExsA,是T3SS基因表达的主要调控因子,鞭毛丝蛋白(FliC)、胞外多糖(alg)等是T3SS的其他效应子。外毒素、溶血磷脂酶C、D是重要的细胞毒素,也可导致宿主细胞裂解。
临床早期发现高风险克隆对医院感染控制具有重要意义,有助于避免其在医院环境中扩散。全基因组测序在多重耐药菌的医院感染调查中提供基因分型、耐药基因、毒力基因等多种重要信息,在充分阐明耐药菌的传播动态,了解高风险克隆成功的因素等方面发挥重要作用。

