不同新型冠状病毒核酸检测试剂的临床性能评价
耿帜,徐远东,包一熙,陈凤花(华中科技大学同济医学院附属协和医院检验科,武汉 430022)
应用实时荧光PCR检测呼吸道标本中新型冠状病毒(2019-nCoV)RNA,是诊断新型冠状病毒肺炎(COVID-19)患者以及筛查无症状感染者的主要手段之一,但2019-nCoV核酸检测可能受到患者病程、标本采集、核酸提取设备及相应试剂、核酸扩增试剂及实时荧光PCR仪等多种因素的影响[1]。目前有多种2019-nCoV RNA检测的RT-PCR试剂盒已获得中国国家药品监督管理局(National Medical Products Administration, NMPA)、美国食品药品监督管理局 (Food and Drug Administration,FDA)紧急使用授权(EUA)、世界卫生组织(World Health Organization, WHO)应急使用清单(Emergency Use Listing,EUL)和体外诊断欧盟认证(CE-IVD)批准,不同生产厂家声称的试剂分析灵敏度不同。对于医疗机构的临床实验室,为避免产生假阴性结果,选择灵敏度高、临床检测性能佳的2019-nCoV RNA检测试剂至关重要[2]。另外,标本周转时间(turnaround time, TAT)也是影响试剂选择的重要因素。在2019-nCoV核酸检测设备包括核酸提取仪和实时荧光PCR仪等资源有限的情况下,缩短PCR扩增时间,有助于缩短TAT,提高实验室2019-nCoV核酸检测能力。本实验室经性能验证后选择达安公司试剂检测临床样本2019-nCoV核酸,近期该厂家又推出一款扩增时间短的试剂,声称新试剂分析灵敏度不变,但扩增时间由110 min减少至62 min。为确定是否能将扩增时间长的试剂更换为扩增时间短的试剂,本研究对同一厂家生产的这两种不同2019-nCoV RNA检测试剂进行临床性能评价。
1 资料与方法
1.1临床样本 华中科技大学同济医学院附属协和医院2020年2月9日发热门诊患者130例,其中,男性56例,女性74例;年龄10~90岁,中位年龄48.5岁。
1.2仪器与试剂 GeneRotex 96全自动核酸提取仪(苏州天隆公司),ABI 7500实时荧光定量PCR仪(美国应用生物系统公司);Ex-DNA/RNA病毒核酸提取试剂盒(磁珠法,苏械备20151030,苏州天隆公司),2019-nCoV RNA液体室内质控品S2[以开放读码框1ab(open reading frame 1ab,ORF1ab)浓度赋值17 300 copies/mL,溯源到国家二级标准物质GBW(E)091132/GBW(E)091133,广州邦德盛公司],试剂A: 新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法,国械注准20203400063)、试剂B: 新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法,国械注准20203400749)(中山大学达安公司)。
1.3分析灵敏度评价 用2019-nCoV阴性混合样本,梯度稀释定值质控品S2(17 300 copies/mL)至1 730、865、567.7、432.5、216.3和108.2 copies/mL 6个浓度;按照美国临床和实验室标准化协会(CLSI)EP17-A2,每个浓度每天做7~8个复孔,连续3 d,共计23孔,进行核酸提取和实时荧光RT-PCR扩增以评估分析灵敏度。厂家声称试剂A和B分析灵敏度均为500 copies/mL。
1.4核酸提取 取200 μL咽拭子病毒保存液或不同浓度质控品稀释液,用Ex-DNA/RNA病毒核酸提取试剂盒在GeneRotex 96全自动核酸提取仪上提取核酸,按照试剂说明书进行操作,将提取的核酸保存于-80 ℃备用。
1.52019-nCoV RNA扩增检测 试剂A和B检测的靶基因均为2019-nCoV ORF1ab基因和核壳蛋白(nucleocapsid, N)基因;检测的荧光均为FAM、VIC和Cy5三通道;均检测内源性内标,以监测咽拭子样本采集、核酸提取和PCR扩增过程的有效性。试剂A和B的PCR反应体系总体积均为25 μL,包括17 μL PCR反应液A,3 μL PCR反应液B,5 μL核酸模板,均在ABI 7500实时荧光定量PCR仪上进行扩增。试剂A和B的扩增条件不同,对应的扩增时间分别为110 min和62 min。试剂A的扩增条件为:50 ℃ 15 min;95 ℃ 15 min;94 ℃ 15 s,55 ℃ 45 s检测荧光,45个循环。试剂B的扩增条件为:50 ℃ 2 min;95 ℃ 2 min;95 ℃ 5 s,60 ℃ 35 s,10个循环;95 ℃ 5 s,60 ℃ 35 s检测荧光,32个循环。每批次设3个阴性质控和1个弱阳性质控。试剂A和B的阳性结果判断的循环阈值(cycle threshold, Ct)分别为Ct≤40和Ct≤30。
1.6相对灵敏度评价 选取试剂A检测ORF1ab和N基因的Ct值为18~27的5例2019-nCoV强阳性核酸,用天隆公司的洗脱液进行连续10倍梯度稀释[3],然后同时用试剂A和B进行检测,原倍核酸做2个复孔,每个稀释度做3个复孔,分析不同稀释度靶基因的检出率和Ct变化。
1.7临床检测性能比较 试剂A和B同时检测130例咽拭子样本核酸,分析其阳性符合率、阴性符合率等,第一次检测结果为靶基因单阳的临床样本核酸进行双孔复查,根据试剂说明书判定结果。
1.8统计学分析 用SPSS 20.0统计软件进行。计数资料以例数和百分率表示,率的比较采用Fisher精确概率法,一致性分析采用Kappa检验,最低检测限采用Probit分析。以P<0.05为差异有统计学意义。
2 结果
2.1分析灵敏度评价 质控品S2的赋值以ORF1ab为准。试剂A和B均能100%(23/23)检测到浓度为1 730 copies/mL的S2稀释液中ORF1ab基因,随着稀释液浓度降低,ORF1ab的检出率逐渐降低。试剂A和B检测865、567.7、432.5、216.3和108.2 copies/mL的S2稀释液中ORF1ab基因的阳性率分别为95.65%(22/23)和82.61%(19/23)、95.65%(22/23)和78.26%(18/23)、91.30%(21/23)和78.26%(18/23)、65.22%(15/23)和43.48%(10/23)、34.78%(8/23)和17.39%(4/23)。根据Probit分析,算得试剂A和B的最低检测限分别为615.9(95%CI:446.0~1 098.5)copies/mL和1 249.1(95%CI:863.4~2 378.8)copies/mL。
2.2相对分析灵敏度评价 用洗脱液连续10倍梯度稀释5例2019-nCoV强阳性的临床样本核酸进行相对分析灵敏度评价。结果显示,在1∶10和1∶100稀释时,试剂A和B均能100%检测到ORF1ab和N基因;而1∶1 000稀释时,试剂A对ORF1ab和N基因的检出率均为100%,试剂B的检出率分别为73.33%和80.00%,见表1。在原倍、1∶10和1∶100稀释时,试剂A检测ORF1ab和N基因的Ct分别为24.66±2.34和22.70±2.32、28.38±2.19和26.25±2.22、32.16±2.23和30.07±2.29,试剂B检测ORF1ab和N基因的Ct分别为16.35±2.46和14.50±2.35、19.15±2.28和17.93±2.42、22.47±2.35和21.97±2.56;连续10倍稀释,试剂A和B检测ORF1ab和N基因的平均Ct增加2.80~4.04。
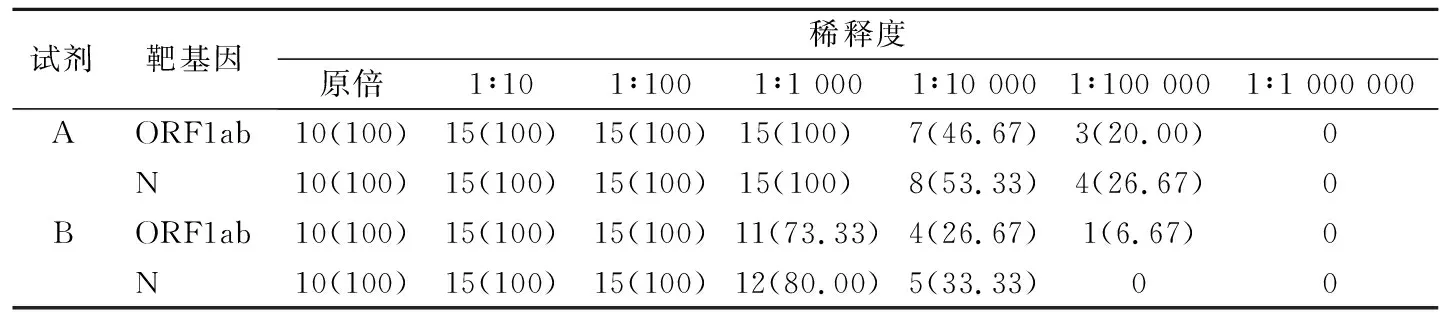
表1 2种试剂检测5例2019-nCoV强阳性标本不同稀释度核酸的相对分析灵敏度[n(%)]
2.32种试剂的临床检测性能评价 2种试剂检测130例咽拭子样本核酸中2019-nCoV的 ORF1ab和N基因,试剂A第一次检测出45例双阳、4例ORF1ab单阳、8例N单阳和73例阴性,试剂B第一次检测出34例双阳、4例ORF1ab单阳、6例N单阳和86例阴性,每种试剂第一次检测的单阳继续用相应试剂双孔复查,最终试剂A检测出57例(43.85%)2019-nCoV RNA阳性、73例(56.15%)2019-nCoV RNA阴性,而试剂B则检测出43例(33.08%)阳性、87例(66.92%)阴性。经Fisher精确概率法检验,这2种试剂检测的阳性率差异有统计学意义(P<0.05)。而有1例样本,试剂A检测阴性、试剂B检出N单阳,随后双孔复查为阴性,根据试剂说明书判定为阴性。应用Kappa一致性检验分析发现:2种试剂的检测结果一致性较好(kappa=0.775 3),阳性率符合率为75.44%(43/57),阴性符合率为100%(73/73),阳性预测值为100%(43/43),阴性预测值为83.91%(73/87),总符合率为89.23%(116/130)。
3 讨论
本研究进行2种试剂的临床检测性能评价,以确定能否将试剂A更换为试剂B,缩短TAT、提高核酸检测能力。虽然厂家声称的试剂A和B的分析灵敏度均为500 copies/mL,但是梯度稀释定值质控品进行分析灵敏度验证,发现试剂A和B的分析灵敏度分别为615.9和1 249.1 copies/mL;进一步应用2019-nCoV阴性混合样本梯度稀释5例强阳性临床样本核酸进行检测,发现试剂A和B 100%检出ORF1ab和N基因的最高稀释度分别为1∶1 000和1∶100,这些均提示试剂A的实际分析灵敏度比试剂B高。有研究应用数字PCR发现试剂A的分析灵敏度为484 copies/mL[4],每反应体系灵敏度为1~10 copies[5],与本研究发现的试剂A分析灵敏度615.9 copies/mL稍有差异,可能是由于定值的溯源性不同以及梯度稀释的基质不同等因素所致。
对于130例咽拭子样本核酸,试剂A检出的阳性率43.85%显著高于试剂B的阳性率33.08%,其中有14例样本试剂A检出阳性而试剂B漏检,进一步分析发现这14例样本应用试剂A检测到ORF1ab或N基因的Ct大多为36~40,可能是由于试剂B的实际分析灵敏度低于试剂A所致。应用Kappa一致性检验发现:试剂A和B的检测结果一致性较好(kappa=0.775 3),阳性符合率为75.44%,阴性符合率为100%,阳性预测值为100%,阴性预测值为83.91%,总符合率为89.23%,提示试剂A和B的临床检测性能存在差异。
总之,本研究发现2种2019-nCoV核酸检测试剂的临床性能之间存在差异。为保证2019-nCoV核酸的检测质量,不宜将扩增时间长的试剂更换为扩增时间短的试剂。

