云南地区宫颈癌和宫颈上皮内瘤样病变患者人乳头瘤病毒感染情况*
杨佳, 杨丽娟, 刘伟鹏, 朱小永, 赵凌锋, 周紫云, 李传印, 严志凌**
(1.中国医学科学院 & 北京协和医学院 医学生物学研究所, 云南 昆明 650118; 2.昆明市延安医院 妇产科, 云南 昆明 650051; 3.昆明医科大学第三附属医院 妇科, 云南 昆明 650118; 4.曲靖市疾病预防控制中心 办公室, 云南 曲靖 655000)
宫颈癌(cervical cancer,CC)是严重威胁女性健康的恶性肿瘤之一,是全球女性中第四常见的癌症,也是导致女性因癌症死亡的第四大原因,2020年全球约有60.4万例新发CC病例和34.2万死亡病例[1]。CC主要是由人乳头瘤病毒(human papillomavirus,HPV)引起[2],HPV是一种球形DNA病毒,目前已鉴定出超过200个HPV病毒的亚型[3]。根据HPV亚型致病力或致癌危险性不同,可将HPV分为高危型和低危型两大类,高危型HPV 主要包括HPV16、18、31、33、35、39、45、51、52、56、58、59、61、68及82等,低危型HPV主要包括6、11、40、42、43、44、54、61、72及81等[4]。高危型HPV能将病毒整合至宿主基因组,从而将感染的细胞转化为恶性肿瘤细胞而导致癌症;低危型HPV通常与较低程度的组织损伤有关[3-5]。HPV的持续感染首先会诱发宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN),CIN是CC的癌前病变阶段,根据病变进展分为CIN Ⅰ、CIN Ⅱ和CIN Ⅲ,绝大多数CIN患者可通过自身免疫清除HPV感染恢复健康,只有少数CIN患者无法清除HPV感染而进展为CC[6]。研究发现,超过99%的CC病例与高危型HPV相关,而HPV16和18型感染占全部病例70%以上[7-8]。相关研究显示,HPV的多重感染非常常见,即不同型别的HPV可同时感染同一患者形成多重感染,占HPV阳性患者的20%~50%[9-10]。虽然HPV16和18是全球范围内最常见的高危型HPV,但由于不同地区人种差异和生活习惯差异,HPV基因型在不同地区的分布也不相同。因此,本研究调查了云南地区CC患者和CIN患者的HPV感染情况,分析不同HPV亚型在2组患者中的分布情况,以期为本地区CC和CIN的筛查及预防策略的制定提供参考。
1 对象与方法
1.1 研究对象
按照知情同意的原则,选取2015年10月7日—2018年12月28日妇科住院接受治疗的CC和CIN患者,患者符合CC和CIN诊断标准依据《临床诊疗指南-妇产科学分册》,并采用国际妇产科学会(International Federation of Gynecology and Obstetrics,FIGO)2018年指南分期系统对CC进行临床分期;所有患者有性生活史及单一宫颈、无其它宫颈病变,取组织前未接受化疗、放疗、手术等抗肿瘤治疗,未合并或继发其他恶性肿瘤,且均为居住于云南地区、彼此无血缘关系的个体。共纳入CC患者703例,年龄21~75岁、平均年龄(46.2±9.9)岁;CIN患者263例,年龄26~75岁、平均(44.4±9.6)岁;2组患者年龄差异有统计学意义(P<0.05)。
1.2 方法
1.2.1标本的采集 采集CC及CIN患者术后宫颈病变组织50~100 mg,浸于组织保存液500 μL(sample protector for RNA/DNA,日本Takara),于-80 ℃冰箱保存。
1.2.2组织样本基因组及病毒DNA提取 组织破碎采用QIAgen组织破碎仪(TissueLyser LT,德国Qiagen),采用组织DNA提取试剂盒(QIAamp DNA Mini Kit,德国Qiagen)提取组织样本DNA,并用超微量紫外可见分光光度计(ND-2000,美国Thermo Fisher Scientific)检测DNA的浓度和纯度后-20 ℃保存备用。
1.2.3HPV分型 HPV的基因分型采用HPV基因型分型试剂盒(凯普生物),该试剂盒采用的是HPV-DNA导流杂交基因芯片技术(HybriMax),可一次性检测21 种HPV型别(包括 15 种高危亚型 HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68型和6 种低危亚型6、11、42、43、44、81型)。
1.3 统计学分析
2 结果
2.1 HPV感染总体情况
703例CC患者中HPV阳性681例(96.87%),全部为高危型HPV阳性;263例CIN患者中HPV阳性252例(95.82%),其中高危型HPV阳性251例(99.60%)、低危型HPV阳性1例(0.40%);CC患者与CIN患者的HPV阳性检出率差异均无统计学意义(χ2=0.643,P=0.423),且高危型HPV检出率的差异无统计学意义(χ2=0.001,P=0.970 )。
2.2 HPV阳性患者中HPV亚型的感染情况
681例HPV阳性的CC组患者中检出HPV亚型18种,检出率前5位的HPV型别依次为HPV16(88.40%)、HPV18(23.05%)、HPV58(4.55%)、HPV31(3.67%)及HPV59(3.23%);252例HPV阳性的CIN组患者中检出HPV亚型21种,检出率前5位的HPV型别依次为HPV16(79.37%)、HPV58(17.06%)、HPV18(16.67%)、HPV56(10.71%)及HPV52(9.13%);2组患者中检出率最高的亚型均为HPV16,CC组患者的HPV16和HPV18的检出率明显高于CIN组,差异有高度统计学意义(P<0.001),该结果表明随着疾病严重程度的进展HPV16和HPV18感染率呈上升趋势;而CIN组中HPV52、HPV56和HPV58的检出率均高于CC组,差异有高度统计学意义(P<0.001),提示随着疾病严重程度的进展HPV52、HPV56及HPV58的感染率呈下降趋势。见表1。
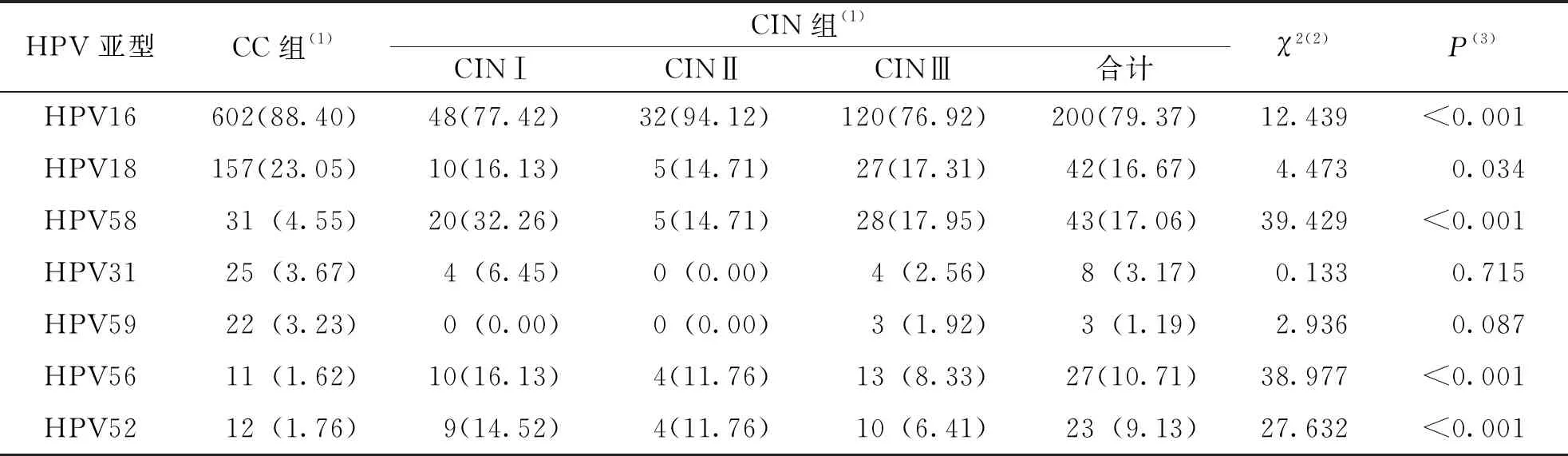
表1 CC组与CIN组HPV阳性患者中检出率前5的HPV亚型[n(%)]
2.3 CC组和CIN组单一HPV型别感染及多重HPV型别感染
研究结果显示,单一感染是CC组和CIN组患者HPV感染的主要方式,且CC组患者单一感染率明显高于CIN组,差异有高度统计学意义(P<0.001);2组患者单一感染中检出率最高的HPV型别均为HPV16,且CC组患者HPV16检出率明显高于CIN组,差异有高度统计学意义(P<0.001);2组患者多重感染均以二重感染为主,其中合并HPV16和HPV18的二重感染比例最高,而CIN患者三重及以上感染率高于CC患者,差异有高度统计学意义(P<0.001),该结果表明随着疾病的进展HPV感染形式趋向于单一感染。见表2。
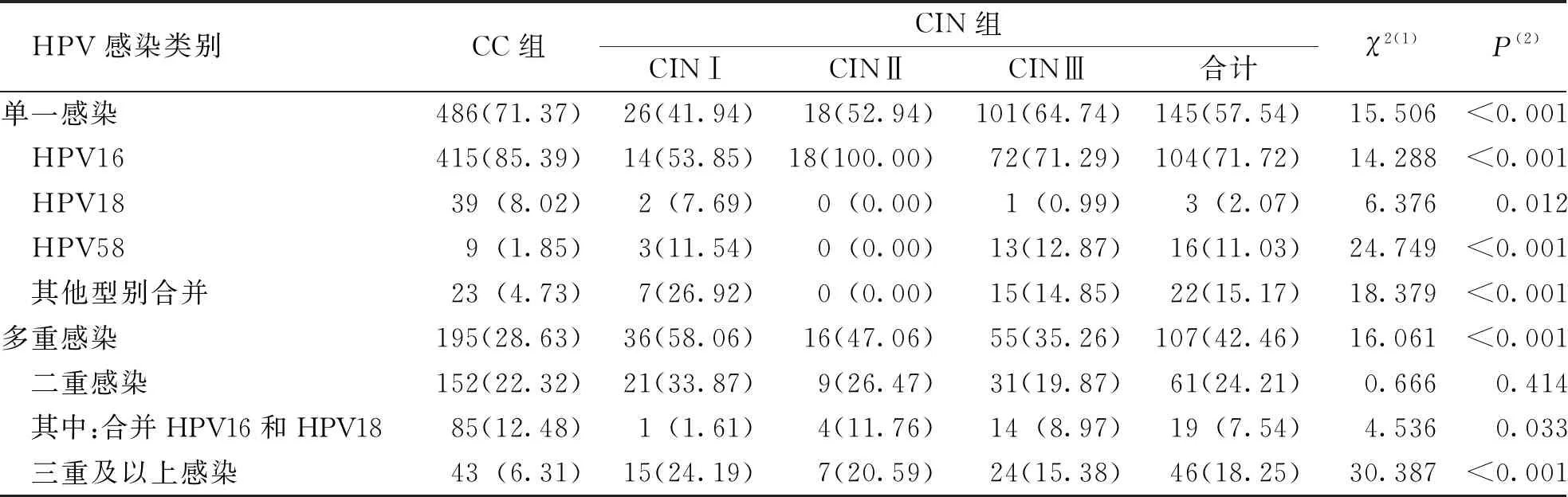
表2 CC组与CIN组HPV阳性患者中HPV单一及多重感染情况[n(%)]
2.4 CC组患者HPV感染与病理类型、年龄的关系
为分析HPV感染类别与CC病理类型的关系,本研究按病理类型将CC组患者分为宫颈鳞癌、腺癌及其他类型。结果显示,宫颈鳞癌、腺癌及其他类型CC患者中的HPV检出率、单一感染率及多重感染率的差异均无统计学意义(P>0.05)。该结果表明,HPV的感染类型与CC病理类型无相关性。同样,为分析HPV感染特征与患者年龄的相关性,本研究将样本分为5个年龄组,结果显示不同年龄组CC患者中HPV的检出率、单一感染率及多重感染率的差异均无统计学意义(P>0.05),表明CC患者中HPV感染类型与患者年龄无相关性。见表3。
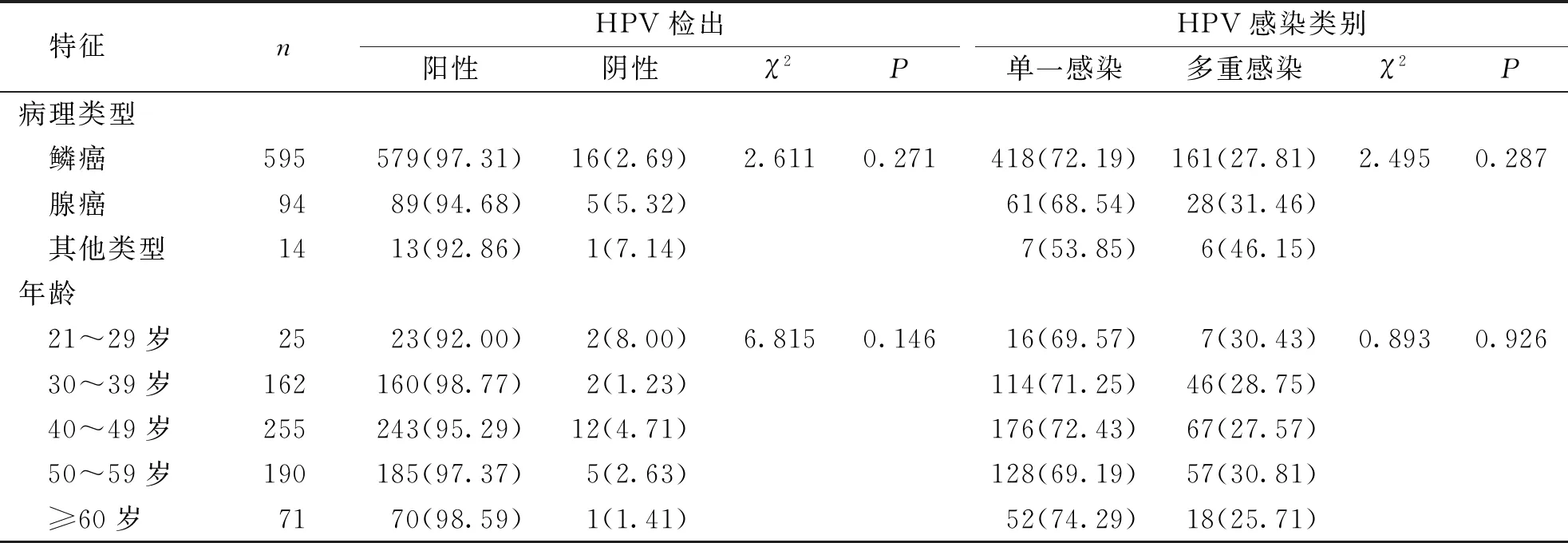
表3 CC组患者HPV感染与病理类型、年龄的关系
3 讨论
流行病学研究表明,高危型HPV的持续感染是CC发生的必要条件[8]。本研究结果显示,在云南地区超过95.0%的CC和CIN患者都有HPV感染,且超过99.0%HPV阳性的CIN患者可检出高危型HPV感染,该结果表明高危型HPV感染是云南地区CC和CIN发生的主要原因,与目前CC患者流行病学调查结果是一致的[8]。流行病学研究发现,从感染HPV到最终发展成为宫颈癌需要经历数十年[11],这也是本研究中CIN组患者年龄低于CC组患者年龄的原因。研究发现,HPV16是CC患者中最常见的高危型HPV,而其他高危型HPV型别(HPV18、52及58等)在不同国家和地区CC患者中的检出率存在不同[12];从全球范围看,HPV16和18 型是最常见的高危型HPV型别[13-14];国内调查结果显示HPV58和HPV52的检出率高于HPV18[15-16]。本研究发现,云南地区CIN患者中HPV16和HPV58是最主要的HPV型别、其次为HPV18型,CC患者中HPV16和HPV18是最主要的HPV型别、其次为HPV58,这与Chen等[17]、Li等[18]研究结果是一致的。该结果说明在中国人群中HPV58的流行能力强于HPV18,但HPV18的致癌能力要强于HPV58型。此外,本研究结果还显示,从CIN到CC,HPV16和HPV18的感染率随着病情严重程度上升,而HPV58感染率随着病情严重程度增加而下降,这不仅说明了HPV16和18在CC的发生中发挥重要作用,并进一步说明了HPV18的致癌能力强于HPV58型。
由于HPV不同亚型之间结构的差异,使不同亚型之间基本没有交叉保护性抗体,所以HPV病毒可以单一或者多重感染宿主细胞[19]。已有研究发现,多重HPV感染较单一HPV感染更容易诱发CC,可能与多重感染的HPV型别间存在协同促进效应有关[20];但也有研究表明,单一和多重HPV感染对于女性患CC的风险无差异[21]。本研究结果显示,CC患者单一HPV感染率>CIN患者,而CC患者中HPV多重感染率 CC是危害女性健康的重要癌症之一,且近年来发病率呈年轻化趋势。本研究结果显示,超过99.0%的CC和CIN病例均有高危型HPV的感染,其中感染HPV16和HPV18的病例超过80%。因此,加强对高危型HPV的筛查将有助于CIN变以及CC的防治。同时,也表明注射针对高危型HPV的CC疫苗将有助于降低CC的患病风险,因此,未来应加大CC疫苗的推广力度。

