三维多孔支架表面成型二氧化钛纳米管阵列体外促进人牙髓干细胞粘附及成骨分化
于泓川,何懋典,刘 鹃,李军霞,帅 逸,臧圣奇,金 磊
外伤、感染、先天畸形、原发性疾病、药物治疗或手术切除肿瘤均可导致骨缺损的产生。有统计数据显示,美国每年单独治疗骨缺损的费用高达50亿美金,骨缺损治疗配套的肿瘤、骨恢复、愈合不良治疗的费用更是不计其数[1]。成本高昂的自体骨及同种异体骨是骨缺损修复的最佳代用品,但自体骨存在数量受限、二次创伤及术后吸收的问题,同种异体骨也往往有免疫排斥、感染传播的风险。因此,设计人工骨修复策略的骨组织工程应运而生,并在最近几十年受到了极大关注。
在过去的60年中,植入物的表面技术已经从生物惰性表面(例如钛和钽)发展到生物活性表面(例如等离子喷涂的羟基磷灰石和其他陶瓷),再到最新的下一代仿生工程纳米技术[2]。其中关于二氧化钛(TiO2)纳米管的研究展示了巨大潜力。TiO2纳米管一般通过阳极氧化法生成于纯钛表面,直径为纳米级,它将平坦表面变成微观立体,极大地增加了接触面积,并可调控细胞行为。成型的TiO2纳米管比Ti表面更能促进细胞粘附、成骨分化、矿化,并有更强的抗菌性能[3-4],有人在兔体内的实验发现TiO2纳米管使骨结合强度提高了9倍[5]。
虽然阳极氧化法可以对纳米管的长度、直径和阵列进行调控,但这种方法产生的最终产品受到钛金属机械性能和各类成本的限制,同时产品外观多为平板和柱状,无法适应骨组织工程的多元化仿生需求,例如模拟骨小梁的三维结构和机械性能。不可吸收骨骼支架需要良好连通的微米级孔隙网络,以便物质运输、血管化和组织渗透生长,为功能性活骨形成提供足够的条件[6]。不过,多数不可吸收多孔支架的机械性能尚未令人满意,可吸收支架应用时更要额外考虑降解速率对成骨产生的影响[7]。
二氧化锆(ZrO2)是一种不可吸收的生物相容陶瓷材料,具备优异的机械强度和韧性。课题组前期通过模板法制作了多孔ZrO2支架[8],很好地模拟了骨小梁的多孔结构和机械性能。
人牙髓干细胞(human dental pulp stem cells,hDPSCs)是一种间充质干细胞,广泛地存在于人牙齿内的活体牙髓中,可多向分化、自我更新,同时具备取材便捷、免疫原性低的特征,是再生组织工程的潜力细胞[9]。本课题组对hDPSCs的取材、培养、分化已经积累了一定的经验,并曾通过慢病毒转染技术对其部分成骨基因完成了转染[10-11]。
因此,本实验利用水热合成将TiO2纳米管成型于ZrO2三维多孔支架表面并形成阵列,使两者的生物学和机械性能优势结合,制造出毫米级、微米级、纳米级分层满足骨修复多层次需求的骨组织工程材料,并结合使用hDPSCs探究其对于干细胞粘附和增殖的影响。
1 材料与方法
1.1 纳米ZrO2支架的制备
将定形好的聚氨酯模版(1 cm×1 cm×0.5 cm,60 ppi)浸泡于2 mol/L的NaOH中8 h后取出,生理盐水冲洗,烘箱(精宏,中国)40 ℃干燥。超声水浴条件下,按照粉液质量比2∶3将钇稳定纳米ZrO2粉(Tosoh,日本,粒径29 nm,纯度94.46%)少量多次加入混合溶液(250 μL 质量分数5%PVB乙醇溶液∶1 mL 95%乙醇溶液∶1 mL去离子水)中得到质量浓度60%的纳米ZrO2均匀液态浆料。聚氨酯模板在ZrO2浆料中浸润后离心机离心3 s去除多余浆料,40 ℃烘箱中干燥24 h后放入烧结炉(科晶,中国),2 ℃/min升温至660 ℃并保持30 min,10 ℃/min升温至1 360 ℃后持续180 min,再0.5 ℃/min降温至1 060 ℃后自然降温。进行再次烧结(重复4次):支架浸入浆料、吹堵孔、干燥后烧结,10 ℃/min升温至1 360 ℃,再1 ℃/min升温至1 400 ℃并保持180 min,5 ℃/min降温至800 ℃后自然降温。
1.2 纳米TiO2浆料涂层及支架的烧结
整个过程与ZrO2浆料类似,只是溶质为TiO2纳米粉末(阿拉丁,中国,粒径25 nm,纯度99.8%,金红石),配制得到质量分数5%、15%、30%的TiO2均匀液态浆料。同样的烧结前准备后烧结,5 ℃/min升温至500 ℃并保持120 min后自然降温。
1.3 TiO2纳米管的形成
将冷却后的支架浸泡在水热反应釜聚四氟乙烯内胆中的NaOH溶液(10 mol/L),密封反应釜后放入高温炉以5 ℃/min加热至110 ℃并保持12、24、36 h,自然冷却至室温,去离子水反复冲洗至冲洗液pH=7。烘箱40 ℃干燥24 h。
1.4 收缩率
使用数显卡尺(广陆,中国)测量待测支架长、宽、高,计算其体积。使用成型支架平均体积V1除以聚氨酯模版平均体积V2得到其收缩率。
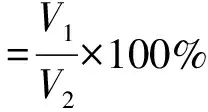
1.5 孔隙率
利用比重瓶法测定支架孔隙率。加满三蒸水的比重瓶称重W1,待测支架干重W2。将支架浸入比重瓶的水中,静置24 h使气泡排出。使用三蒸水加满比重瓶测重W3,取出饱含三蒸水的支架,称取比重瓶剩余重量W4。孔隙率计算公式如下。

1.6 压缩强度
测量每个样品的尺寸,输入程序;将待测样品放入电子万能材料试验(Instron3365,美国)样品台,上下垫纸,设定机头加载速度为0.5 mm/min,施加负荷直至试样破坏。记录最大强度数值。
1.7 扫描电子显微镜(SEM)和能谱仪(EDS)
支架表面喷金至少40 s后置于电镜托盘上,使用场发射扫描电子显微镜(Quanta 250FEG,美国)观察表面形态,并通过配套能谱仪(Oxford Instruments,英国)分析成分。
1.8 拉曼光谱(LRS)
通过拉曼光谱仪(Horiba,法国),利用 100~800 cm-1的拉曼谱扫描各组样品表面。
1.9 细胞培养
将支架放入48孔板中,每个样品使用普通培养基浸泡12 h之后,吸出培养基,滴入约5×105个培养3代的hDPSCs。放入培养箱(力申,中国)6 h之后,每孔加入含10%比例胎牛血清的培养基0.5 mL,每2 d换液。hDPSCs由临床患者拔除的第三磨牙中获取,已通过患者知情同意。
1.10 SEM和鬼笔环肽观察粘附细胞形态
接种6 h后,使用PBS洗涤3次后,细胞固定液(碧云天,中国)常温下固定30 min,细胞洗涤液(碧云天,中国)洗涤3次,每次配合摇床晃动5 min。a. 使用 10%、30%、50%、80%、95%、100%(2次)的乙醇层级脱水各10 min,冷冻干燥机干燥12 h。常规SEM处理及观察。b. 将1∶100的二抗稀释液(碧云天,中国)每孔滴入300 μL,室温避光孵育 30 min后,PBS配合摇床洗涤3次,每次5 min,共聚焦显微镜(Zeiss,德国)下观察细胞形态。
1.11 CCK-8检测细胞增殖能力
使用 CCK-8(诺唯赞,中国)试剂盒检测3、5、7 d样品,按照产品说明书每孔加入300 μL检测液,处理2 h后,吸出100 μL进行酶标仪(Tecan,荷兰)检测。
1.12 碱性磷酸酶检测细胞成骨分化能力
利用成骨诱导液培养细胞,按照产品说明书使用碱性磷酸酶(ALP)检测盒(碧云天,中国)检测实验组和对照组4、7 d ALP活性。
1.13 统计分析
格拉布斯准则去除极端值,Shapiro-Wilk test验证各组正态齐性,Bartlett-test检验组间方差齐性,使用ANOVA进行方差分析,多组样本之间使用Tukey test对比差异。每组有效样本不少于3个,P<0.05计为有统计学差异。统计分析及作图均使用R(version 3.6.3)进行。
2 结 果
2.1 成品支架成型
聚氨酯膜版(图1A)通过一系列处理最终得到了多孔蜂窝状立方体目标支架,肉眼观支架为淡黄色,与模板形状相似且无明显堵孔(图1B)。15个样品支架长、宽、高平均为7.35 mm、7.49 mm、4.42 mm,对比初始模板体积收缩率约为48.4%。场发射电子显微镜低倍观测到支架孔径为230~820 μm,且无堵孔、表面光滑、无明显裂痕(图1C)。

A:成型的聚氨酯模版;B:15%TiO2涂层支架;C:SEM( ×120)观察15%TiO2涂层支架
2.2 各组微观表面及元素分析
扫描电子显微镜高倍观察个组样品,可发现NaOH处理时长和涂层TiO2浓度均影响表面形态,15%TiO2涂层NaOH处理24 h的样品表面观测到了成型的TiO2纳米管阵列。
NaOH处理12 h仅在紧密连接的ZrO2陶瓷颗粒表面形成分散的指状凸起,反应底物(TiO2)越充足,凸起结构越密集(图2A、D、G)。即使NaOH处理时间延长,5%组样品仍是分散的指状凸起(图2B、C)。反应底物充足的样品,过长的NaOH处理时长会使表面结构杂乱化(图2F、I)。预期的管样阵列结构出现于底物充足、反应时长24 h的样品(图2E、H)。15%TiO2涂层NaOH处理24 h的样品表面结构最优,类似玫瑰花瓣的管壁组成了不规则蜂窝样阵列结构,孔径100~800 nm不等(图2E、图4D)。EDS对表面元素的分析证实了底层支架Zr成分。同时TiO2涂层浓度越高,对Zr元素掩盖作用越明显(图2G、K、L)。
A~I:SEM( ×24 000)观察各组表面纳米形态;J~L:EDS分析5%、15%、30%TiO2涂层表面的元素比例
2.3 压缩强度和孔隙率
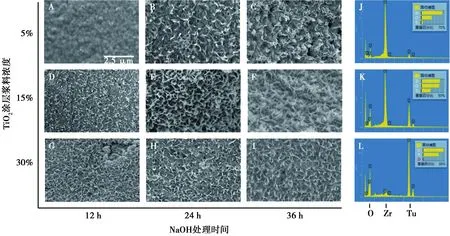
经过万能试验机测试,发现最终支架有两种典型的压缩强度-位移关系曲线(图3A)。第Ⅰ类出现最大断裂强度后压缩强度急剧下降,第Ⅱ类最大压缩强度较第Ⅰ类低,没有明显的强度骤降。复合TiO2后样品的机械强度与原有ZrO2支架组均无统计学差异(P>0.05),约为1.5 MPa(图3B),但双因素方差分析发现5%类样品与15%类样品的压缩强度存在统计学差异(P<0.05)。利用比重瓶法对比各组孔隙率,各组孔隙率值均约80%左右,各组之间均无明显差异(P>0.05)(图3C)。
A:本实验全部支架的两类特征性压缩强度-位移曲线图;B:各组压缩强度;C:各组孔隙率;*:P<0.05
2.4 微管晶型鉴定
LRS检查了ZrO2支架组、15%TiO2涂层组(未经NaOH处理形成纳米管)和纳米管组型样品的晶体结构(图4A),并联合SEM分析结果。纯ZrO2陶瓷颗粒(图4B)在145 cm-1、259 cm-1和643 cm-1处显示拉曼峰。用TiO2覆盖表面后(图4C),仅有金红石型TiO2的237 cm-1、445 cm-1和609 cm-1特征峰[12]。当纳米管形成后(图4D),两个物质的拉曼光谱重叠并且金红石相的TiO2拉曼反射表现较弱。

A:拉曼光谱仪(100~800 cm-1)检测ZrO2支架组、15%TiO2涂层组、纳米管组样品;B~D:扫描电镜( ×30 000)观测ZrO2支架组、15%TiO2涂层组、纳米管组样品
2.5 hDPSCs细胞粘附
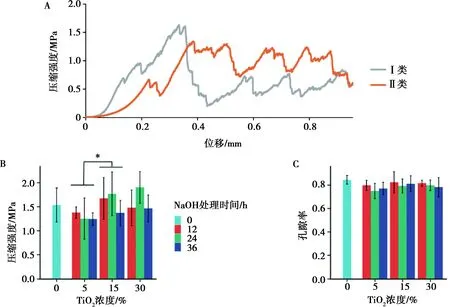
将未形成纳米管的样品(图4C)设为对照组,纳米管成型样品(图4D)设为实验组,两者的唯一不同在于是否经过NaOH处理形成TiO2微管。hDPSCs接种6 h后,通过SEM看到对照组表面细胞团块呈无形态的摊平样貌(图5A),实验组表面有细胞丝状伪足散布在纳米管阵列的孔中,与表面空隙形成了互锁的细胞结构(图5B)。利用鬼笔环肽可染色细胞肌动纤维骨架[13],接种后6 h的染色图片也观测到了实验组呈现出更为明显的纺锥状骨架伸展(图5C、D)。
A、B:SEM( ×4 000)观察对照组及实验组表面,实验组附带局部放大细胞伪足;C、D:鬼笔环肽染色后共聚焦显微镜( ×200)观察对照组及实验组
2.6 hDPSCs细胞增殖和成骨活性
CCK-8检测3、5、7 d的OD值表明两组之间无明显统计学差异(P>0.05)(图6)。但是在成骨诱导液的培养条件下,ALP检测表明实验组细胞4、7 d的ALP活性较实验组明显增高(P<0.05)。
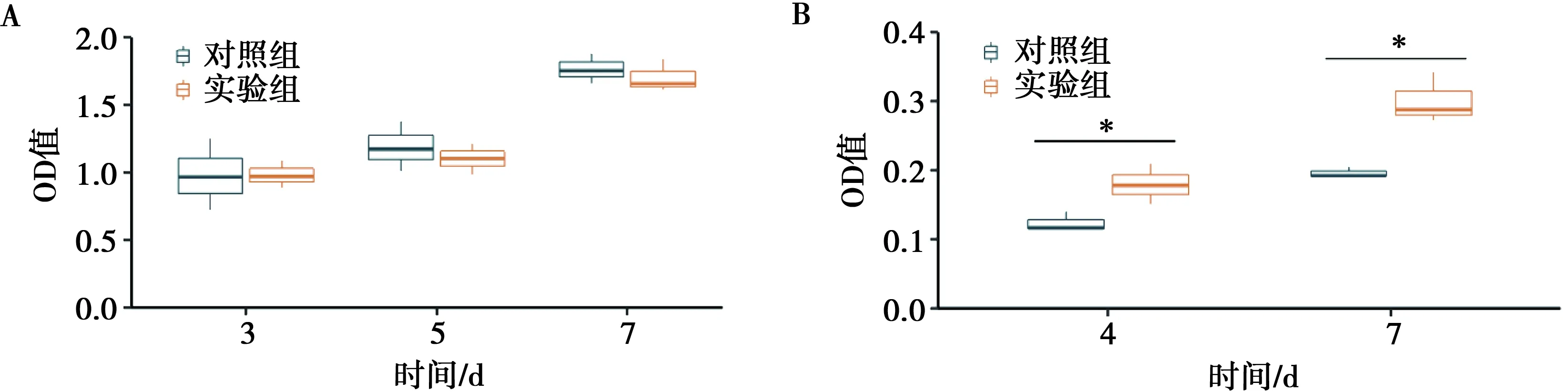
A:CCK-8检测法对各组进行细胞定量;B:实验组和对照组的ALP活性;*P<0.05
3 讨 论
骨组织工程领域的研究目标是设计出优于自体骨和同种异体骨的外源性骨修复策略,因此必须从疾病损伤和治疗的角度,进行材料、制造方法和应用途径的选择[14]。
从临床角度考虑,骨组织本身足以愈合小的骨缺损及裂纹,但是超出阈值的缺损往往不能较好地恢复。一般认为这个阈值为直径2.5 cm,超过阈值则需要骨组织工程材料的帮助[15]。成型的不可吸收骨替代材料能够在缺损处提供空间支撑、时间维持和应力配适,进而帮助机体早期承力、美学恢复和远期功能行使,同时不会因溶解或吸收而产生代谢物质、造成局部微环境改变,是当下不可替代的一种骨修复策略。
本实验采用的ZrO2及TiO2具备良好的生物安全性,已经临床使用多年[16]。本复合支架的两类断裂曲线(图3A)与小梁结构固有形态有关。表面小梁均匀的支架整体受力并在碎裂前形成压缩强度高点,符合第Ⅰ类曲线。而有些支架表面小梁结构不均匀导致分块碎裂,不能呈现整体受力的最大机械强度,表现为第Ⅱ类曲线。TiO2的烧结温度约为1 450 ℃,本方法的处理温度最高为500 ℃,仅去除浆料内的有机杂质,不能使TiO2颗粒致密化形成陶瓷层,因此无法明显增强支架强度(图3B)。15%TiO2涂层NaOH处理24 h的样品,底物充足、反应时长适中,表面观测到了成型的孔径100~800 nm的TiO2纳米管阵列(图2E),其空管样的结构极大减弱了对拉曼波的反射,并且使底层ZrO2暴露于拉曼波(图4A)。阵列略微增加原支架压缩强度至1.76 MPa,接近骨松质2~12 MPa的固有性能[17]。而相对过量的NaOH强碱溶液腐蚀了5%TiO2涂层组并降低了其机械强度,因此造成这两个变量样品出现统计学差异(P<0.05)(图3B)。最终支架预期可形成较好的应力传递,减少骨-修复体结合界面不良应力集中及界面组织损害,优化患者体验和使用年限。满足机械强度的同时,支架具备相互交联的孔网络,约80%的孔隙率很好地模拟了骨小梁50%~90%孔隙率的特征[6]。230~820 μm满足物质交换及血管向内生长的需求,细胞、神经和血管的进入和持续停留将对于骨组织的重塑产生重要积极影响[18]。
本实验也证实,此支架方便运输,并且可通过临床常见的高温蒸汽或酒精浸泡消毒处理。在制造成本低的同时,无额外运输、临床处理成本,不存在供体感染风险。
机体内的细胞行为依赖于它们与细胞外基质(ECM)的相互作用[19]。人造底物表面上的纳米特征可以与天然ECM相同的方式影响蛋白及细胞粘附、细胞增殖、细胞生化功能甚至细胞分化[20]。蛋白吸附是材料和机体之间的首次交互,影响后续细胞行为。阳极氧化法生产的TiO2管一般为锐钛型,有人发现经过特殊处理得到的金红石型更有利于血清蛋白粘附[21]。同时,细胞表面的整联蛋白与早期附着息息相关,附着过程的关键是力高度敏感的纳米管-整联蛋白-细胞骨架连锁反应[22]。表面纳米结构孔径决定了细胞表面粘附蛋白的点位和间距,两者之间的粘附力分散在整联蛋白上并传递给细胞骨架,细胞骨架上的压力会进一步触发一系列细胞内反应,从而改变代谢平衡[19]。本实验通过扫描电镜及鬼笔环肽染色细胞肌动蛋白骨架,观测到了TiO2纳米结构阵列产生了类似ECM的作用,促使人牙髓干细胞在接种早期形成丝状伪足、延伸细胞骨架(图5B、D),对细胞早期粘附产生了积极作用,这是骨组织工程希望得到的材料性能[14]。同时,实验组表面相对不规则的微观形态并未阻滞细胞增殖(图6A)。细胞内ALP在牙本质和骨组织成骨矿化的早期出现表达上调,是干细胞成骨分化的重要指标[10]。成骨诱导液培养条件下,实验组的表面细胞有更好的成骨分化表现(图6B)。但是,表面成型TiO2纳米管阵列的多孔支架在机体中具体的骨修复表现处于未知状态。
综上所述,本实验成功提出了一种表面TiO2纳米管阵列的成型策略,突破了异类底层材料的限制,成功结合了具备优异宏观性能的三维多孔ZrO2支架。从毫米级、微米级、纳米级分层设计并制造出一种潜在满足骨修复多层次需求的骨组织工程材料,并且初步验证了对于干细胞的早期粘附和成骨分化具有促进作用。
注:所有作者声明不存在利益冲突

