响应面法优化乳酸乳球菌Z103菌株产抑菌物质的发酵条件
杜琨

摘要:以分离于高原酸奶中的乳酸菌Z103为研究对象,通过单因素试验确定蔗糖、大豆蛋白胨、酵母浸膏、MgSO4、NaCl、牛肉膏、Na2HPO4、(NH4)2SO4、装液量、接种量、发酵温度和pH值对产抑菌物质活力的影响,应用响应面法的Box-Behnken设计对产抑菌物质发酵条件进行优化。结果表明,当发酵液pH 值7.0、装液量40 mL、大豆蛋白胨含量 9.6 g/L 时可获得抑菌物质最大抑菌圈直径为1.350 cm,优化后乳酸菌产抑菌物质的效价较优化前提高了41.17%。该模型能科学地预测抑菌物质的合成情况。响应面法可有效、成功地优化抑菌物质的发酵条件。
关键词:抑菌物质;乳酸乳球菌;响应面法;发酵条件;优化
中图分类号:S182 文献标志码: A 文章编号:1002-1302(2021)10-0155-07
从高原酸奶中分离出产抑菌物质的乳酸菌,经过发酵条件的优化,生產出活性高、抑菌普广的抑菌物质,该种抑菌物质有广阔的发展前景,主要原因在于:抑菌活性高,比nisin的抑菌活性高得多;成本低,安全性高;来源广泛。因此,从高原酸奶中生产抑菌物质的研究备受国内外研究人员的关注。
PB试验设计(Plackett-Burman design)是一种经济有效的二水平试验设计方法[1-3],它可以从众多考察因素中快速有效地筛选出主要的影响因素[4-7]。响应面法(response surface methodology,RSM)是一种优化生物过程的综合技术,可同时对影响生物产量的因子水平及交互作用进行优化与评价[8-11],快速有效地确定多因子系统的最佳条件,该法已被广泛应用于培养基和培养条件的优化[12]、提取技术和酶学性质的研究[13-16]、异黄酮[17-18]及药物的作用[19-20]等研究方面。利用JMP(Version 4.0.5,SAS Institute Inc.,1989—2001)实验设计软件对影响乳酸菌产抑菌物质产量的各方面因素进行优化研究,筛选出主要影响因子。在此基础上,借助Box-Behnken试验设计,对主要影响因子的最佳水平及其交互作用做进一步研究,以期获得较高产量的乳酸菌产抑菌物质。
1 材料与方法
1.1 试验材料
生产菌:乳酸乳球菌Z103菌株,由西藏高原酸奶中分离得出。 检测指示菌:金黄色葡萄球菌(Staphylococcus aureus),由陕西师范大学食品工程与营养科学学院微生物实验室提供。该试验于2018年12月在陕西师范大学食品工程与营养科学学院微生物实验室开展。
1.2 主要试剂
蔗糖、酵母浸膏、MgSO4·7H2O、NaCl 、牛肉膏、大豆蛋白胨、Na2HPO4·12H2O、(NH4)2SO4、KH2PO4、亮氨酸等试剂均为国产。
1.3 培养基
种子培养基:1%大豆蛋白胨、1%酵母浸膏、0.5%NaCl、0.05%MgSO4·7H2O、0.034%亮氨酸、0.5%蔗糖、pH值6.8。
活化培养基:在种子培养基中加入1.5%琼脂。
发酵培养基:20 g/L蔗糖、10 g/L大豆蛋白胨、10 g/L酵母浸膏、10 g/L牛肉膏 、0.4 g/L MgSO4·7H2O、5 g/L NaCl、18 g/L Na2HPO4 ·12H2O、12 g/L (NH4)2SO4。
发酵液效价检测培养基:1%酵母浸膏、1%大豆蛋白胨、0.5% NaCl、pH值7.0。
1.4 主要仪器与设备
TQHZ-2002A恒温振荡培养箱,太仓市华美生化仪器厂;GHP-250恒温培养箱,扬州市三发电子有限公司;SB-3S-1无菌操作台,上海博迅实业有限公司医疗设备厂;XY280B不锈钢蒸汽消毒器,上海三申医疗器械有限公司;GL-20G-Ⅱ冷冻离心机,上海安亭仪器设备有限公司;GHP-250智能光照培养箱,扬州市三发电子有限公司。
1.5 试验方法
1.5. 菌种活化 将保藏的乳酸菌和金黄色葡萄球菌斜面菌种转接至各自的活化培养基,分别于30 ℃和37 ℃培养18 h,使菌体恢复生理活性。
1.5.2 种子瓶培养 以2%的接种量将培养了 18 h 的Z103菌株转接入种子培养液中,于30 ℃ 150 r/min 的培养条件下培养18 h备用。
1.5.3 发酵培养 依照试验设计配制发酵培养基,将种子液按设计接种量分别接种于不同的处理中,按设计温度置于恒温振荡培养箱中150 r/min培养24 h。
1.5.4 乳酸菌产抑菌物质抑菌活性测定方法 将供试菌种接种培养(37 ℃培养24 h)后,用血细胞计数板对活化好的菌液进行计数,用无菌水将菌液浓度调至106 CFU/mL。用改进滤纸片法测量抑菌圈大小。
1.5.5 试验设计
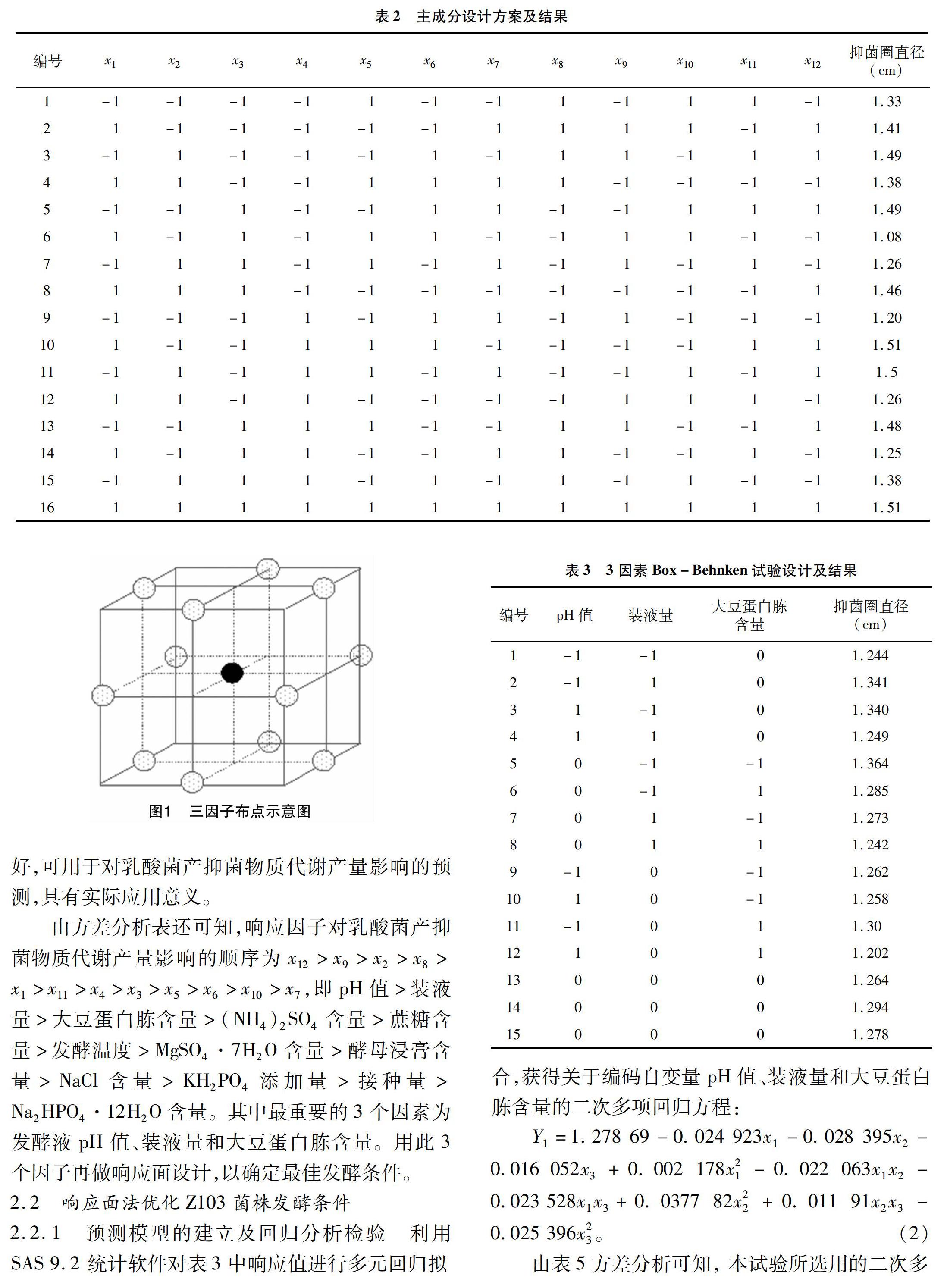
1.5.5.1 主成分分析 在单因素基础上对乳酸菌产抑菌物质发酵培养基进行主成分设计,降维筛选出影响显著的前3个因子,最终再结合响应面设计确定最佳发酵培养基配方。主成分试验设计水平见表1,设计方案及结果见表2。
1.5.5.2 响应面分析 试验选取通过降维分析得到的3个因子作为响应因子,见图1,以发酵清液抑菌圈直径作为响应值(Y1),通过Box-Behnken Design进一步进行优化。试验方案及结果见表3。
1.5.6 模型验证试验 根据试验结果选择最理想的5组发酵条件进行验证试验,并进行相关距离分析,验证产生高原乳酸菌素模型的有效性。
2 结果与分析
2.1 Z103菌株发酵培养条件关键因子的确定
对表2的结果进行分析,建立Z103菌株代谢产量初步回归模型:
Y1=1.374 375-0.016 875x1+0.030 625x2-0.010 625x3+0.011 875x4+0.006 875x5+0.005 625x6+0.000 625x7+0.029 375x8-0.038 125x9-0.004 375x10+0.013 125x11+0.106875x12。(1)
由式(1)可知,乳酸菌产抑菌物质代谢产量与蔗糖含量、酵母浸膏含量、装液量和接种量呈负相关,而与其余响应因子均呈正相关。由表4方差分析看出,误差项不显著,而多元回归系数R2=0.953 7,说明回归方程(1)能够在95.37%的置信度上解释响应因子对响应值的影响,试验数据与所采用的二次数学模型基本符合,模型与实际情况拟合程度较好,可用于对乳酸菌产抑菌物质代谢产量影响的预测,具有实际应用意义。
由方差分析表还可知,响应因子对乳酸菌產抑菌物质代谢产量影响的顺序为x12>x9>x2>x8>x1>x11>x4>x3>x5>x6>x10>x7,即pH值>装液量>大豆蛋白胨含量>(NH4)2SO4含量>蔗糖含量>发酵温度>MgSO4·7H2O含量>酵母浸膏含量>NaCl含量>KH2PO4添加量>接种量>Na2HPO4·12H2O含量。其中最重要的3个因素为发酵液pH值、装液量和大豆蛋白胨含量。用此3个因子再做响应面设计,以确定最佳发酵条件。
2.2 响应面法优化Z103菌株发酵条件
2.2.1 预测模型的建立及回归分析检验 利用SAS 9.2 统计软件对表3中响应值进行多元回归拟合,获得关于编码自变量pH值、装液量和大豆蛋白胨含量的二次多项回归方程:
Y1=1.278 69-0.024 923x1-0.028 395x2-0.016 052x3+0.002 178x21-0.022 063x1x2-0.023 528x1x3+0.0377 82x22+0.011 91x2x3-0.025 396x23。(2)
由表5方差分析可知, 本试验所选用的二次多项模型具有高度的显著性(P=0.014 1<0.05);失拟项P值(0.373 0)较大,表明相对于纯误差而言,失拟项不显著,多元拟合系数R2=0.939 9,表明仅有6.01%的Z103菌株代谢产量总变异不能由此模型进行解释,其实际值与预测值之间具有较好的拟合程度,可以用该方程对不同发酵条件下的响应值进行预测。
由表5还可以看出,发酵液pH值和装液量的一次项、装液量和大豆蛋白胨含量的二次项均具有极显著性;大豆蛋白胨含量的一次项、发酵液pH值和装液量的交互项以及发酵液pH值和大豆蛋白胨含量的交互项显著。对回归系数进行检验, 表明发酵液pH值和装液量的二次项以及装液量和大豆蛋白胨含量的交互项对Z103菌株代谢产量影响呈正效应,其余各因子对其影响为负效应,回归模型的F值为8.695 478,P等于0.014 1,说明模型的回归效果显著具有实际应用意义。剔除二次回归方程中不显著项,优化后的回归模型方程为
Y=1.278 69-0.024 923x1-0.028 395x2-0.016 052x3+0.037 782x22-0.025 396x23-0.022 063x1x2-0.023 528x1x3。(2)
2.2.2 Z103菌株代谢产量响应面分析与优化 由图2见,固定大豆蛋白胨含量为零水平,当发酵液pH值不变且处于较低水平时,随着装液量的升高响应值呈开口向上的抛物线;而发酵液pH值处于较高水平时,随着装液量水平增加,响应值几乎呈线性下降,之后略有上升。当固定装液量不变且处于较低水平时,随着发酵液pH值升高响应值有小幅增加,二者呈线性变化;当固定装液量不变且处于较高水平时,随着发酵液pH值的升高响应值呈线性下降,且变化幅度较大。从发酵液pH值和装液量交互作用的等高线图(图2右)可以看出,响应值对装液量的变化更为敏感。这也进一步验证了响应面图分析的正确性。
由图3可见,固定装液量为零水平,当发酵液pH值不变且处于较低水平时,随着大豆蛋白胨含量的升高响应值迅速增加,之后略有下降;而当发酵液pH值不变且处于较高水平时,随着大豆蛋白胨含量的增加,响应值先略有上升,之后迅速下降。当固定大豆蛋白胨含量不变且处于较低水平时,响应值随发酵液pH值变化趋势不明显;当固定大豆蛋白胨含量不变且处于较高水平时,随着发酵液pH值的升高响应值则呈线性下降,且变化幅度较大。从发酵液pH值和大豆蛋白胨含量交互作用的等高线图(图3右)可以看出,响应值对大豆蛋白胨含量的变化更为敏感。
由以上响应面图可知,发酵液pH值、装液量和大豆蛋白胨含量三者之间的交互作用出现鞍面,无极值的存在,说明不能从二次响应面上找出最佳参数,需进一步做岭脊分析,见表6。
利用SAS 9.2进行分析,得到回归模型存在稳定点,当编码半径为1.0时响应值Y(即抑菌圈直径)最大,约为1.347 36,此时优化参数为发酵液pH值7.0,装液量40 mL,大豆蛋白胨含量9.6 g/L。
2.3 回归模型验证试验
通过上述回归模型,采用SAS 9.2软件优化发酵条件,获得Z103菌株的最适发酵条件为发酵液pH值 7.0,装液量40 mL,大豆蛋白胨含量9.6 g/L,在此条件下抑菌圈直径可达到1.347 36 cm。采用上述条件进行验证试验,结果获得的抑菌圈直径为1.350 cm,与预测值的相对误差为0.48%;并且未进行发酵条件优化时,乳酸菌产抑菌物质的效价为850.26 IU/mL,优化后抑菌物质的效价达到 1 200.32 IU/mL,较优化前提高了41.17%。证明采用响应面法对乳酸菌产抑菌物质产生菌进行发酵培养基优化准确可靠,具有实用价值和指导意义。
3 讨论与结论
Z103菌株的代谢产物受发酵条件的影响很大,因此,对Z103菌株发酵培养基和外在条件进行优化研究十分必要。孙帅等都利用单因子和正交试验对发酵条件进行过研究[21-24]。Sen等采用响应曲面法对脂肽surfactin发酵条件进行了优化研究[25-26]。但这些研究主要是针对乳杆菌产生的细菌素发酵条件的研究,对从高原酸奶中提取能产生抑菌物质的Z103菌株的发酵条件和发酵培养基方面的研究报道较少。
本试验采用PB试验设计和响应曲面法对培养条件进行了优化。PB试验设计法是一种经济有效的二水平试验设计方法,它的主因素为正交设计,两因素之间的交互作用仅部分与主因素产生混淆。响应曲面法是一种优化生物技术过程的综合技术方法,它可以建立连续变量曲面模型,对影响生物过程的因素水平及其交互作用进行优化与评价,可快速确定多因子的最佳条件[27]。与传统方法相比,响应曲面法试验次数少,节省人力物力,已被广泛应用于培养基优化的实践中。
PB试验设计省时省力,可快速有效地从诸多相关因素中筛选出主要影响的内在因素和外部因素,在此基础上,通过响应曲面法建立数学模型,利用优化后的发酵条件产生的抑菌物质效价较原来提高了41.17%。
通过PB试验设计对主成分的分析,优选出对Z103菌株代谢产量有主要影响的3个因子为发酵液pH值、装液量和大豆蛋白胨含量。
失拟项P值较大,表明相对于纯误差而言,失拟项不显著,多元拟合系数R2=0.939 9,表明仅有6.01%的Z103菌株发酵产物总变异不能由此模型进行解释,其实际值与预测值之间具有较好的拟合程度,可以用该方程对不同发酵条件下的响应值进行预测。
由岭脊分析结果得出Z103菌株最佳发酵产抑菌物质的发酵条件为发酵液pH值7.0,装液量为40 mL,大豆蛋白胨含量为9.6 g/L。
参考文献:
[1]Demeo M,Laget M,Mathieu D. Application of experimental designs for optimization of medium and culture conditions in fermentation[J]. BioScience,1985,4:99-102.
[2]Kalil S J,Maugeri F,Rodrigues M I. Response surface analysis and simulation as a tool for bioprocess design and optimization[J]. Proeess Bioehemistry 2000,35(6):539-550.
[3]孙力军,陆兆新,孙德坤. Bacillus amyloliquefaciens ES-2液体发酵抗菌脂肽培养基及其主要影响因子筛选[J]. 食品工业科技,2008,29(5):60-63.
[4]Bie X M,Lu Z X,Lu F X,et al. Screening the main factors affecting extraction of the antimicrobial substance from Bacillus sp. fmbJ using the Plackett-Burman method[J]. World Journal of Microbiology and Biotechnology,2005,21(6):925-928.
[5]Li Y,Liu Z,Cui F,et al. Application of Plackett-Burman experimental design and Doehlert design to evaluate nutritional requirements for xylanase production by Alternaria mali ND-16[J]. Applied Microbiology and Biotechnology,2007,77(2):285-291.
[6]Ahuja S K,Ferreira G M,Moreira A R. Application of Plackett-Burman design and response surface methodology to achieve exponential growth for aggregated shipworm bacterium[J]. Biotechnology and Bioengineering,2004,85(6):666-675.
[7]罗 海,唐 洁,汪静心,等. 响应曲面法优化乳杆菌产细菌素的条件研究[J]. 食品工業科技,2012,33(13):163-166.
[8]饶 瑜,常 伟,唐 洁,等. 产细菌素屎肠球菌E6的特性分析及发酵条件优化[J]. 食品工业科技,2013,34(7):199-201,218.
[9]李 浩,任嘉红,叶建仁. 响应面法优化生防菌吡咯伯克霍尔德氏菌JK-SH007的发酵工艺[J]. 生物工程学报,2013,29(2):243-246.
[10]王鸿磊,王红艳,刘鹏丽,等. 响应面法优化胶冻样芽孢杆菌发酵条件的研究[J]. 中国农学通报,2012,28(8):63-67.
[11]Elibol M. Optimization of medium composition for actinorhodin production by Streptomyces coelicolor A3(2) with response surface methodology[J]. Process Biochemistry,2004,39(9):1057-1062.
[12]Wang Y X,Lu Z X. Statistical optimization of media for extracellular polysaccharide by Pholiota squarrosa(Pers.ex Fr.)Quel.AS 5.245 under submerged cultivation[J]. Biochemical Engineering Journal,2004,20(1):39-47.
[13]Lai L,Pan C C,Tzeng B K. The influence of medium design on lovastatin production and pellet formation with a high-producing mutant of Aspergillus terreus in submerged cultures[J]. Process Biochemistry,2003,38(9):1317-1326.
[14]劉国荣,张郡莹,王成涛,等. 响应面法优化弯曲乳杆菌RX-6代谢产细菌素的发酵培养基组成[J]. 食品科技,2013,38(3):1-8.
[15]Francis F,Sabu A,Nampoothiri K M,et al. Use of response surface methodology for optimizing process parameters for the production of α-amylase by Aspergillus oryzae[J]. Biochemical Engineering Journal,2003,15(2):107-115.
[16]张宽朝,陈 杰,马 伟,等. 响应面法优化草莓总黄酮提取工艺[J]. 江苏农业学报,2019,35(6):1450-1458.
[17]Wei Q K,Chen T R,Chen J T. Using of lactobacillus and bifidobacterium to product the isoflavone aglycones in fermented soymilk[J]. International Journal of Food Microbiology,2007,117(1):120-124.
[18]Otieno D O,Ashton J F,Shah N P. Isoflavone phytoestrogen degradation in fermented soymilk with selected beta-glucosidase producing L. acidophilus strains during storage at different temperatures[J]. International Journal of Food Microbiology,2007,115(1):79-88.
[19]Otieno D O,Ashton J F,Shah N P. Evaluation of enzymic potential for biotransformation of isoflavone phytoestrogen in soymilk by Bifidobacterium animalis,Lactobacillus acidophilus and Lactobacillus casei[J]. Food Research International,2006,39(4):394-407.
[20]史垠垠,石 瑞,曹福亮. 澄清白果汁酶解工艺的研究[J]. 南京林业大学学报(自然科学版),2010,34(3):11-14.
[21]孙 帅,常忠义,唐学明,等. 丙酸杆菌代谢物摇瓶补料分批发酵条件研究[J]. 西北农林科技大学学报(自然科学版),2011,39(7):135-140.
[22]付 燕,林 洋,王 蕙,等. 嗜酸乳杆菌P302菌株产类细菌素最佳条件的研究[J]. 中国微生态学杂志,2009,21(1):26-29.
[23]苏 芳,李 莉,罗 斌,等. 戊糖乳杆菌WH12-2-1产细菌素条件的优化[J]. 中国乳品工业,2010,38(3):10-15.
[24]张言慧,李晓雪,张 悦,等. 利用响应面方法优化产L-乳酸的合成培养基[J]. 中国酿造,2012,31(5):15-20.
[25]Sen R,Swaminathan T. Response surface modeling and optimization to elucidate and analyze the effects of inoculum age and size on surfactin production[J]. Biochemical Engineering Journal,2004,21(2):141-148.
[26]Trupkin S,Levin L,Forchiassin F,et al. Optimization of a culture medium for ligninolytic enzyme production and synthetic dye decolorization using response surface methodology[J]. Journal of Industrial Microbiology & Biotechnology,2003,30(12):682-690.
[27]Lu Y,Dong X,Liu S,et al. Characterization and identification of a novel marine Streptomyces sp. produced antibacterial substance[J]. Marine Biotechnology,2009,11(6):717-724.

