昆虫取食和机械损伤对棉花和玉米脂氧合酶活性的诱导作用
吕敏 卫甜 刘怀阿 苏建坤
摘要:脂氧合酶(LOX)是植物防御反应中的关键酶,脂氧合酶途径的产物包括茉莉酸、绿叶挥发物等,在植物防御反应中起着重要作用。为了明确脂氧合酶在昆虫取食和机械损伤诱导植物通信中的作用,以棉花、玉米为研究对象,分析不同处理(包括棉蚜取食和机械损伤诱导棉花及其相应挥发物诱导邻近玉米、玉米螟取食和机械损伤诱导玉米及其相应挥发物诱导邻近棉花)的诱导防御机制,测定不同方法处理24、48、72 h后棉花、玉米的脂氧合酶的活性。结果表明,昆虫取食和机械损伤不仅会诱导棉花、玉米植株的LOX活性升高,还能诱导邻近健康植株的LOX活性升高。研究结果表明,脂氧合酶在昆虫取食和机械损伤诱导的棉花、玉米间通信中起作用。
关键词:脂氧合酶;昆虫取食;机械损伤;棉花;玉米;诱导防御机制
中图分类号: S188+.3 文献标志码: A 文章编号:1002-1302(2021)10-0086-05
植物在其生长发育过程中形成了多种诱导防御机制来抵御生物因子的入侵[1],昆虫取食作为一种重要的生物胁迫而广泛存在于自然界中[2]。面对昆虫的取食危害,植物形成了直接诱导和间接诱导2种防御机制。直接诱导防御是指植物产生次生代谢物质直接杀伤昆虫,间接诱导防御是指植物通过释放一系列特定的挥发性化合物吸引昆虫的捕食性、寄生性天敌,从而减少昆虫的危害。脂氧合酶是昆虫取食诱导的挥发性化合物形成过程中的关键酶。
脂氧合酶(lipoxygenase,简称LOX)在生物体内主要催化含有(Z,Z)-1,4戊二稀结构单元的不饱和脂肪酸的加氧反应,生成过氧化物及其一系列次生产物。脂氧合酶是植物代谢过程中的关键酶,它在调节植物的生长发育、成熟衰老、抗虫、抗病及抗胁迫等过程中起着重要作用[3]。脂氧合酶通常处于静止状态,只有当生物体发育到一定阶段或受到环境胁迫时才启动[4-5]。脂氧合酶的诱导表达作用已经在植物受到机械损伤、昆虫取食和病原菌侵染中得到证明[6-10]。杨毛臀萤叶甲取食能诱导桤木叶片中酚类物质的含量增加,使得在防御反应中起作用的多酚氧化酶、脂氧合酶和过氧化物酶的活性增加,蛋白酶抑制剂也增多[11-13]。大豆通过LOX途径对昆虫的取食作出反应,大豆夜蛾(Anticarsia gemmatalis)取食大豆植物后会诱导脂氧合酶活性增加、蛋白酶抑制剂增多,同时,茉莉酸会激活编码蛋白酶抑制剂基因的转录[14]。
昆虫取食还能诱导植物间的通信作用,即昆虫取食不仅能诱导植物本身产生防御反应,还能诱导邻近健康植株产生防御反应[15-16]。植物间是通过空气进行交流的,暴露于二斑叶螨取食诱导利马豆释放的挥发物中的健康利马豆和黄瓜对捕食性螨的吸引力都增强[17-19]。Karban等通过田间试验发现,受伤艾草灌丛附近的烟草多酚氧化酶活性升高,受蝗虫、烟草天蛾取食程度的影响较小[20]。
棉花、玉米是重要的经济作物和粮食作物,研究它们之间的通信作用可为棉花、玉米的间作套种提供依据。本研究分析受到机械损伤和棉蚜取食棉花诱导棉花及其邻近健康玉米,以及受到机械损伤和玉米螟取食玉米诱导玉米及其邻近棉花的脂氧合酶活性,以期明确昆虫取食和机械损伤诱导棉花和玉米间通信作用的机制,有利于找到害虫综合防治的新途径。
1 材料与方法
1.1 试验材料
棉花品种为中棉35,将种子催芽后种于沙土(已灭菌)中,等到子叶完全展开后,将幼苗移栽到盛有营养液[21]的塑料杯(容量为250 mL)中,在温室中培养1~2周后供试。玉米品种是农大108,将玉米种子浸泡12 h后种于营养土中2周,再用于试验。
1.2 供试昆虫
供试昆虫为棉蚜,为室内饲养的品系,饲养在日光温室内(温度为25~35 ℃,相对湿度为60%~80%,自然光周期);玉米螟卵购自中国农业科学院植物保护研究所,室内饲养至3龄。饲养温度为 25~28 ℃,相对湿度为60%~80%,光—暗周期为 16 h—8 h。
1.3 试验处理
试验参照吕敏等的处理方法[15]进行处理。
1.4 酯氧合酶活性的测定方法
将棉花、玉米幼苗剪去根部后洗净,在液氮中研磨,加入0.1 g/g聚乙烯吡咯烷酮(PVPP)和 3 mL/g 浓度为0.1 mol/L、pH值为7.0、含Triton 0.1%的磷酸缓冲液(棉苗)或0.1 mol/L pH值为6.5的磷酸缓冲液(玉米),离心(4 ℃、12 000 g)20 min,上清液用于酶活性的测定。棉苗、玉米的 3 mL 反应体系为2.875 mL反应缓冲液、25 μL底物、100 μL酶液。棉苗的反应缓冲液为pH值为3.5的甘氨酸-盐酸缓冲液。
测定中用到的缓冲液:pH值为3.0~3.5的甘氨酸-鹽酸缓冲液,pH值为4.0~5.5的柠檬酸缓冲液,pH值为6.0~7.5的磷酸缓冲液,pH值为 8.0~9.0的硼酸缓冲液。底物的配制和活性测定参考Axelord等的方法[22]。
1.5 蛋白质含量的测定
参照Braford的考马斯亮兰G-250法测定蛋白质含量[23],以牛血清白蛋白作为标准蛋白制作标准曲线。
1.6 数据处理
各试验数据用Excel进行作图分析,并用SPSS软件进行处理间的差异显著性检验。
2 结果与分析
2.1 脂氧合酶的最适pH值
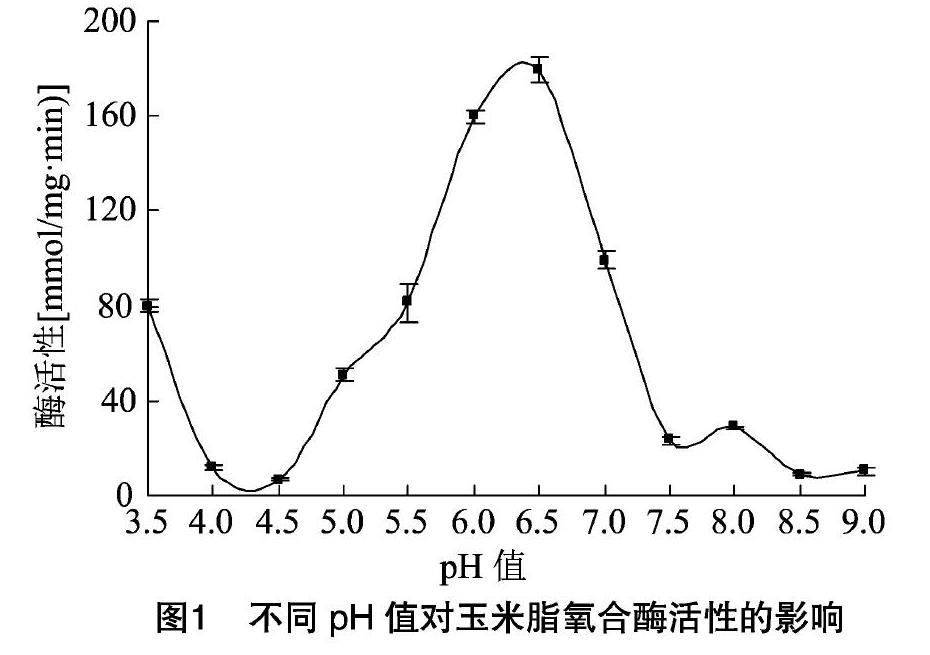
棉花脂氧合酶的最适pH值为3.5,本试验测定了pH值为3.5~9.0的玉米脂氧合酶活性的变化。如图1所示,玉米脂氧合酶的活性在pH值为6.5时最高。
2.2 机械损伤和棉蚜取食诱导棉花及邻近玉米脂氧合酶活性的变化
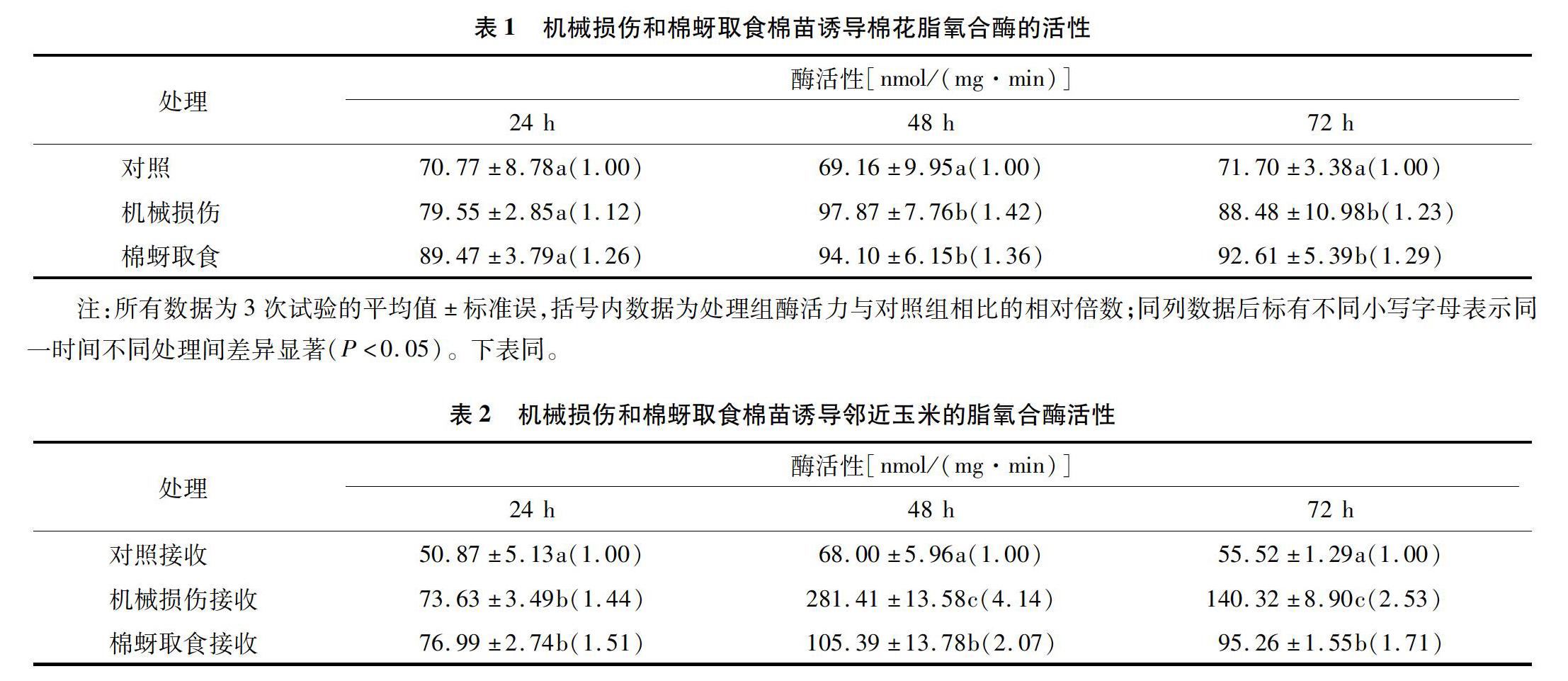
从表1、表2可以看出,机械损伤和棉蚜取食诱导棉花及其相应诱导挥发物接收玉米的脂氧合酶的活性与对照相比均有所增加。在处理后24、48、72 h,机械损伤诱导棉花脂氧合酶的活性分别为对照的1.12、1.42、1.23倍,棉蚜取食诱导棉花脂氧合酶的活性分别是对照的1.26、1.36、1.29倍,在处理后48 h达到最大值,为94.10 nmol/(mg·min)。在处理后24 h,机械损伤、棉蚜取食诱导挥发物接收玉米的脂氧合酶活性分别是对照的1.44、1.51倍,在处理后48 h,酶活性达到最大值,分别为281.41、105.39 nmol/(mg·min),分别是对照的4.14、2.07倍,随后在处理后72 h下降,但是处理72 h后的LOX活性仍然与对照间差异显著(P<0.05),分别是对照的2.53、1.71倍。
2.3 機械损伤和玉米螟取食诱导玉米邻近棉苗脂氧合酶活性的变化
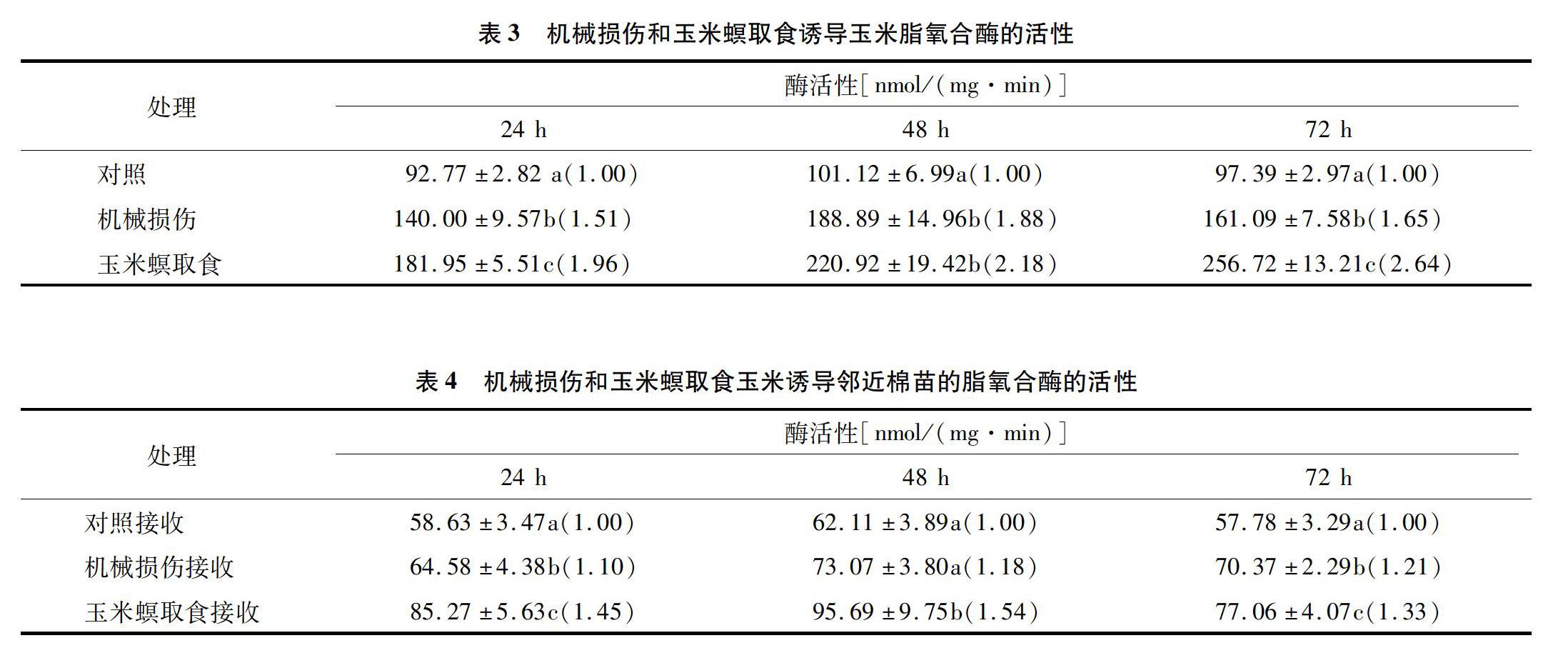
从表3、表4可以看出,玉米螟取食和机械损伤诱导玉米及其相应诱导挥发物接收棉苗的脂氧合酶的活性与对照相比均有所增加。机械损伤诱导玉米的脂氧合酶活性随时间增加,到48 h达到最大值,随后下降,而玉米螟取食诱导玉米脂氧合酶的活性最大值在72 h,为对照组的2.64倍。在24、48、72 h,机械损伤诱导挥发物接收棉花的脂氧合酶活性分别是对照组的1.10、1.18、1.21倍;玉米螟取食诱导挥发物接收棉苗脂氧合酶的活性分别为对照组的1.45、1.54、1.33倍。
3 讨论与结论
脂氧合酶是脂氧合酶途径中的关键酶。脂氧合酶途径可以生成一系列绿叶挥发性化合物,受伤植物释放的绿叶挥发物可直接杀伤植食性昆虫[24-25]。此外,脂氧合酶途径还参与信号分子的合成,如合成产物茉莉酸,在植物防御反应信号交流中发挥了重要的作用。昆虫取食和机械损伤能诱导植物脂氧合酶活性增加。豆青叶甲和三刺苜蓿角蝉取食诱导了番茄、大豆和棉花的脂氧合酶活性增加[26]。Qin等研究发现,机械损伤和棉蚜取食能诱导棉苗体内苯丙氨酸解氨酶和脂氧合酶活性升高[27]。本研究发现,棉花被棉蚜取食或受到机械伤害后,自身的脂氧合酶活性增加,这与秦秋菊的研究结果[28]一致,说明脂氧合酶途径参与了由机械损伤和昆虫取食诱导的棉花防御反应。试验结果还表明,机械损伤和玉米螟取食诱导玉米的脂氧合酶的活性显著增加(P<0.05)。玉米螟取食诱导玉米的脂氧合酶的活性比机械损伤诱导的高,这是由于昆虫取食和机械损伤对植物的诱导作用不同。因为许多昆虫取食后还能在伤口部位引入特异性激发子,如甜菜夜蛾(Spodoptera exigua)口腔分泌物中的脂肪酸-氨基酸轭合物(FACs)[29]。另外,机械损伤与昆虫取食损伤的不同还表现在时间上,玉米螟取食诱导玉米脂氧合酶的活性在72 h达到最大值,而机械损伤诱导玉米脂氧合酶的活性在48 h达到最大值。
越来越多的研究证明了植物间通信的存在。包括同种植物间的通信[17-18,27,30],异种植物间的通信作用也被很多试验证明[19-20]。秦秋菊等研究发现,棉蚜取食和机械损伤还能引起邻近的健康棉花脂氧合酶活性增加[28]。Lv等的研究结果证明了昆虫取食和机械损伤能诱导棉花和玉米间通信作用的存在,且苯丙氨酸解氨酶在其中起作用[31]。本试验结果表明,暴露于棉蚜取食和机械损伤的挥发物中健康玉米的脂氧合酶活性增加。另外,暴露于玉米螟取食和机械损伤挥发物中的棉苗的脂氧合酶活性也增加,表明脂氧合酶在昆虫取食和机械损伤诱导的棉花和玉米间通信作用中起作用。
暴露于植物衍生的挥发性化合物能激发邻近植物的防御反应[28,32-36],昆虫取食诱导产生的植物挥发性化合物通过表皮吸收或激活生理反应影响邻近植物[37]。昆虫取食诱导的植物挥发性化合物因不同的取食方式有不同的途径。蒺藜苜蓿被毛虫和螨取食会产生不同种不同量的挥发性化合物,茉莉酸、水杨酸都有积累,但是这种积累因口器不同而不同。螨类取食诱导的水杨酸积累量高于毛虫取食诱导的,同时这2种昆虫取食的茉莉酸积累的时间不同[38]。Turlings等对比分析了甜菜夜蛾取食后释放的挥发性化合物并与健康植株释放的挥发性化合物发现,在玉米被害后0~1 h内,二者没有区别,都是绿叶挥发物,5~6 h后,与对照的健康叶片相比,被害植株释放大量萜烯等(herbivore-induced plant volatiles,简称HIVs)[39],这更加证明不同昆虫取食诱导植物释放的挥发性化合物量和时间上不同。本试验得出,玉米螟取食诱导挥发物接收棉花以及棉蚜取食诱导挥发物接收玉米的LOX的活性都在48 h达到最大。这可能与挥发物释放的时效性有关,须要进一步分析棉蚜取食诱导棉花及玉米螟取食诱导玉米产生的挥发性化合物的成分及其释放时效。
参考文献:
[1]Karban R,Baldwin I T. Induced response to herbivory[M]. Chicago:Chicago University Press,1997.
[2]张庆花,陈迎迎,张海龙,等. 1-戊烯-3-酮在植物防御反应中的作用[J]. 植物生理学报,2019,55 (3):225-231.
[3]吴桂玲,冯定坤. 植物脂氧合酶的研究进展[J]. 广州化工,2019,47(17):37-39.
[4]Gardner W H. Biological roles and biochemistry of the lipoxygenase pathway[J]. HortScience,1995,30 (2):197-205.
[5]李翠霞,李志忠,张 继. 外源诱导物对百里香植株再生过程中脂氧合酶活性的影响[J]. 草业科学,2012,29(9):1390-1395.
[6]Saravitz D M,Siedow J N. The differential expression of wound-inducible lipoxygenase genes in soybean leaves[J]. Plant Physiology,1996,110(1):287-299.
[7]Wang C,Zien C A,Afitlhile M,et al. Involvement of phospholipase D inwound-induced accumulation of jasmonic acid in Arabidopsis[J]. The Plant Cell,2000,12(11):2237-2246.
[8]Vieira A A,Oliveira M G A,José I C,et al. Biochemical evaluation of lipoxygenase pathway of soybean plant submitted to wounding[J]. Brazilian Journal of Plant Physiology,2001,13(1):5-12.
[9]da Silva Fortunato F,de Almeida Oliveira M G,Brumano M H N,et al. Lipoxygenase-induced defense of soybean varieties to the attack of the velvetbean caterpillar (Anticarsia gemmatalis Hübner)[J]. Journal of Pest Science,2007,80:241-247.
[10]Melan M A,Dong X,Endara M E,et al. An Arabidopsis thaliana lipoxygenase gene can be induced by pathogens,abscisic acid,and methyl jasmonate[J]. Plant Physiology,1993,101(2):441-450.
[11]Pea-Cortes H,Sanchez-Serrano J,Rocha-Sosa M,et al. Systemic induction of proteinase-inhibitor-II gene expression in potato plants by wounding[J]. Planta,1988,174(1):84-89.
[12]Farmer E E,Ryan C A. Octadecanoid precursors of jasmonic acid activate the synthesis of wound-inducible proteinase inhibitors[J]. Plant Cell,1992,4(2):129-134.
[13]Koiwa H,Bressan R A,Hasegawa P M. Regulation of protease inhibitors and plant defense[J]. Trends in Plant Science,1997,2(10):379-384.
[14]Fortunato F S,Oliveira M G A,Brumano M H N,et al. Effect of the Anticarsia gemmatalis injury on the lipoxygenases activity from soybean leaves[J]. Bioscience Journal,2004,20(2):37-46.
[15]呂 敏,孙婳婳,高希武. 昆虫取食诱导棉花和玉米多酚氧化酶和过氧化物酶的活性研究[J]. 中国农学通报,2012,28(6):211-216.
[16]Rhoades D F. Responses of alder and willow to attack by tent caterpillars and webworms:evidence for pheromonal sensitivity of willows[M]//Hedin P A. Plant resistance to insects. Washington DC:American Chemical Society,1983:55-68.
[17]Bruin J,Dicke M,Sabelis M W. Plants are better protected against spider-mites after exposure to volatiles from infested conspecifics[J]. Experientia,1992,48:525-529.
[18]Dicke M. Evolution of induced indirect defence of plants[M]//Tollrian R,Harvell C D. The ecology and evolution of inducible defenses. Princeton,New Jersey,USA:Princeton University Press,1990:62-88.
[19]Oudejans A M C,Bruin J. Dose spider-mite damage induce information transfer between plants of different species ?[J]. Med Fac Landbouww Univ Gent,1995,59:733-739.
[20]Karban R,Baldwin I T,Baxter K J,et al. Communication between plants:induced resistance in wild tobacco plants following clipping of neighboring sagebrush[J]. Oecologia,2000,25:66-71.
[21]Liang R X,Li C J.Diferences in cluster-root formation and carboxylate exudation in Lupinusa albus L. and different nutrient deficiencies[J]. Plant Soil,2003,248:221-227.
[22]Axelrod B,Cheesbrough T M,Laakso S. Lipoxygenase from soybeans[J]. Methods in Enzymology,1981,71:441-451.
[23]Bradford M M A. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry,1976,25(1):248-256.
[24]Farmer E E. Surface-to-air signal[J]. Nature,2001,411(6839):854-856.
[25]Turlings T C J,Benrey B. Effects of plant metabolites on the behavior and development of parasitic wasps[J]. Ecoscience,1998,5:321-333.
[26]Felton G W,Summers C B,Mueller A J. Oxidative response in soybean foliage to herbivory by bean leaf beetle and three cornered alfalfa hopper[J]. Journal of Chemical Ecology,1994,20:639-650.
[27]Qin Q J,Shi X Y,Liang P,et al. Induction of phenylalanine ammonia-lyase and lipoxygenase by artificial damage and aphid infestation in cotton seedlings[J]. Progress in Natrual Science,2005,15(5):419-423.
[28]秦秋菊. 害蟲取食和机械损伤诱导的棉花防御反应[D]. 北京:中国农业大学,2005.
[29]Turlings T C J,Alborn H T,Loughrin J H,et al. Volicitin,an elicitor of maize volatiles in oral secretion of Spodoptera exigua:isolation and bioactivity[J]. Journal of Chemical Ecology,2000,26:189-202.
[30]Tscharntke T,Thiessen S,Dolch R,et al. Herbivory,induced resistance,and interplant signal transfer in Alnus glutinosa[J]. Biochemical Systematics and Ecology,2001,29:1025-1047.
[31]Lv M,Kong H L,Liu H A,et al. Induction of phenylalanine ammonia-lyase (PAL) in insect damaged and neighboring undamaged cotton and maize seedlings[J]. International Journal of Pest Management,2017,63(2):166-171.
[32]Arimura G,Ozawa R,Shimoda T,et al. Herbivory-induced volatiles elicit defence genes in lima bean leaves[J]. Nature,2000,406(6795):512-515.
[33]Arimura G,Ozawa R,Horiuchi J,et al. Plant-plant interactions mediated by volatiles emitted from plants infested by spider mites[J]. Biochemical Systematics and Ecology,2001,29(10):1049-1061.
[34]Arimura G,Tashiro K,Kuhara S,et al. Gene responses in bean leaves induced by herbivory and by herbivore-induced volatiles[J]. Biochemical and Biophysical Research Communications,2000,277(2):305-310.
[35]Alméras E,Stolz S,Vollenweider S,et al. Reactive electrophile species activate defense gene expression in Arabidopsis[J]. Plant Journal,2003,34(2):202-216.
[36]Weber H,Chételat A,Reymond P,et al. Selective and powerful stress gene expression in Arabidopsis in response to malondialdehyde[J]. Plant Journal,2004,37(6):877-888.
[37]Choh Y,Shimoda T,Ozawa R,et al. Exposure of lima bean leaves to volatiles from herbivore-induced conspecific plants results in emission of carnivore attractants:active or passive process?[J]. Journal of Chemical Ecology,2004,30(7):1305-1317.
[38]Leitner M,Boland W,Mithofer A. Direct and indirect defences induced by piercing-sucking and chewing herbivores in Medicago truncatula[J]. New Phytologist,2005,167(2):597-606.
[39]Turlings T C J,Tumlinson J H,Heath R R,et al. Isolation and identification of allelochemicals that attract the larval parasitoid Cotesi marginiventris (Gresson) to the microhabitat of one of its hosts[J]. Journal of Chemical Ecology,1991,17(11):2235-2251.

