基于胸阻抗检测的电流自动调节型除颤仪的研制
李伟明,谢佳玲,彭 莉,魏 良,鄢苏鹏,李永勤
(陆军军医大学生物医学工程与影像医学系,重庆400038)
0 引言
在全球范围内,心脏骤停(cardiac arrest,CA)严重危及人类的生命,平均每10万人中就有35~125例CA患者[1]。尽管最近几十年来的报道显示室颤患者的数量有所减少,但其仍然是引起CA的主要原因之一[2]。动物实验模型和临床治疗研究都已证明,电击除颤是终止室颤的唯一有效方法[3]。
电击除颤是指用较强的脉冲电流冲击心脏来消除室颤并使之恢复正常窦性心律的方法。临床研究证实决定除颤效率的主要因素是冲击心脏的电流大小而非能量高低[4]。现有的除颤仪采用基于脉冲宽度调整的阻抗补偿技术,即在保持输出电压不变的情况下通过改变电容放电的时间来实现除颤仪输出的能量恒定[5]。然而不同患者的胸阻抗(transthoracic impedance,TTI)存在相当大的差异[6]。现有除颤仪在保持输出电压和能量恒定的情况下,其输出的电流会因患者TTI的增大而减小,特别是对于高TTI患者(>90Ω)而言,会导致除颤仪输出的电流过小进而影响除颤效率[7-9]。
目前新型除颤仪的研究主要朝着小型化以及研究新型体外除颤波形除颤仪的方向发展。在除颤仪小型化研究方面,Huang等[10]从电路结构上着重研究除颤仪的充放电电路的小型化,设计了一种微型除颤仪充放电电路,电路结构紧凑,电路板大小为4.9 cm×4.9 cm。Okamura等[11]利用4个微型电容设计了一种能够释放双向量双相除颤波形的可穿戴小型除颤仪,与传统除颤仪所使用的2个除颤电极不同,该除颤仪使用了相互正交的4个除颤电极。在研究新型体外除颤波形的除颤仪方面,Varghese等[12]研制了一种除颤脉冲宽度约为300 ns的单相波除颤仪,通过实验发现该除颤仪所需的除颤能量大大降低,但是所需的除颤电压远高于传统毫秒级除颤脉冲宽度的除颤仪。Huang等[13]采用混合线性高压放大器电路设计了一种能够产生第一相上升的双相除颤波形的除颤仪,并进行了动物实验研究,结果发现采用相同能量进行电击除颤时,该除颤仪引起的心肌损伤明显小于现有的双相指数截断波除颤仪。总体而言,目前的研究并未解决除颤仪对于高TTI患者输出电流过小的问题。
本文拟研制一种基于TTI检测的电流自动调节型除颤仪,其主要优势是对于高TTI患者,能够在除颤时输出恒定的电流从而保证除颤效率。并通过模拟负载和动物实验分别对除颤仪的输出电流和除颤效率进行验证。
1 系统设计
1.1 基本原理
除颤仪采用电容充放电技术实现电击除颤。通过直流升压变压器将直流低压转换成直流高压,实现对高压储能电容的充电。在除颤时高压储能电容向人体瞬时释放能量形成除颤电流,电流大小由高压储能电容的电容值、高压储能电容的初始电压和患者的TTI共同决定。上述各参数的关系如公式(1)所示:

式中,I为除颤仪的输出电流;C为高压储能电容的电容值;U0为高压储能电容的初始电压;R为患者的TTI。由公式(1)可知,在电容放电的最初时刻,即t=0+时,除颤仪输出电流的峰值取决于高压储能电容的初始电压和患者的TTI。除颤所释放的能量E由公式(2)计算:

式中,U为除颤过程中电容的电压;T为除颤脉冲宽度,其可由公式(3)计算:

因此,为了调节除颤仪的输出电流和控制除颤仪释放的能量,必须实现对患者的TTI、高压储能电容的电压和除颤仪的输出电流等参数的精确测量。
1.2 系统组成
本研究研制的除颤仪系统框图如图1所示,主要由主控芯片、TTI检测电路、高压充电电路、高压监测电路、放电电路和放电电流监测电路组成。主控芯片为STM32F767,TTI检测电路检测的TTI信号、高压监测电路监测的电压信号和放电电流监测电路监测的电流信号等3路信号通过主控芯片的A/D通道转换成数字信号。主控芯片在内部程序中利用所读取的TTI信号来计算充电电压和除颤脉冲宽度,继而控制高压充电电路充电及高压监测电路监测电压。在充电完成之后,主控芯片控制放电电路放电和放电电流监测电路监测放电电流,同时利用所读取的电压和电流计算放电能量进而控制除颤仪的放电过程。

图1 除颤仪系统框图
1.3 硬件设计
1.3.1 TTI检测电路
TTI检测电路原理图如图2所示。本研究采用30 kHz的恒流源作为激励电路,其产生的正弦交变电流通过患者后会在除颤电极的两端形成包含TTI信号的正弦电压信号,该电压信号的幅值与患者的TTI值呈线性关系[14]。将除颤电极两端的信号经前置放大电路放大,采用高通滤波器滤除心电信号及其他干扰信号。然后通过解调电路得到基础阻抗信号和交流阻抗信号,再经过低通滤波器滤除交流阻抗信号得到基础阻抗信号[15]。最后由单片机读取基础阻抗电压信号,并将读取的结果与程序内的阻抗映射表的数值进行比较,得到患者的TTI值。
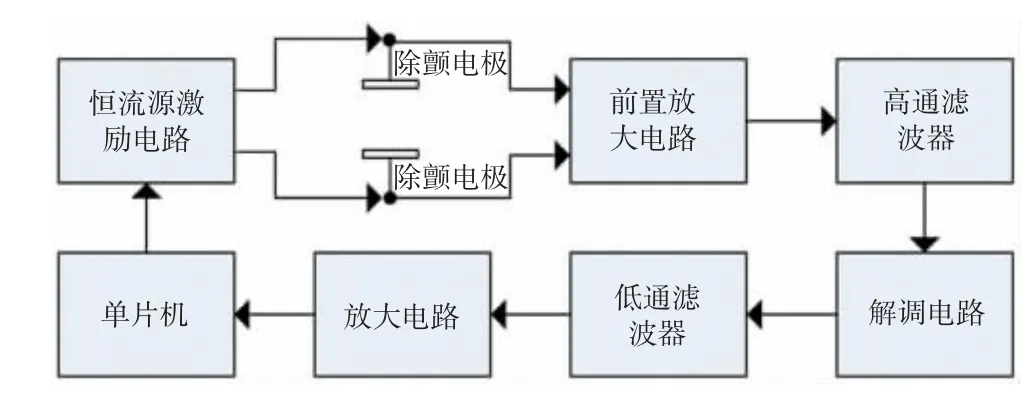
图2 TTI检测电路原理图
本研究采用30~200Ω的电阻模拟患者的TTI,电阻以10Ω递增。采用上述电路测量电阻得到一组数字量,并在单片机中建立一个映射表来校准电路测量的误差,从而实现对TTI的精确测量。
1.3.2 高压充电电路与高压监测电路
除颤所需要的电压远高于除颤仪所使用的电源电压,必须设计一种将高压储能电容充电至目标电压的反激式高压充电电路。该电路包括高压充电电路和高压监测电路2个部分,如图3所示,其中高压储能电容的电容值为210μF。
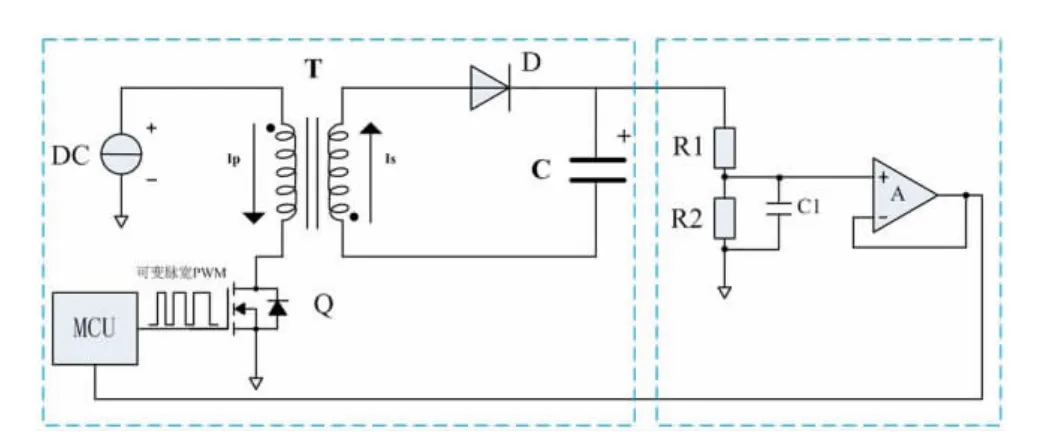
图3 高压充电电路与高压监测电路原理图
高压充电工作过程为:
(1)当开关管Q导通时,变压器T的初级线圈中有电流通过,此时次级线圈中有感应电动势,而二极管D是反向截止,因此次级线圈中没有电流,能量暂时存储在变压器T的次级线圈之中。
(2)当开关管Q关闭时,变压器T的初级线圈中的电流骤减为零,而变压器T的磁通量不能突变,因此次级线圈会感应出反向电动势,此时二极管D导通,存储在次级线圈中的能量通过导通的二极管D向高压储能电容充电。
单片机输出脉冲宽度调制(pulse width modulation,PWM)信号,控制功率开关管Q不断地导通和截止[16]。在刚开始充电时,由于高压储能电容的电压为零,电容两端相当于短路,不能通过太大的充电电流,因此单片机会输出占空比较小的PWM信号来控制变压器T充电,从而在变压器T的次级线圈中产生较小的充电电流。当高压储能电容充到一定电压时,单片机输出占空比较大的PWM信号来增大充电电流,从而实现对高压储能电容的快速充电。
在充电的同时,需要对高压储能电容的电压进行实时监测,并据此控制充电的整个过程。为了防止高压储能电容中的高电压损坏分压电阻,采用阻值与功率均比较大的R1和R2作为分压电阻。采样保持电路由电容C1与分压电阻组成,能够保持电压监测的稳定性和准确性。采样后的电压信号通过电压跟随器输出稳定的电压信号并接入单片机的A/D通道,单片机读取电压值,并与设定的目标电压进行比较,若达到设定的目标电压时则停止充电。
1.3.3 放电电路与放电电流监测电路
图4为放电电路与放电电流监测电路原理图,放电电流监测电路通过采样电阻R实时监测放电电流。因此,在除颤时监测放电电流和高压监测电路监测电容的电压能够实现实时计算除颤释放的能量,从而精确控制放电能量。
在除颤过程中,单片机通过放电控制程序对放电电路中的开关管进行控制。开关管Q1、Q2、Q3和Q4的控制时序如图4所示。当开关管Q1和Q4导通,并且开关管Q2和Q3截止时,电流从左侧电极流向右侧电极,产生持续一定时间的正相脉冲;当开关管Q1、Q2、Q3和Q4同时截止时,截止的持续时间为0.5 ms;当开关管Q1和Q4截止且Q2和Q3导通时,电流从右侧电极流向左侧电极,产生持续一定时间的负相脉冲,然后开关管Q1、Q2、Q3和Q4同时截止。在上述整个过程中,双相波采样电阻R对放电电流进行实时采样,采样频率为10 kHz,同时高压监测电路也以同样的采样频率对高压电容中的电压进行采样。在单片机中对所采样的放电电流和电容中的电压进行积分计算,可以得到除颤实时释放的能量。当释放的能量达到设定的能量时,单片机输出低电平信号,关闭开关管Q1、Q2、Q3和Q4。
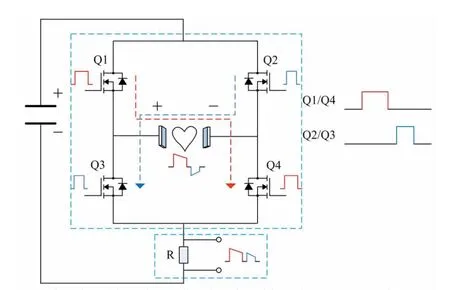
图4 放电电路与放电电流监测电路原理图
在除颤过程中开关管的导通内阻相对于患者的TTI可忽略不计,高压储能电容中的电压会根据患者的TTI和电容的时间常数呈现指数衰减。
1.4 软件设计
软件采用C语言进行设计,以KeilμVision5 IDE为开发平台。除颤控制流程如图5所示。首先在按下充电按键之后除颤仪会自动读取默认设定的能量,并控制TTI检测电路检测患者的TTI值,除颤仪利用检测的TTI值来计算充电电压和除颤脉冲宽度。其次控制高压充电电路对高压电容充电,充电完成后按下放电按键,除颤仪控制放电电路放电,同时控制高压监测电路和放电电流监测电路分别监测电容电压和放电电流,利用所监测的电压值和电流值实时计算除颤能量。最后,当除颤仪释放的能量达到默认设定的能量时放电完成。

图5 除颤控制流程图
2 样机性能测试与动物实验
2.1 主要实验器材
将研制的样机作为实验机,临床使用的PHILIPS HeartStart XL+除颤仪作为对照机,其他仪器包括RIGOL DM3068数字万用表、FLUKE Impulse 7000 DP除颤器/经皮起搏器分析仪、SpaceLab Model 90396多功能生理参数仪、上海奥尔科特生物技术有限公司ALC-V8动物呼吸器。
2.2 样机性能测试方案
在完成实验机的系统设计之后,需进一步验证其是否达到设计要求。因此对实验机的性能进行测试,包括TTI检测、高压监测、放电能量控制、放电电流监测、输出电流和除颤波形测试。
在30~200Ω的模拟负载上对实验机的TTI检测性能进行测试。使用数字万用表测量模拟负载的电阻值,再用实验机测量模拟负载的电阻值,采用Bland-Altman法评估2种仪器阻抗测量结果的一致性[17]。对于高压监测测试,采用Bland-Altman法对除颤器/经皮起搏器分析仪测量的电压值和实验机测量的电压值进行一致性评估。对于放电能量控制和放电电流监测测试,由于在除颤过程中除颤仪释放高电压大电流脉冲,因此采用除颤器/经皮起搏器分析仪内置的50Ω大功率电阻作为模拟负载[18-19]。该除颤器/经皮起搏器分析仪不仅可以计算实验机实际释放的能量,还可以测量释放的峰值电流。放电能量控制测试采用除颤器/经皮起搏器分析仪测量实验机释放的能量,并与实验机设定的目标能量进行对比分析。在放电过程中,实验机控制放电电流监测电路测量峰值电流,同时采用除颤器/经皮起搏器分析仪测量峰值电流,并记录其数值。采用Bland-Altman法对2种测量方法测量的电流进行一致性分析。对于实验机输出电流和除颤波形测试,在模拟负载上对实验机和对照机进行测试,获取了2种除颤仪在5 J能量水平输出的峰值电流和除颤波形。
2.3 动物实验
在完成实验机的系统设计和性能测试之后,通过动物实验验证实验机的除颤效率,并与对照机进行比较。
2.3.1 制作动物实验模型
本实验使用由陆军军医大学实验动物中心提供的新西兰兔制作室颤动物实验模型,因为早期的研究表明兔的心室动作电位与人相似,并且该模型适用于体外除颤实验[20]。实验兔雌雄不拘,体质量(2.1±0.2)kg,实验前一晚禁食,但可自由饮水。腹腔注射戊巴比妥钠(30 mg/kg),麻醉后将实验兔置于手术板上呈仰卧位,此后,每隔1 h腹腔注射8 mg/kg戊巴比妥钠以维持实验兔的麻醉状态。采用气管切开术插管并连接动物呼吸机进行机械通气,设定呼吸频率30~40次/min,潮气量10 mL/kg。经右股动脉插管测量动脉压并在整个实验过程中持续监测。实验过程中持续监测标准肢体Ⅱ导联心电图。从右颈外静脉将1根5-French起搏导管插入右心室以安置室颤诱导装置。通过插入右心室的起搏导管施加5~8 mA的50 Hz交流电流来诱发室颤,并且通过动脉压的骤然降低和脉搏的消失来确认诱发成功。致颤1 min后,等待30 s,通过心电图确定是可除颤节律,再进行除颤。
2.3.2 动物实验过程
对实验兔先并联电阻(10~200Ω),再串联电阻(10~150Ω),通过改变串并联电阻的值来调节除颤仪释放到实验兔身上的能量。兔的TTI范围相对窄,而调整串并联电阻值可以模拟低、中、高3个TTI段。每个TTI段进行10轮随机除颤,5轮使用实验机,另外5轮使用对照机。
为了比较2种除颤仪的除颤效率,采用5轮上下阈值法进行评估[21]。具体流程如下:实验机和对照机均设定为3 J的输出能量,除颤过程中释放到实验兔身上的能量通过调节串并联电阻值来控制。实验机和对照机的首轮除颤释放到实验兔身上的能量为1J,若除颤成功,则通过调节串并联电阻值使得第二轮除颤释放到实验兔身上的能量降低25%,反之则增加25%;若在前几轮除颤中有一轮除颤成功,则后续除颤释放到实验兔身上的能量为前几轮中除颤成功能量的最小值与除颤失败能量的最大值的均值;若前几轮的除颤均成功,则后续除颤释放到实验兔身上的能量降低到前一轮的25%,反之则增加25%,直至在5轮除颤中出现一轮失败或成功。判定除颤成功的标准为除颤后1 s内室颤终止。2个相邻的除颤实验之间间隔为5 min,以确保实验兔在电击除颤前有相同的生理状态。每只实验兔进行30轮除颤,24只实验兔总共进行720轮除颤。
2.4 统计学方法
采用SPSS 22.0软件进行数据处理,采用Kolmogorov-Smimov方法检验计量资料是否服从正态分布,若符合正态分布,以均数±标准差(x¯±s)表示,采用t检验;除颤成功率的比较采用χ2检验,P<0.05表示差异有统计学意义。
3 结果
最终研制的实验样机如图6所示。整机的尺寸为300 mm×210 mm×90 mm(长×宽×高),总质量为2000 g,待机时的功耗为1.5 W。

图6 实验样机实物图
3.1 样机性能测试结果
3.1.1 TTI检测测试
2种仪器阻抗测量结果的Bland-Altman分析如图7所示,阻抗测量的一致性界限为(-1.8Ω,1.3Ω),7.8%(7/90)的点位于95%一致性界限以外,阻抗差值的绝对值最大为1.9Ω;在95%一致性界限以内,阻抗差值的绝对值最大为1.1Ω,其测量结果阻抗平均值为149.5Ω;阻抗检测误差为3.0%,符合设计要求。从除颤仪的性能角度考虑这种测量结果是可以接受的,因此这2种仪器具有较好的一致性。

图7 2种仪器阻抗测量结果的Bland-Altman分析
3.1.2 高压监测测试
从图8中可以看出,电压测量的一致性界限为(-36 V,12 V)。2.9%(1/34)的点在95%一致性界限以外,电压差值的绝对值最大为52 V,其测量结果电压平均值为1942 V;在95%一致性界限以内,电压差值的绝对值最大为33 V,其测量结果电压平均值为1958 V;高压监测误差为2.7%,满足设计要求。从除颤仪的性能角度考虑,此差异能够接受,因此这2种仪器具有较好的一致性。

图8 2种仪器电压测量结果的Bland-Altman分析
3.1.3 放电能量控制和放电电流监测测试
表1为放电性能评估结果,放电能量控制的最大误差为4.8%。
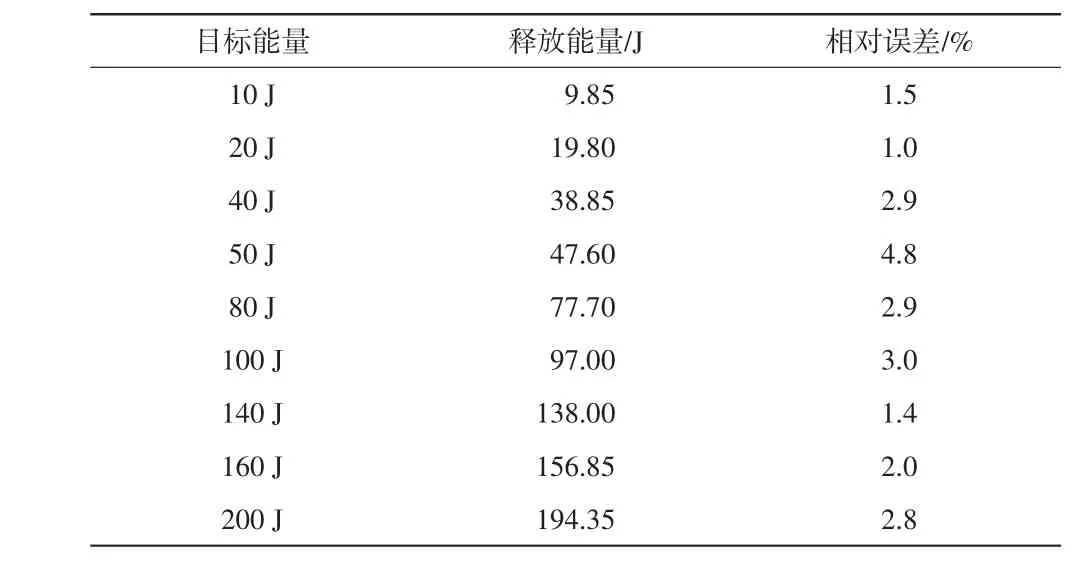
表1 放电性能评估结果
从图9中可以看出,电流测量的一致性界限为(0.0 A,1.5 A),6.7%(1/15)的点位于95%一致性界限以外,电流差值的绝对值最大为1.7 A,其测量结果电流平均值为39.2 A;在95%一致性界限以内,电流差值的绝对值最大为1.2 A,其测量结果电流平均值为39.4 A;放电电流监测误差为4.3%。因此这2种仪器具有较好的一致性。

图9 2种仪器电流测量结果的Bland-Altman分析
3.1.4 输出电流和除颤波形测试
图10为2种除颤仪在5 J能量水平下输出的峰值电流与阻抗的关系。可以看出,对照机输出的峰值电流随着阻抗的增加而减小。当阻抗<100Ω时,实验机输出的峰值电流比对照机的小;当阻抗≥100Ω时,实验机与对照机输出的峰值电流均服从正态分布,实验机输出的峰值电流显著高于对照机,分别为(2.9±0.1)和(2.3±0.4)A,P<0.01,差异有统计学意义。

图10 2种除颤仪在5 J能量水平下的峰值电流与阻抗的关系
图11为2种除颤仪的能量设定为5 J时在阻抗为40、100和160Ω时输出的除颤波形。图11(a)为对照机输出的除颤波形,其除颤波形的脉冲宽度随阻抗的增大而增大,最后脉冲宽度保持在20 ms左右不变。图11(b)为实验机输出的除颤波形,除颤波形的脉冲宽度随阻抗增大而先增大后减小,最后脉冲宽度保持在6 ms左右不变。实验机输出的峰值电压随着阻抗的增大而增大,而对照机输出的峰值电压随着阻抗的增大保持相对恒定。

图11 2种除颤仪在5 J能量水平下的除颤波形
3.2 动物实验结果
对数据资料进行正态性检验,结果表明,从实验兔检测的TTI服从正态分布。其TTI为(103.1±13.1)Ω,属于人体除颤的高TTI范围。图12为动物除颤实验过程中不同参数的除颤成功率。图12(a)为释放到实验兔身上各能量水平的除颤成功率,当能量<0.5 J时,实验机的除颤成功率(33.1%)高于对照机(19.5%);当能量>1.0 J时,实验机的除颤成功率(78.8%)高于对照机(65.3%)。P均<0.05,差异有统计学意义,详见表2。图12(b)为释放到实验兔身上各峰值电流的除颤成功率,当峰值电流≥0.9 A时,实验机的除颤成功率(69.5%)高于对照机(57.5%),其中当峰值电流在0.9~1.5 A时,实验机和对照机的除颤成功率分别为66.1%和54.9%;当峰值电流>1.5 A时,实验机和对照机的除颤成功率分别为80.4%和63.3%。P均<0.05,差异有统计学意义,详见表3。

图12 2种除颤仪在各能量水平和各峰值电流水平的除颤成功率

表2 2种除颤仪在各能量水平的除颤成功率比较

表3 2种除颤仪在各峰值电流段的除颤成功率比较
4 结语
本研究设计了一种基于TTI检测的电流自动调节型除颤仪,通过检测的阻抗值计算充电电压,进而调节除颤仪对于高阻抗负载的输出电流并使其输出恒定的电流。在放电过程中,通过监测电容电压和放电电流来实时计算除颤能量,能够精确控制能量的释放。动物实验验证了电流自动调节型除颤仪的除颤成功率高于现有的能量自动调节型除颤仪。对于高阻抗负载,本研究设计的除颤仪输出的电流显著高于现有除颤仪,弥补了现有除颤仪对TTI较高时输出电流不足的问题。本研究设计的除颤仪在高阻抗水平输出的除颤波形的脉冲宽度为6 ms,小于现有除颤仪(20 ms),而除颤脉冲宽度在6~16 ms时除颤效果最好[22]。
本研究研制的除颤仪仍存在以下不足:(1)高压监测电路测量的电压大于真实电压,进而导致除颤实际释放的能量总是小于设定的目标能量。(2)放电电流监测电路的测量误差随着电流的增大而增大。(3)除颤仪目前只是在小动物的电诱导室颤模型中验证了其除颤效率。后续将针对上述问题改进电路设计和优化程序,加强对除颤效率的进一步研究。

