HIF-1α及其相关通路在缺氧缺血性脑病中的研究进展
李健维,谢宗玉
新生儿脑损伤(neonatal brain injury,NBI)可由多种因素导致,例如缺氧缺血(hypoxic-ischemic,HI)、宫内感染以及围产期出血等[1]。缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由围产期新生儿脑部HI导致复杂的生理、细胞和分子变化的一类最常见NBI,在发达国家中发病率约为1.5%,而中低收入国家则高达1%~2%[2]。一旦新生儿发育大脑发生HI后,大量的未成熟神经细胞对缺氧高度敏感,大面积脑区的神经元会死亡,患儿急性死亡或者多种慢性终身疾病风险显著提高,例如视力障碍、学习障碍、癫痫、智力低下、失明或者脑瘫等并发症。因此,探讨HIE发病的分子机制,从分子机制角度探讨临床上安全有效的治疗方案是当前国内外治疗HIE的热点。
缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)是机体面临HI时的重要应激信号。1992年,SEMENZA[3]首次证明HIF-1是与低氧反应因子(hypoxia response element,HRE)结合的转录因子,增加了促红细胞生成素(erythropoietin,EPO)的表达。目前发现的受HIF-1调控的基因约70余种,例如EPO、血管内皮生长因子(vascular endothelial growth factor,VEGF)、诱导型一氧化氮合酶(inducible nitrogen oxide synthase,iNOS)、葡萄糖转运蛋白-1(glucose transporter 1,GLUT-1)、胰岛素样生长因子-2(insulin like growth factor-2,IGF-2)和转化生长因子-β(transforming growth factor-β,TGF-β)等,主要涉及红细胞生成、血管发生、能量代谢、细胞凋亡和增殖等多个HIE相关过程[4]。因此,HIF-1及其相关通路参与哺乳动物缺氧性特异应答的基因表达调控,使机体对HI产生适应反应,在HIE的发病和进展发挥重要作用。目前临床上治疗HIE的方法较多,在常规的对症支持治疗基础上会结合活性氧自由基清除剂、凋亡抑制类药物、iNOS抑制类药物、钙通道阻滞剂、神经生长因子、脑细胞代谢激活剂或者亚低温及高压氧等方案[5]。本文介绍HIF-1α及其相关信号通路在HIE中的分子机制,并对可能的临床治疗策略进行探讨。
1 HIF-1通路的分子基础和活性调控
HIF家族主要存在三种形式,包括HIF-1、HIF-2和HIF-3。该家族蛋白行使功能时需要2个亚基,包括具有活性功能的HIF-α亚型(包括HIF-1α、HIF-2α和HIF-3α)和组成表达的β亚基(HIF-1β)。HIF-1活性形式以HIF-1α和HIF-1β异二聚体蛋白复合物存在,属于bHLH-PAS类转录因子。HIF-1α相对分子质量为120 000,其表达随着细胞氧气浓度的降低而增加,在所有类型组织均有表达。HIF-1β相对分子质量为90 000,表达水平不受氧分子浓度调控,在常氧和缺氧条件下均在细胞核内稳定表达。目前认为HIF-1β的作用主要维持HIF-l异二聚体的稳定性以及活性构象转变等结构性功能。HIF-2α或称HRF/EPAS-1/HLF,是在克隆HIF-1α亚基的同源物时发现[6]。研究[7]表明,与HIF-1α的泛表达模式不同,HIF-2α主要局限在胶质母细胞瘤和血管母细胞瘤中表达,HIF-3α的研究则相对有限。
HIF-1α的活性调控主要包括三个层次,即mRNA水平、蛋白质水平以及高级结构(二聚化)水平[8]。蛋白质的水平调控主要通过HIF-1α蛋白的羟化、乙酰化、磷酸化等三种蛋白修饰方式完成[9]。在常氧条件下,脯氨酰羟化酶(prolyl hydroxylases,PHD)羟化HIF-1α的氧依赖性降解结构域的两个脯氨酸,肿瘤抑制蛋白pVHL识别并结合羟基化的脯氨酸残基,募集elongin C和elongin B等泛素蛋白形成泛素连接蛋白酶复合体,启动多泛素化降解途径。除HIF-1α外,氧气还通过天冬酰胺基羟化酶HIF-1抑制因子(factor inhibiting HIF-1,FIH)修饰HIF-1α的C端结构,抑制其转录活性[10-11]。缺氧条件下,因PHD 和FIH均失活,导致HIF-1α的泛素化降解抑制和转录抑制均被解除,HIF-1α稳定并在细胞内积累,由核定位信号介导入核并与HIF-1β结合成具有活性的完整HIF-1复合物,识别缺氧反应性DNA元件,并结合转录共因子p300诱导低氧靶基因的转录。部分研究利用2-氧戊二酸类似物、重金属和铁螯合剂等,抑制PHD和FIH活性,提高HIF-1α的稳定性(或假性低氧),从而模仿缺氧情况下的生物反应。
2 HIF-1参与HIE的靶基因
缺氧条件下,HIF-1α易位至核后形成HIF异二聚体,结合至靶基因上游的HRE中的核心共有序列5′-(A/G)CGTG-3′。此外,靶基因的启动子还具有HIF辅助序列(HIF ancillary sequence,HAS),序列为HRE的反向重复,即(5′-CAGGT-3′)。KIMURA等[12]通过定点诱变和荧光素酶报告系统发现,HAS序列缺失或者改变后VEGF和EPO报告基因的表达受阻。除缺氧外,还有许多非缺氧刺激能够上调该转录因子,包括生长因子、细胞因子、自由基和激素等。目前发现约有70多种HIF的直接靶基因参与正常生理和疾病过程。按功能主要包括血管生成和氧气供应、细胞干性和自我更新、细胞增殖、上皮向间质转化(epithelial-mesenchymal transition,EMT)、转移和侵袭、氧化还原稳态以及细胞凋亡(见表1)。本文重点探讨EPO、VEGF、COX-2、GLUT-1与糖酵解酶类等与HIE相关的靶基因。
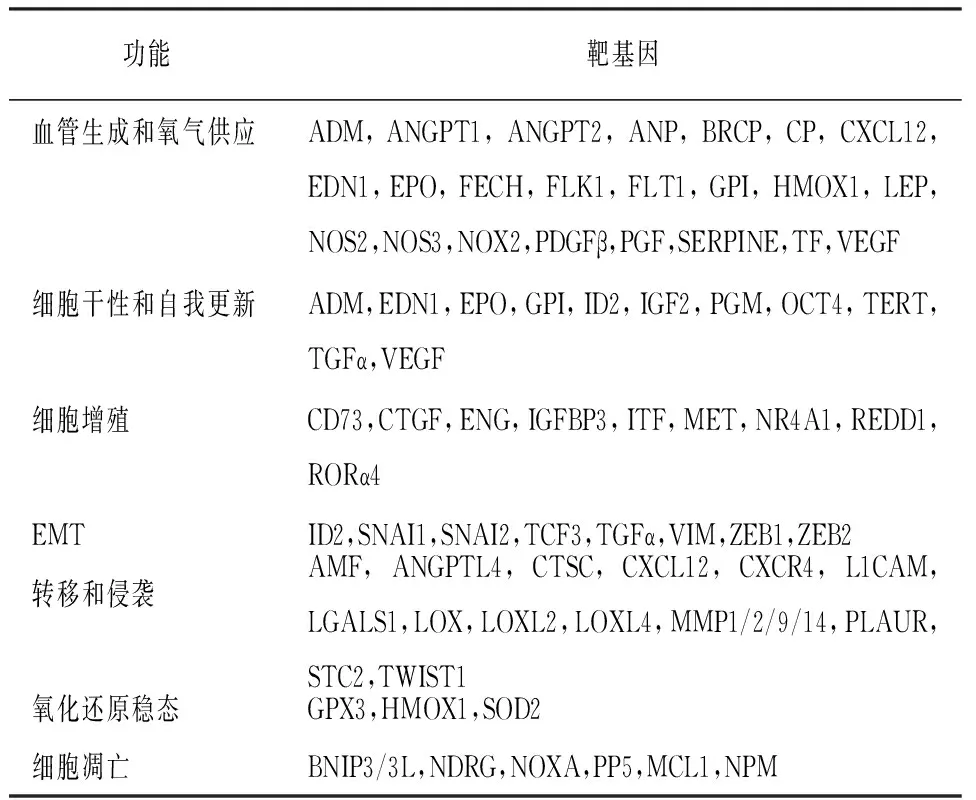
表1 HIF的靶基因及参与生物过程
2.1 EPO EPO是发现的首个HIF靶基因,为一种激活红细胞生成的激素类糖蛋白[13]。缺氧情况下EPO的表达水平提高是形成红细胞所必要条件,是在缺氧情况下机体提高输氧能力的一种反应[14-15]。EPO最初认为是参与红系祖细胞的成熟和增殖的关键基因,而后来的免疫组织化学研究表明,EPO广泛存在于哺乳动物的脑细胞中,而EPO受体也在包括星形胶质细胞、神经元、内皮细胞和小胶质细胞等大多数脑细胞中广泛表达[16]。KAWAKAMI等[17]发现,缺氧情况下HIF-1α能抑制谷氨酸等兴奋性氨基酸的释放,从而发挥脑保护的作用。KAWAKAMI等[17]以体外培养的小脑神经元颗粒作为谷氨酸释放源,加入EPO后谷氨酸释放受到抑制且神经元数目提高。KELLER等[18]在新生大鼠缺血缺氧模型中发现,EPO能抑制NMDA受体从而实现神经保护作用。EPO促进血红蛋白合成,是血液系统在缺氧时的重要代偿机制。但EPO的过量生成则会导致血小板黏附聚集增多,血容量和血液黏度提高,对HIE的恢复具有负面作用[15]。
2.2 VEGF 血管生成是一个复杂的过程,涉及由不同细胞类型表达的多种基因产物。脑缺血后,HIF-1α可以激活VEGF,VEGFR-1和PAI-1等血管生成相关基因,驱动生理和病理性血管生成,进而改善脑缺血状态[19]。MATSUDA等[20]在大鼠脑缺血模型的大脑表面转染HIF-1α DNA,结果发现HIF-1α和VEGF表达水平明显高于对照组,同时侧支循环数量显著增加,表明HIF-1α显著增加新生血管生成。缺氧程度对于VEGF的功能影响较大。当缺氧程度为轻度或者中度时,HIF-1结合在VEGF的增强子区域的HRE序列增强VEGF表达,增强低氧区域周围细胞的存活率[21-22]。当缺氧非常严重且持续较长时间时,过量的VEGF则直接导致血管重塑,血脑屏障的通透性增加,引发和加重HIE引起的脑水肿等[23]。
2.3 iNOS和环氧合酶2(cyclooxygenase-2,COX-2) iNOS和COX-2在HIE中通过通过炎症诱导导致脑损伤,均是HIF-1靶基因[24-25]。已证明COX-2的表达水平降低与新生儿脑损伤的减轻程度相关,而COX-2和iNOS的表达水平提高则伴随HIE后神经元的丢失[26]。COX-2抑制剂能改善新生儿脑损伤程度的减轻和神经行为等预后的,并且效能持续性较强,表明可能实现了对神经血管单位的有效保护。缺氧时,HIF-1参与内皮细胞中COX-2的上调,从而催化类花生酸的产生。在成年大脑中发生局灶性脑缺血后,HIF-1介导的iNOS明显上调。但是,关于iNOS参与新生儿HII后神经炎症的研究却存在明显争议。iNOS的主要细胞来源是星形胶质细胞和小胶质细胞,它们都在新生儿HIE后被激活。报道发现缺氧缺血后P12大鼠仅iNOS的少量表达。同时,发现在缺氧缺血后iNOS的表达没有改变,或者在缺氧后在P0和P7年龄小鼠中iNOS mRNA的显著下降[27]。
2.4 GLUT-1及糖酵解酶类 编码几乎所有糖酵解酶的基因都直接被HIF上调[28]。研究[29]表明,低氧预处理能显著增高新生大鼠的HIF-1α水平,同时GLUT-1以及多种糖酵解酶类的活性提高,从而保证脑组织能量充分以减轻脑损伤。PAPANDREOU等[30]发现,在缺血缺氧情况下,HIF-1α能提高丙酮酸脱氢酶激酶-1的表达水平,同时抑制丙酮酸脱氢酶活性,缓解脑损伤。
3 HIF-1α与HIE中的细胞凋亡
HIF控制许多凋亡基因,包括Bcl-2、BNIP3、NIX(或BNIP3L)和NOXA。其中,已证明BNIP3通过不依赖caspase的细胞死亡机制促进了发育中的皮质中的细胞损伤[31-32]。尽管众所周知,在新生儿大脑中,细胞凋亡的过程很大程度上依赖于caspase-3。针对两种类型的细胞凋亡是新生儿脑损伤的合理治疗选择。此外,对大鼠caspase 3/9启动子分析显示了HIF-1结合元件[33]。
3.1 HIF-1参与细胞凋亡 新生儿HI期间和之后,神经元细胞会发生凋亡。HIF-1α参与缺氧诱导的细胞凋亡主要为两种可能的途径。首先,HIF-1α增加了肿瘤抑制蛋白p53的稳定性,从而诱导细胞凋亡[34]。在皮质神经元中使用疱疹扩增子介导的基因转移,表达能够破坏缺氧依赖性转录的显性负性形式的HIF-1α,减少了因缺氧葡萄糖而导致的延迟性神经元死亡。相反,耐缺氧的p53无效的原代培养物不受HIF-1α表达的保护[35]。此外,另一项体外研究[36]表明,在缺氧状态下,HIF-1α消除了p53的降解,抑制了p53的泛素化并阻止了p53的核输出,从而导致了凋亡相关基因的表达增加。其次,HIF-1α的过表达还诱导BNIP3的表达增加,从而可以诱导新生大鼠脑细胞凋亡[31-32]。尽管HIF-1α可以增加p53和BNIP3的表达,但这些分子参与了两个独立的凋亡途径。PEREIRA等[37]使用HeLa细胞进行的体外研究结果表明,没有HIF-1α的p53的过表达不能诱导BNIP3的转录,但是其机制尚不清楚。
3.2 HIF-1的抗细胞凋亡活性 HIF-1α也可能因为高表达而对缺氧诱导的凋亡具有更高的抵抗力[38]。在轻度低氧的大鼠模型中,大鼠脑中HIF-1α有明显且持续的反应,而未检测到细胞凋亡。在急性缺氧体外模型中,与野生型细胞相比,具有HIF-1α蛋白组成型表达的细胞对凋亡的抵抗力更高。抗凋亡作用的详细机制尚不清楚。据推测,HIF-1α的持续表达通过在慢性低氧时增加EPO等抗凋亡因子的表达而具有抗凋亡作用,并在急性低氧时增加无氧代谢[33]。
由于HIF-1α参与促凋亡和抗凋亡过程,因此需要研究这两种矛盾效应之间的关系。新生儿脑细胞凋亡的诱导取决于缺氧的严重程度:在轻度缺氧条件下,p53水平较低,HIF-1α被HIF-1β磷酸化和二聚化,从而导致转录激活抗凋亡基因例如EPO的表达[34]。但是,更持续或更严重的缺氧条件会导致HIF-1α脱磷酸化并导致p53水平整体升高。这导致形成一种新的转录复合体,该复合体同时包含两种与病理基因(如Bax)的反式激活有关的蛋白质[39]。一项使用小鼠缺血模型的研究表明,脑缺血后HIF-1α激活有两个阶段[40]。第一阶段发生在缺血后持续到24 h,并且与大多数促凋亡基因的上调相关;而在第二阶段,HIF-1α激活从缺血后48 h至8 d,大部分是抗凋亡基因被诱导。
4 HIF-1α与坏死
细胞坏死是HIE后神经元最早期的死亡途径,在使用P7大鼠HI模型进行的研究中,坏死性神经元细胞的死亡主要集中在缺血核心,而凋亡性神经元的细胞主要分布在缺血性损伤较轻的区域[41]。神经元细胞是氧敏感细胞,这意味着细胞对缺氧有反应,细胞质游离钙的增加是由于细胞外钙的大量流入和内质网中钙的释放共同引起的。钙流入激活了与细胞坏死有关的几种蛋白质,例如钙蛋白酶[42]。体外研究[43]表明,钙蛋白酶的激活参与了调控HIF-1α的降解。这种降解是通过增加细胞内钙引起的,当PHD活性被阻断时,钙蛋白酶途径被激活。钙蛋白酶介导的HIF-1α降解可能与了解钙波动引起的长期和/或严重缺氧期间HIF-1α的低浓度有关。尽管钙内流激活钙蛋白酶介导的HIF-1α降解,有研究表明在I型颈动脉细胞中,缺氧期间细胞内钙浓度的增加刺激了HIF-1α蛋白的翻译[44]。也有学者[45]认为HIF-1α的稳定导致缺氧时细胞坏死。但是,这些作用可能仅限于肿瘤细胞,而在神经元中,HIF-1α的稳定可能导致存活[46]。尽管如此,HIF-1α与坏死之间的关系仍未完全阐明。
5 展望
HIF-1能通过调控多种靶基因表达而实现对于多个生命过程调控。HIF-1α在脑发育和缺氧缺血性脑损伤中起重要作用,并且该分子同时具有神经保护和神经毒性特性[22]。HIF-1α表达的调节涉及多种因素。尽管最近对新生脑损伤中对HI应答的分子机制的理解有了迅速的发展,但有关HIF-1α的许多问题仍有待回答。
在神经元细胞死亡或存活期间,HIF-1α表达的调节和HIF-1α的独特作用尚不完全清楚,尤其是条件决定细胞死亡或存活的问题。缺氧后HIF-1α是诱导促凋亡还是抗凋亡的决定可能取决于HI的持续时间,病理刺激的类型和涉及的脑细胞类型等[34]。
基于对HIF-1α信号通路的理解,我们可以探寻治疗HIE的新途径。首先,可以用PHD抑制剂调节HIF-1α的产生来促进神经保护性靶基因(如EPO和VEGF)的表达[47]。其次,也可以通过抑制HIF-1α的去磷酸化或用抗氧化剂下调其表达,例如p53和BNIP3诱导的细胞凋亡被阻断[48]。第三,可以通过预处理提高HIF-1α的稳定性,是预防HIE另一个重要方向。从治疗的角度看,应更加关注在新生儿HIE发生前未接受产前低氧预适应的窒息新生儿。HIF-1α的大多数特性仅通过实验测试,需要通过转化性研究进一步验证方案可行性[49]。

