3.0 T磁共振波谱成像联合扩散张量成像对小儿髓母细胞瘤的相关分析
朱凯,曾立红,张晓凡,徐守成,郝明珠,蔡静怡
髓母细胞瘤(medulloblastoma,MB)是小儿颅内较常见的恶性肿瘤,是小脑的胚胎性脑肿瘤,发病率为2.0%~5.8%约占儿童颅内肿瘤的18.5%,目前在MB诊断中,磁共振成像(magnetic resonance imaging,MRI)传统序列能提供肿瘤的大小、边界、内部信号特征等形态学方面的特点,其诊断价值有限[1]。氢质子波谱(1H-magnetic resonance spectroscopy,1H-MRS)和扩散张量成像(diffusion tensor imaging,DTI)评估生物标记物检测的一个重要因素是3.0 T MRI 在临床上的应用越来越广泛,新的成像技术1H-MRS 和DTI 都有各自特点,能够提供有关组织特性,结构和基本代谢过程的信息,术前诊断会影响尝试手术切除的程度范围,允许及时计划辅助治疗并与家人进行讨论。所以探查小儿MB 特点,越来越受到临床医生的重视,肿瘤组织细胞分子水平代谢物的生化信息及对周围组织纤维束受压、侵袭情况,从分子水平解释和定量分析肿瘤组织细胞[2]。笔者通过回顾性分析21 例MB1H-MRS 和DTI 数据,旨在探索1H-MRS 联合DTI 技术在MB 诊断中的价值,对帮助诊断和治疗提供影像学依据。
1 材料与方法
1.1 一般资料
回 顾2017 年 至2019 年10 月 检 查 的MB 患儿1H-MRS 和DTI 数据及信息完整的病例21 例,其中13 例男,8 例女,年龄范围2 个月至11 岁,平均年龄(32.28±22.24)个月,11 例发生在小脑蚓部,7 例发生在第四脑室内,3 例发生在右侧小脑半球;19 例患者磁共振检查时并发脑积水;年龄最小2 个月发病,术后脊髓转移,6个月时去世。同时行年龄匹配21名健康对照组1H-MRS和DTI检查,其中男13名,女8名,年龄范围2 个月至11 岁,平均年龄(32.23±22.21)个月。本研究经本单位医学伦理委员会批准(批准文号:2016-IEC-07),免除受试者知情同意。
1.2 纳入及排除标准
纳入标准:均经病理组织学确诊,临床影像资料保存完整,患者家属知情同意。排除标准:检查过程中不配合的患儿,数据基线不稳,病理结果收集不详的。
1.3 仪器设备
采用Ingenia 3.0 T磁共振仪(美国Philips)。
1.4 检查方法
常规的成像设备被用来显示已知特征描绘原发性肿瘤的边缘,1H-MRS 检查采用点分辨多体素谱(point resolved spectroscopy sequence,PRESS),重复时间(TR 2000 ms)和回波时间(TE 144 ms)各采集一次,层厚10 mm。根据肿瘤大小采用1.5 cm×1.5 cm×1.5 cm 或1.0 cm×1.0 cm×1.0 cm 的体素(VOI)。水抑制数据从较大的体素128次重复和较小的体素256次重复中获得。DTI检查采用单次激发回波平面成像(single-shot echo planar imaging,SS-EPI)序列,TR 5000 ms,TE 60 ms,16 个方向,层间距0 mm,层厚2 mm,60层,视野(FOV) 230 mm×230 mm。
图像分析及评价指标:将1H-MRS 在原始工作站中处理,基线校正代谢物识别和计算,分别获得N-乙酰天冬氨酸(N-acetylaspartic acid,NAA)、肌酸(creatine,Cr)、胆碱(choline,Cho)及Cho/Cr、NAA/Cr、Cho/NAA数值;在DTI处理界面勾画感兴趣区测得表观扩散系数(apparent diffusion coefficient,ADC)值及部分各向异性(fractional anisotropy,FA)值,分别计算MB患儿瘤体中心区、瘤周区、健康对照组各参数值。
1.5 统计学方法
采用SPSS 23.0软件对数据进行分析,计算指标采用(均数±标准差)表示,组间比较使用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 MB性别、肿瘤部位、月龄及肿瘤体积之间关系
21 例MB,男/女比例约13/8 (1.625/1),发生在小脑蚓部居多,占52.4% (11/21),第四脑室内占33.3% (7/21),右侧小脑半球占14.3% (3/21),如表1。MB 男患儿平均发病年龄小,平均(28.20±22.24)个月,MB 肿瘤体积小,平均(75.30±45.61) cm3,P<0.01,差异有统计学意义(表2;图1)。
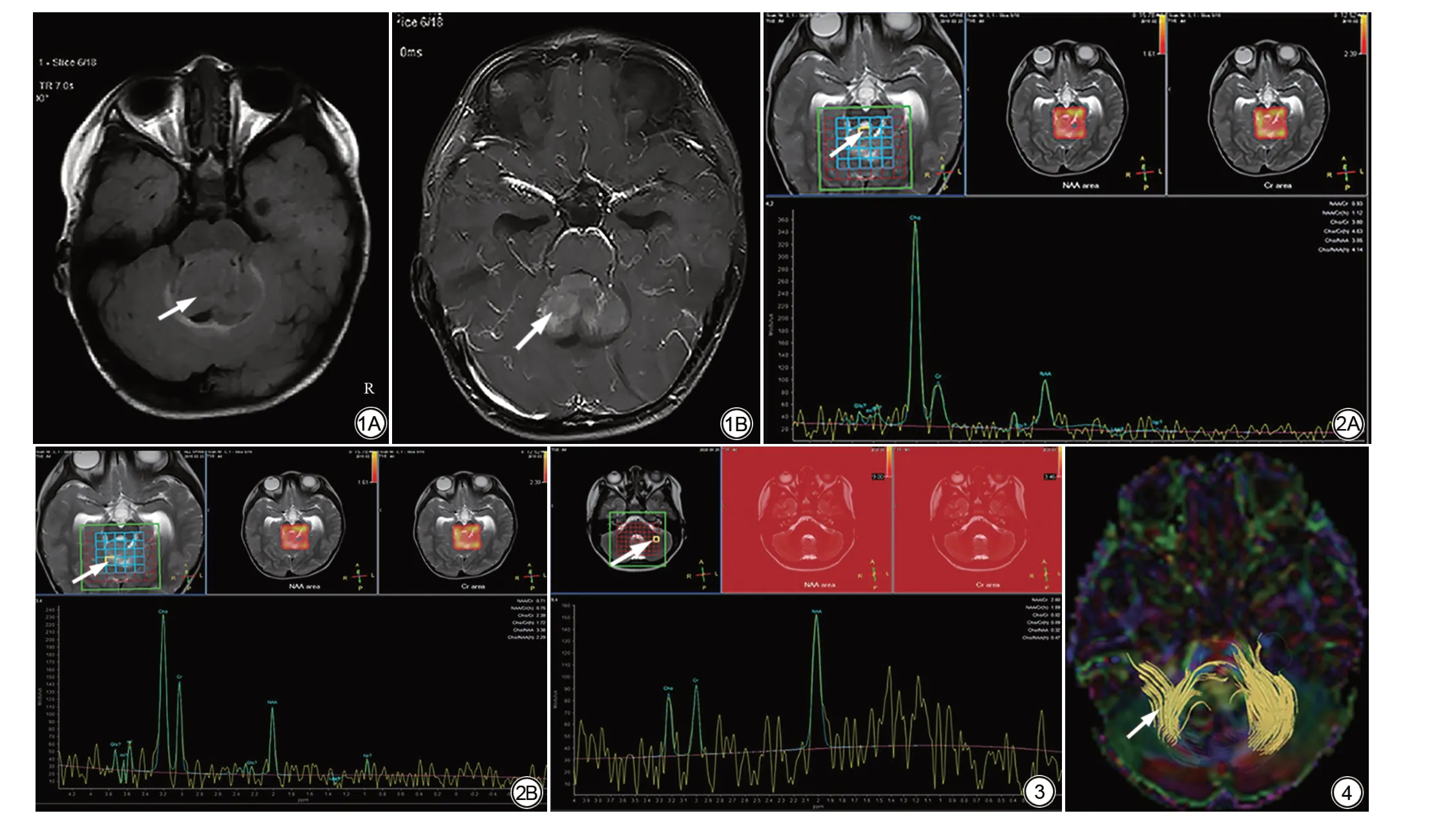
图1 男,28个月,第四脑室内髓母细胞瘤。A:FLAIR序列呈等高信号(箭),第四脑室显示不清、脑干受压;B:增强序列,肿瘤明显强化(箭),脑干受压 图2 髓母细胞瘤肿瘤中心及肿瘤周边1H-MRS 多体素波谱。A:肿瘤中心(箭)Cho 峰明显升高,NAA 峰明显下降;B:肿瘤周边(箭)Cho 峰明显升高,NAA 峰下降图3 健康对照组。1H-MRS多体素波谱中一个体素(箭):Cho,3.22 ppm;Cr,3.02 ppm;NAA,2 ppm;NAA峰最高,Cho、Cr峰相对低 图4 DTI序列中DTT,显示肿瘤区域纤维素部分中断、推移(箭)Fig. 1 28 months old male presented with medulloblastoma in the fourth ventricle. A: FLAIR sequence showed iso-signal and high signal (arrow), unclear fourth ventricle and brainstem compression.B:The tumor was obviously enhanced(arrow),and the brainstem was compressed.Fig.2 1H-MRS multivoxel spectrum of tumor center andperiphery.A:Tumor center(arrow)Chopeakincreased significantly,NAApeak decreased significantly.B:Tumorperiphery(arrow)Chopeak increased significantly,NAA peakdecreased.Fig.31H-MRSmultivoxelspectrum of healthy controlgroup,one voxel(arrow):Cho,3.22ppm;Cr,3.02 ppm;NAA,2 ppm;NAA peak is the highest,Cho,Cr peak is relatively low.Fig.4 DTT in DTI sequence,showing partial interruption and displacement of cellulose in tumor area(arrow).

表1 髓母细胞瘤在性别与肿瘤部位之间关系(例)Tab.1 Relationship between sex and tumor location of medulloblastoma(n)
表2 髓母细胞瘤在性别与月龄、肿瘤体积之间关系(±s)Tab.2 Relationship among sex,month age and tumor volume of medulloblastoma(±s)

表2 髓母细胞瘤在性别与月龄、肿瘤体积之间关系(±s)Tab.2 Relationship among sex,month age and tumor volume of medulloblastoma(±s)
性别男女月龄28.20±22.24 37.37±21.86体积(cm3)75.30±52.42 86.72±49.41 P值<0.01>0.05
2.2 MB 肿瘤中心、肿瘤边缘、健康对照组1H-MRS 代谢物半定量比值之间的关系
肿瘤中心NAA 最低,Cho 最高,肿瘤中心Cho/Cr、Cho/NAA (4.64±2.25、6.92±4.00)比健康对照组及肿瘤周边高,健康对照组NAA/Cr (1.10±0.44)最高,差异有统计学意义(表3;图2,3)。
表3 髓母细胞瘤氢质子波谱代谢物及半定量比值(±s)Tab.3 Metabolites and semiquantitative ratio of medulloblastoma(±s)

表3 髓母细胞瘤氢质子波谱代谢物及半定量比值(±s)Tab.3 Metabolites and semiquantitative ratio of medulloblastoma(±s)
注:与健康对照组比较,aP<0.01,bP<0.05
Cho/NAA 6.92±4.00a 1.81±0.33b 0.67±0.16组别肿瘤中心肿瘤边缘健康对照组NAA 4.78±2.56a 7.98±0.56b 8.87±3.05 Cho 24.78±5.55a 14.33±3.30b 5.79±2.19 Cr 6.02±1.67 9.20±0.38 8.07±1.26 Cho/Cr 4.64±2.25a 1.56±0.28 1.36±1.87 NAA/Cr 0.78±0.32 0.86±0.18 1.10±0.44
2.3 MB不同部位ADC和FA值比较
肿瘤中心、肿瘤边缘及健康对照组ADC值呈递增趋势,肿瘤中心最低[(0.73±0.11) ×10-3mm2/s],稍高的是肿瘤边缘,健康对照组最高[(1.06±0.41) ×10-3mm2/s],P<0.05,差异有统计学意义;肿瘤中心、肿瘤边缘及健康对照组FA 值呈递减趋势,肿瘤中心最高(0.47±0.22),稍低的是肿瘤边缘,健康对照组最低(0.23±0.09),P<0.05,差异有统计学意义(表4)。扩散张量纤维束成像(diffusion tensor tractography,DTT)肿瘤区纤维束扭曲、中断(图4)。
表4 髓母细胞瘤与健康对照组ADC和FA值比较(±s)Tab.4 Comparison of ADC and FA values between medulloblastoma and healthy controls(±s)

表4 髓母细胞瘤与健康对照组ADC和FA值比较(±s)Tab.4 Comparison of ADC and FA values between medulloblastoma and healthy controls(±s)
注:与健康对照组比较,aP<0.05;与肿瘤边缘比较,bP<0.05
组别肿瘤中心肿瘤边缘健康对照组ADC (×10-3 mm2/s)0.73±0.11ab 0.83±0.35a 1.06±0.41 FA 0.47±0.22ab 0.34±0.14a 0.23±0.09
3 讨论
3.1 MB特点
MB 是小儿颅内较常见的恶性肿瘤[3],多为男孩,文中男患儿比例高达61.9% (13/21),发病年龄比女患儿早,肿瘤体积相对略小。肿瘤发生于小脑蚓部居多,占52.4% (11/21),向下突入第四脑室内或后髓帆向周围扩展生长,肿瘤在小脑蚓部边界不清,第四脑室是受压改变,肿瘤常因压迫第四脑室而导致幕上脑室梗阻、扩张,本组中90% (19/21)患儿有脑积水。MB 细胞致密,无壁结节,出血和坏死少见,囊变多见,有学者研究MB 发现囊变可能与肿瘤存在分泌功能有关,可能与肿瘤生长速度快,而血液供应不足导致肿瘤组织缺血有关[4],肿瘤也可沿脑脊液播散,本组1例2个月男患儿,发病年龄最小,术后2个月脊髓播散,月龄6个月时去世。
3.2 波谱应用
1H-MRS可以无创定量分析代谢物,具有成本低且无辐射的优势,已逐步成为临床常用检查手段。1H-MRS 在颅内肿瘤中的应用,常规MRI 脑肿瘤诊断准确率约55%,在此基础上加以1H-MRS 分析后可提高到71%[5]。利用1H-MRS 进行MB 无创性生物标志物检测,可以提高疾病监测水平[6]。最小的年龄组(年龄<1 岁)存活率最低,女性的生存率明显高于男性[7]。本组中发病最早年龄为2个月男患儿,与之前的研究有一致性,本组中截至随访时已有15 例患儿去世,占71.4% (15/21)。当结合解剖学或其他类型的影像学检查时,1H-MRS提供了关于不能手术的脑肿瘤的独特的生物化学信息,一些研究发现,大量的预后MRS 生物标志物可能影响初始治疗方案的选择,并提示在无反应的情况下改变治疗方案。文献报道通过添加包括MR成像特征、年龄、性别和肿瘤大小的数据神经网络,提供影像学数据、光谱数据和有限的临床信息,可以预测儿童后颅窝肿瘤类型,具有显著的准确性[8]。波谱学上MB 最典型的特征是Cho 高,也是区别其他后颅窝肿瘤的标志性代谢物[4]。MB恶性增殖,细胞排列紧密,细胞间隙小,其恶性程度高,有学者研究颅后窝肿瘤中MB Cho水平的增高与细胞数量和细胞膜转换率有关,Cho 可以作为细胞增殖和肿瘤恶性程度的指标,肿瘤恶性程度越高越明显,生存率越低[5];1H-MRS上Cho常显著升高,Cr、NAA明显降低,肿瘤细胞快速增殖及分裂破坏了正常神经元和轴突,释放大量胆碱,使其浓度明显高于正常组织[9],Cho/NAA和Cho/Cr 比率明显增高,比星形细胞瘤和室管膜瘤更为突出[10]。本组中病例肿瘤中心Cho/Cr (4.64±2.25)和Cho/NAA (6.92±4.00),明显高于肿瘤边缘和健康对照组,提示肿瘤中心具有较高的侵袭性。一项多中心研究表明1H-MRS 为颅内肿瘤提供了一种“仿真活检”技术,Cho/Cr 和Cho/NAA 的明显增高对MB 有提示作用,有助于提高诊断的准确性。1H-MRS 在儿童小脑肿瘤代谢产物谱的判别分析是一种有前途的分类工具,MB 放疗后脑组织NAA/Cr 比值的升高可能是大脑代谢功能至少部分恢复的标志[11],MB 患者Cho峰增高最明显的区域提示肿瘤恶性程度高的区域,可以作为穿刺的选择部位,与需要活检组织的传统分子标记不同,非侵入性方法可用于定期安全监测患者,提供有关疾病进展的动态信息[12]。与单体素1H-MRS 相比,多体素MRS 能够进一步被用来评估肿瘤的不同区域及肿瘤周围或邻近的脑实质,而通过识别肿瘤部位来指导活检[9],多体素不仅可以观察病变内部的不均匀性,还可以观察在MR 图像上可能是正常的周围组织。本组中MB 肿瘤边缘Cho 值也是明显高于正常对照组的。尽管MB 组织学的四种亚型MRI 表现有所差别,但是有学者研究MB 亚型1H-MRS 显示各亚型的Cho/Cr、NAA/Cr、NAA/Cho 差异无统计学意义[13]。
3.3 扩散张量成像
扩散张量成像中ADC值与病变细胞增殖程度、胞内结构、间质成分及病理组织相关主要集中在对脑肿瘤的鉴别诊断价值、评估瘤周水肿区肿瘤细胞浸润程度、鉴别术后损伤抑或肿瘤复发等方面。有学者研究3.0 T DTI在鉴别儿童后颅窝肿瘤,计算病变区的ADC、FA 值,结果ADC 平均值与最大值呈显著相关,MB 的ADC 值低于细胞较少的毛细胞性星形细胞瘤[14]。测量肿瘤ADC 值用以鉴别儿童小脑肿瘤既简便又可靠,MB的ADC值最低[15]。本研究结果显示肿瘤中心ADC 值最低0.73×10-3,DTT 图像特征有着高度相关性,肿瘤所侵及区域纤维束中断、减少。MB 属高度恶性肿瘤,发展快,常早期沿脑室及蛛网膜下腔播散,MB 坏死少见且细胞密集缺乏胞质,细胞密度是影响ADC 值的主要因素,肿瘤恶性程度增加,细胞密度增大,水分子弥散受限显著,ADC 值较低,ADC 值的改变可能反映肿瘤的细胞组织学提示MB[9]。在MB 患者上,利用DTI可以显示小脑前纤维束在术后纤维信号强度减少[16],有学者分析了儿童MB 患者FA 和ADC,DTI 评估的白质纤维束结构完整性在放射治疗后脑干中并不均匀[17]。DTI 提供了一种量化儿童后颅窝肿瘤幸存者因肿瘤和治疗相关效应而产生白质损伤的方法[18]。MB 提示小脑-桥小脑传入束通路在儿童小脑肿瘤治疗后的共济失调和精细运动功能障碍中起一定作用[19]。有学者研究后颅窝综合征是儿童后颅窝肿瘤切除术后常见的并发症,它通常在术后1~2 d 内出现缄默症、共济失调、情绪不稳定和其他行为症状,术后DTI可以作为早期影像学指标[20]。
3.4 目前功能成像联合应用前景
在儿童脑肿瘤中已经有很多功能序列方面的研究,如DWI 主要用于后颅窝肿瘤,或单独使用MRS 及ASL,而联用两种或三种技术的研究很少见[21]。在本研究中,评估了治疗前1H-MRS 联合DTI 在儿童MB 队列中提供非侵入性预测性分子生物标记物的潜力,在肿瘤中心、肿瘤边缘及健康对照组进行半定量及定量分析,肿瘤中心区1H-MRS及DTI组织学改变都有一致性,证明了联合两种技术在检测儿童肿瘤时能够从各自的理论上支持MB肿瘤中心、肿瘤边缘的代谢物变化及扩散受限程度,加上3.0 T1H-MRS也与之前报道的1.5 T 多中心数据相比具有优势[22],并且具有自动处理和模式识别功能,3.0 T1H-MRS 和DTI 技术选择MB恶性程度高的位置为手术最佳位置,规范肿瘤手术范围,为准确无创地诊断MB提供了有用的技术,从而为临床实践、术式选取提供了强大的影像诊断工具。1H-MRS 联合DTI 便于从不同角度更为全面、透彻地了解肿瘤中心、边缘及周围组织情况,有望从形态学和功能学层面对不典型MB明确诊断。
展望:已有学者根据术前多参数磁共振成像特征预测MB的分子亚型[23],其中包括SHH亚组定位小脑偏侧,WNT亚组定位桥小脑角,第4组肿瘤位于中线下位伴第四脑室上隐窝扩张。放射基因组学或成像基因组学是一个新兴的研究领域,旨在确定非侵入性成像特征(放射表型)和基因组数据/分子标记(分子表型)之间的关系。最近的研究报道了令人鼓舞的数据,关于髓母细胞瘤的成像基因组学,其某些MRI 特征与特定的分子亚群相关。磁共振波谱上代谢物特征图谱可以可靠地区分SHH 亚组和非WNT/非SHH 髓母细胞瘤[24]。本研究的不足之处是未对分子亚型进行分析,所以功能磁共振的联合应用,对MB的组织学分型及分子亚型的评估将为临床医师提供更多重要的治疗和预后意义[25]。
作者利益冲突声明:全体作者均声明无利益冲突。

