拔罐对大鼠环跳穴区皮肤组织相关神经肽及化学物质表达变化的影响
刘惠 徐东升 陈虹 王莹莹 杨金生
摘要 目的:通过使用免疫组化和共聚焦技术研究拔罐对环跳穴区皮肤组织肥大细胞(Mast Cell)、神经肽Y(Neuropeptide Y,NPY)及5-羟色胺(5-Hydroxytryptamine,5-HT)的影响。方法:选取10只健康SD大鼠,剃除双后肢环跳穴区毛发,充分暴露穴区皮肤组织,在左侧环跳穴进行拔罐干预,拔罐后即刻灌流,并分别取正常大鼠和拔罐大鼠左侧穴区皮肤组织,长宽均为1 cm。使用25%高渗糖脱水后用恒冷箱切片机制成20 μm厚的组织切片,然后分别用Mast Cell、NPY、5-HT抗体进行荧光免疫组化检测。结果:与正常组比较,拔罐组大鼠环跳穴区皮肤组织表皮层明显增厚,且结构不清,真皮及皮下组织血管扩张挤压变形,Mast Cell、NPY、5-HT阳性表达明显增强。Mast Cell和5-HT在表皮和真皮内靠近血管和毛囊聚集,在皮下组织中大量散在分布围绕血管形成不连续的细胞带。NPY神经纤维在真皮及皮下组织的分布以串珠形式为主,在真皮下层绕血管毛囊汇聚明显。使用荧光显微镜分别在10倍镜下对5-HT和Mast Cell阳性細胞进行计数,在20倍显微镜下NPY阳性表达纤维的长度进行统计,结果表明拔罐观察组各项指标均高于正常组,2组比较,差异有统计学意义(P<0.05)。结论:拔罐能够使环跳穴区皮肤组织中Mast Cell、NPY、5-HT的表达上调,这些神经活性物质的释放可能激活相关信号传递通路而实现拔罐的效果。
关键词 拔罐;肥大细胞;神经肽Y;5-羟色胺;环跳;穴区效应;皮肤组织;实验研究
Effect of Baguan on the Expression of Neuropeptides and Chemical Substances
in Skin Tissue of “Huantiao”(GB30) Acupoint Area
LIU Hui1,XU Dongsheng2,CHEN Hong3,WANG Yingying2,YANG Jinsheng1
(1 Shaanxi University of Chinese Medicine,Xianyang 712046,China; 2 Institute of Acupuncture and Moxibustion,
China Academy of Chinese Medical Sciences,Beijing 100700,China; 3 The Second Affiliated Hospital
of Shaanxi University of Chinese Medicine,Xianyang 712046,China)
Abstract Objective:To investigate the influence of baguan on mast cell neuropeptide Y(NPY),5-Hydroxytryptamine(5-HT) in skin tissue at Huantiao(GB30)by using immunohistochemistry combined with confocal technique.Methods:A total of 10 rat was used in this experiment.Their skin tissue on hind limbs Huantiao(GB30) was exposed by shaving.Subsequently,baguan was carried out on the left side of Huantiao(GB30).After baguan,the local skin tissue of 1 cm×1 cm on bilateral Huantiao(GB30) of rats were collected,and tissue sections of 20 μ m thickness were prepared by dehydration with 25% hypertonic sugar and sectioning in constant cooling box The Mast Cell、NPY、5-HT antibodies were used for fluorescent immunohistochemical test.Results:Compared with the normal group,the epidermal layer of the skin significantly thickened,with unclear structure,dermis and subcutaneous tissues dilated and extruded,and the positive expressions of Mast Cell,NPY and 5-HT increased significantly.Mast Cell and 5-HT aggregated in close proximity to the blood vessels and hair follicles in intra-epidermis and dermis,and are widely dispersed in subcutaneous tissue layer forming a discrete band of cells surrounding the blood vessels.NPY is distributed in the dermis and subcutaneous tissues in the beads form,and aggregated in close proximity to the blood vessels in the subdermal layer significantly.The markers of 5-HT and Mast Cell positive cells were counted under 10 times microscope,and the length of NPY positive fibers was counted under 20 times of microscope.The results showed that the indexes of baguan group were significantly higher than that of the control group.The difference was statistically significant(P<0.05).Conclusion:Baguan plays a role in up-regulating the level of Mast Cell、NPY、5-HT in the local skin tissue at Huantiao(GB30).These neuroactive substances may convey signals to certain pathways that contribute to the effects of baguan.
Keywords Baguan; Mast Cell; Neuropeptide Y; 5-Hydroxytryptamine; Huantiao(GB30); Acupoint effect; Skin tissue; Experimental research
中图分类号:R245文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.05.016
拔罐疗法是在传统中医理论指导下,和其他中医外治法一样,以刺激经络循行上具有特定效用的穴位来治疗疾病的一种非药物治疗方法[1]。古人最早将拔罐疗法称为“角法”,马王堆帛书《五十二病方》中就已经有使用拔罐疗法治疗疾病的记载。近年来由于拔罐适应证广、疗效好、见效快,不仅在中国广泛运用,在国外也引起广泛关注[3]。现代医学目前对于拔罐疗法机制的研究开展甚少,而且主要机制研究集中于拔罐对于腧穴局部血流量、氧分压变化,及其对机体免疫功能影响等方面[4-5]。而对于拔罐过程中腧穴活性物质变化的研究更是不足。本研究以SD大鼠为研究对象,采用免疫组织化学结合激光共聚焦技术,观察正常大鼠皮肤组织和拔罐后皮肤组织中相关神经肽及化学物质表达的变化,为临床拔罐治疗疾病提供相应的形态学依据。
1 材料与方法
1.1 材料
1.1.1 动物 清洁级成年雄性健康SD大鼠10只,重量为(220±10)g,由中国中医科学院针灸研究所实验中心提供[实验动物许可证号为SCKX(军)2012-004]。整个实验过程严格遵守动物伦理学和美国国立卫生研究院的《实验动物照料和使用指南》,按分组分笼喂养,加食物和水,1次/2 d,同时更换垫料,由同一实验人员负责动物的日常管理。
1.1.2 试剂与仪器 本实验所用试剂及仪器见表1、表2。
1.2 方法
1.2.1 分组与模型制备 将10只健康SD大鼠按照随机数字表法分为观察组和正常组,每组5只。观察组选取大鼠左侧环跳穴进行拔罐干预,正常组除不进行拔罐干预外其他操作与观察组相同。
1.2.2 干预方法 穴位选择:定穴参考《实验针灸学》[6]中大鼠常用穴位定位方法,环跳穴位于左侧后肢髋关节后上缘,股骨大转子前方凹陷中。罐具选取:内径(25±2)mm的5号抽气罐。拔罐干预过程:使用小动物呼吸机对SD大鼠进行麻醉,剔除大鼠环跳穴区及周围毛发,充分暴露穴区皮肤组织,并将拔罐部位皮肤用生理盐水浸湿,后使用抽气式真空拔罐器对左侧环跳穴区进行拔罐干预,留罐时间5 min,其间若气罐出现松动,及时使用拔罐器补充吸力(约每30秒吸拔2次)。正常组不进行拔罐干预,其余操作和观察组相同。见图1。
1.2.3 试剂配制 1)0.2 mol/L磷酸缓冲液(Phosphate Buffer,PB)∶磷酸氢二钠(Na2HPO4·12H2O)、磷酸二氢钠(NaH2PO4·12H2O)、纯水。2)0.1~0.2 MPB、纯水。3)25%蔗糖溶液∶0.1 MPB、固体蔗糖。4)8%多聚甲醛∶固体多聚甲醛、纯水、氢氧化钠(NaOH)。5)4%多聚甲醛∶8%多聚甲醛、纯水。6)封闭液∶3%驴血清、0.5% Triton X-100、0.1 M PB。7)稀释液∶1%驴血清、0.5% TritonX-100、0.1 M PB。8)一抗稀释液∶羊抗5-HT抗体(1∶500);小鼠抗Mast Cell抗体(1∶1 000);兔抗NPY抗体(1∶500)分别和稀释液混合。9)二抗稀释液:Alexa 594荧光素化的驴抗兔二次抗体(1∶500)、Alexa 594荧光素化的驴抗小鼠二次抗体(1∶500)、Alexa 594荧光素化的驴抗羊二次抗体(1∶500)分别与Alexa 488荧光素化的鬼笔环肽(Pha)(1∶1 000)、核酸特异性荧光染料(DAPI)(1∶50 000)和稀释液混合。
1.2.4 灌流取材及固定 拔罐干预1次后,对大鼠进行称重,使用10%乌拉坦进行腹腔麻醉,在麻醉成功的基础上对大鼠进行灌流取材,大鼠仰面朝上置于试验台,做一皮肤的U形切口,快速剪开肋骨及胸腔,暴露心脏。剪开大鼠心尖部,将灌流针头经左心室插入升主动脉,用动脉夹固定心脏与针头的位置,之后剪开右心耳,灌入生理盐水至大鼠血液颜色变清亮。按照大鼠体质量灌入体质量±10 mL的固定液(4%多聚甲醛)灌流结束后在大鼠左后肢环跳穴区取1.0 cm×1.0 cm的皮肤组织。将组织放入固定液中后固定2 h,再换至含25%的蔗糖中,置于4 ℃冰箱沉糖脱水后备用。
1.2.5 组织切片制备 将大鼠皮肤组织进行修整,便于包埋痛同时准备阳离子载玻片并对其进行标记编号。将各组大鼠皮肤组织置于包埋槽中(期间注意大鼠皮肤方向),使用包埋剂对组织进行包埋。将包埋槽放置在恒冷箱切片机中使组织冻结,将包埋槽中的组织移至样本托上,对皮肤组织进行矢状切片(厚度为20 μm),将组织贴在载玻片上,然后放于4 ℃冰箱阴干。
1.2.6 检测指标与方法 组织切片使用0.1 mol/L PB清洗,待组织胶清洗干净后用组化笔在皮肤组织周围画圈。将封闭液用移液器滴加到组织切片上,室温孵育1 h,其间配置一抗稀释液,1 h后移去封闭液,分别滴加5-HT、Mast Cell、NPY抗体的一抗稀释液,并将装有组织切片的湿盒置于4 ℃冰箱中过夜。第2天使用0.1 M PB清洗3次,阴干后分别加入相应二抗稀释液,在室温环境下放置2 h后使用0.1M PB清洗3次,洗净二抗后阴干组织切片。在载玻片上滴加少量50%甘油,盖上盖玻片后皮肤标本制作完成(加入二抗后的操作过程注意避光)。
固定好的皮肤组织使用荧光显微镜进行观察和计数,使用共聚焦显微镜拍照。拍好的图片使用Adobe Photoshop CS2、Adobe Illustrator CS6软件进行标注和编辑。使用荧光显微镜在10倍视野下选取12个面积相同的区域进行2组皮肤标本的Mast Cell、5-HT进行计数;在20倍视野下对NPY阳性表达纤维的长度进行统计,完成统计后使用GraphPad Prism 6軟件制作条形图。
1.3 統计学方法 采用SPSS 19.0统计软件进行数据分析,计量资料使用均数±标准差(±s)表示,组间数据比较使用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
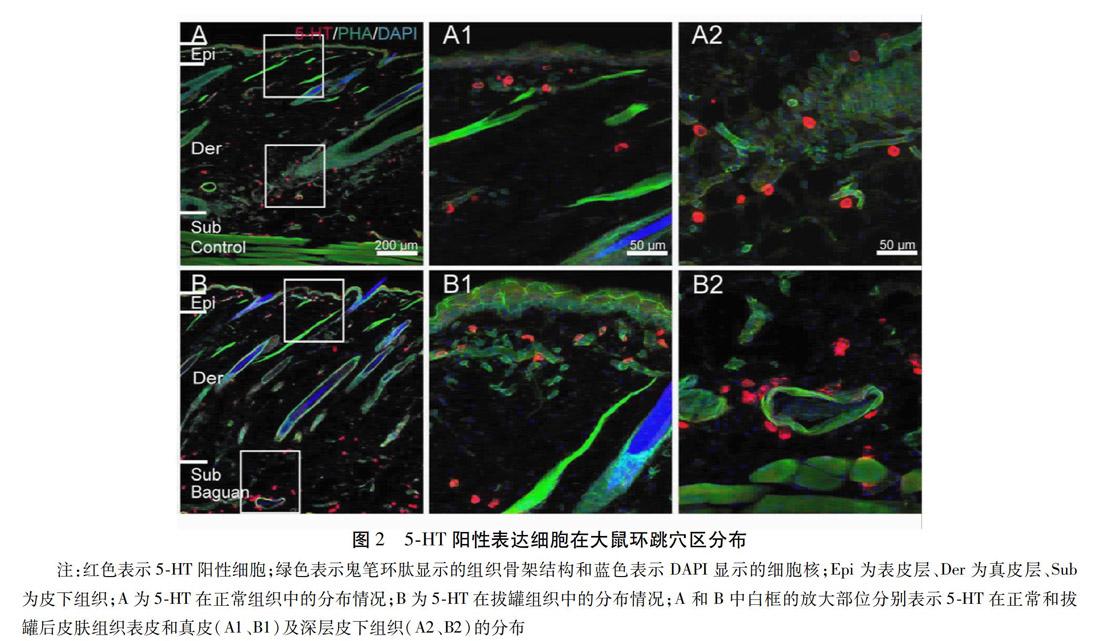
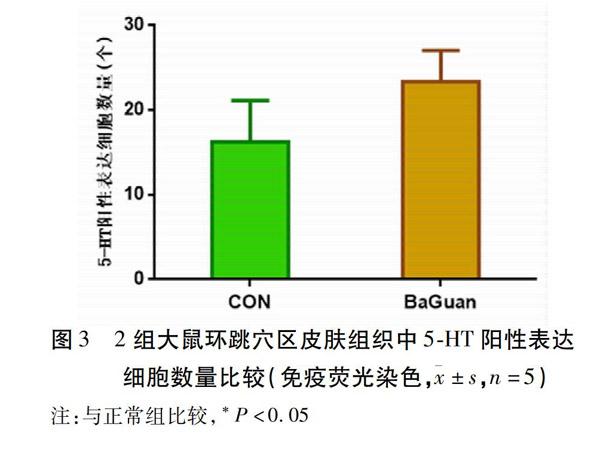
2.1 拔罐对SD大鼠环跳穴区皮肤组织5-HT表达的影响 环跳穴区局部皮肤组织的表皮层、真皮层、皮下组织均有5-HT阳性标记,拔罐干预后皮肤组织(图2B)与正常皮肤组织(图2A)比较,表皮层明显增厚,且结构不清,真皮及皮下组织血管扩张挤压变形,同时5-HT阳性表达增多,呈明显的血管毛囊趋向性。
2.2 拔罐对SD大鼠环跳穴区皮肤组织NPY表达的影响 NPY神经纤维在真皮及皮下组织的分布以串珠形式为主,在真皮浅层靠近表皮的部分则以散在游离分布为主,在真皮深层围绕血管和毛囊走行分布。与正常组织(图4A)比较,拔罐组织(图4B)NPY表达明显增强,在真皮下层血管汇聚明显。
2.3 拔罐对SD大鼠环跳穴区皮肤组织Mast Cell表达的影响 环跳穴区局部正常皮肤组织(图6A)中Mast Cell在表皮和真皮上层鲜少分布,在真皮下层绕血管毛囊散在分布,拔罐后(图6B)在表皮和真皮内靠近血管和毛囊聚集,在皮下组织中大量散在分布并伴有脱颗粒现象,围绕血管形成不连续的细胞带。
3 讨论
3.1 SD大鼠拔罐的参数确定 通过对国内外相关文献的归类分析,发现目前关于拔罐基础实验研究的文献较少,分析原因可能是由于对动物皮肤特点与人有一定差异性,对拔罐操作有所影响所致。查阅与拔罐实验研究相关文献后得出,目前用于拔罐的实验动物主要为小型猪、兔、大鼠等,本研究选取SD大鼠,在空气麻醉状态下对大鼠进行拔罐干预,探索拔罐后穴区化学物质的变化情况。在临床、教材以及拔罐技术操作规范国家标准中拔罐的留罐时间较多界定为10~15 min,但实际操作过程中考虑到大鼠皮肤具有弹性大并缺乏与皮下组织牢固结合的特点[7],预实验时选择适当力度能够使罐体吸附住的情况下,采用不同的留罐时间3、5、10 min进行比较,结果表明留罐3 min后与正常组比较差异无统计学意义;留罐10 min后皮下组织疏松水肿,皮下可见片状出血,不利于进一步的形态学观察。故本实验选择留罐5 min后比较2组之间的差异。
3.2 拔罐干预后Mast Cell、5-HT、NPY的变化 研究发现,拔罐后大鼠皮肤表皮层增厚,部分大鼠出现角质层脱落,观察时在表皮上方显示出强荧光带,而且穴区局部皮肤组织中的Mast Cell、5-HT、NPY表达发生明显的变化。HT作为神经递质和免疫调节因子,负责激活感觉神经末梢,针刺、艾灸、刮痧、拔罐等操作可能会引起代偿性(突触后)改变,可能导致细胞外5-HT功效增强[8-9],参与后续疼痛信息的传导。NPY在皮肤中均属于神经肽,是主要存在于皮肤组织中的感觉神经[10],具有维持皮肤正常感觉和对伤害性刺激感受[11-13]的功能,且这些穴区神经纤维和Mast Cell对体表刺激有反应,体表刺激可诱导SP、NPY和CGRP的痛觉神经肽在皮下神经纤维中高表达,进而激活Mast Cell。Mast Cell聚集并脱颗粒,又可释放胰蛋白酶、5-HT和HA,共同参与痛觉过敏、神经免疫相互作用和组织炎症反应等[14-16]。5-HT、Mast Cell和NPY的变化,与课题组观察刮痧刺激后产生的变化基本类似[17],提示刮痧、拔罐均为体表刺激,在临床应用时同一部位叠加使用的可行性与必要性。
本研究证实,拔罐对大鼠环跳穴区的物理性机械刺激,可导致局部皮肤组织出现一定程度的充血、水肿等,提示拔罐可能对局部皮肤组织产生良性刺激[18],同时对Mast Cell、5-HT和NPY表达变化产生显著影响,可改善局部微循环,并通过影响Mast Cell、5-HT和NPY等化学物质的表达产生持续弱刺激,形成级联反应,进而影响整体微循环,产生拔罐的通络效应,达到治疗疾病的效果[19]。拔罐后穴区这些化学成分的增加提示其可能参与了拔罐作用信息的传递过程,为我们进一步研究拔罐效应的神经生物学机制提供科学依据。
拔罐作为一种体表刺激,可以改变大鼠局部皮肤的组织形态,拔罐时使用适度的吸附力度和留罐时间,其产生的皮肤组织形态改变是一种可自我修复的短暂改变,具有安全性。本研究主要以穴区皮肤化学物质的形态学描述为主,而对其含量的分析研究相对不足。下一步研究将继续测定其形态学的分布趋势,同时对于拔罐穴区皮肤组织中的Mast Cell、NPY、5-HT含量的变化也将做进一步的检测和研究。
参考文献
[1]杨金生,王敬.拔罐疗法的治病机理探讨[J].中国中医基础医学杂志,1996,2(6):39-40.
[2]马榕,葛泉希,王超,孟向文.论拔罐禁忌及风险防范[J].辽宁中医药大学学报,2019,21(2):89-92.
[3]李丹丹,孟向文,刘华朋,等.拔罐疗法作用机理研究概述[J].辽宁中医杂志,2014,41(11):2506-2508.
[4]徐东升,佘琛,王佳,等.大鼠“太冲”穴区皮肤组织中血管和神经纤维的显微结构特征[J].针刺研究,2016,41(6):486-491.
[5]何伟,吴美玲,景向红,等.穴位的本态:穴位组织细胞化学的动态变化[J].中国针灸,2015,35(11):1181-1186.
[6]余曙光.实验针灸学[M].上海:上海科学技术出版社,2009:151.
[7]章金涛,葛蓓蕾,朱奎成,等.SD大鼠皮肤组织病理学观察[J].中国比较医学杂志,2008,18(3):81-82,86.
[8]Bertrand PP,Kunze WA,Furness JB,et al.The terminals of myenteric intrinsic primary afferent neurons of the guinea-pig ileum are excited by 5-hydroxytryptamine acting at 5-hydroxytryptamine-3 receptors[J].Neurosci,2000,101(2):459-469.
[9]Nonkes LJ,van Bussel IP,Verheij MM,et al.The interplay between brain 5-hydro-xytryptamine levels and cocaine addiction[J].Behav Pharmacol,2011,22(8):723-738.
[10]Wu ML,Xu DS,Bai WZ,et al.Local cutaneous nerve terminal and mast cell responses to manual acupuncture in acupoint LI4 area of the rats[J].Journal of Chemical Neuroanatomy,2015,68:14-21.
[11]吴胜,吴仲敏,傅磊冕.皮肤中的P物质及其作用[J].解剖学研究,2009,31(3):220-222.
[12]Kashiba H,Ueda Y.Acupuncture to the skin induces release of substance P and calcitonin generelated peptid from peripheral terminals of primary sensory neurons in the rat[J].Am J Chin Med,1991,19(3/4):189-197.
[13]Benarroch E E.CGRP:sensory neuropeptide with multiple neurologic implications[J].Neurology 2011,77(3):281-287.
[14]周丹,潘萍,郭義,等.针刺引起的炎性反应是针效产生始动环节之一[J].中国针灸,2009,29(1):32-34.
[15]Huang Meng,Zhang Di,Sa ZY et al.In adjuvant-induced arthritic rats,acupuncture analgesic effects are histamine dependent:potential reasons for acupoint preference in clinical practice[J].Evid Based Complement Alternat Med,2012,2012:810512.
[16]Tang YY,Cao GX,Chen Xi et al.A finite element framework for studying the mechanical response of macromolecules:application to the gating of the mechanosensitive channel MscL[J].Biophys J,2006,91:1248-1263.
[17]王莹莹,陈虹,张豪斌,等.刮痧对皮肤组织形态和GCS、SP、SOD、表达的影响[J].中华中医药杂志,2019,34(7):3204-3208.
[18]杨金生.中国拔罐健康法[M].北京:中医古籍出版社,1996:8.
[19]刘华朋,杨静,朱成慧,等.拔罐疗法对寒凝血瘀型家兔局部皮肤相关因子影响的实验研究[J].吉林中医药,2018,38(1):76-79.
(2020-04-14收稿 责任编辑:芮莉莉)
基金项目:国家自然科学基金项目(81674079);北京市自然科学基金项目(7172149)
作者简介:刘惠(1994.07—),女,硕士研究生,研究方向:中医外治法研究,E-mail:1837595345@qq.com
通信作者:杨金生(1964.02—),男,博士,主任医师,研究方向:针灸标准化及中医外治法研究,E-mail:zml@ibucm.com;王莹莹(1981.02—),女,博士,主任医师,研究方向:中医外治法及针刺戒烟方案研究,E-mail:yyw261206@126.com

