恩施产区湖北贝母乙酸乙酯组分挥发性成分与抗菌活性研究
李 宇,刘翠君,艾伦强,方昕悦,刘 玉,袁名远,冉亚兰,何美军,*
(1.湖北省农业科学院 中药材研究所,国家中药材产业技术体系恩施综合试验站,湖北 恩施 445000; 2.湖北民族大学 生物科学与技术学院,湖北 恩施 445000; 3.恩施土家族苗族自治州农业农村局,湖北 恩施 445000)
湖北贝母(FritillariahupehensisHsiao et K. C. Hsia),属百合科贝母属(FritillariaL.),主要分布于长江流域地区[1]。湖北贝母具有清热化痰、止咳、散结的功效,传统用于治疗热痰咳嗽、瘰疬痰核、痈肿疮毒[2]。药理实验表明,湖北贝母总生物碱具有舒张离体气管平滑肌、镇咳[3]、平喘[4]、降压[5]以及抗癌[6]等作用。贝母素乙(peiminine),别名浙贝乙素,是湖北贝母中被鉴定的主要活性生物碱成分之一[7],具有减轻急性肺损伤[8]、治疗骨关节炎[9]、抗癌[10]等重要生理活性。湖北贝母还富含萜类化合物如fritilleinide A、fritillebin C、fritillahupehin等,脂肪酸类化合物如棕榈酸、二十四烷酸和壬二酸等,其相关活性尚无文献报道[5]。
主产于湖北恩施地区的湖北贝母,是湖北省恩施州的重要道地药材[11]。因此,展开恩施产区的道地药材湖北贝母活性研究对于当地药材产业具有重要意义。本实验研究了湖北贝母提取物乙酸乙酯组分挥发性组分的组成、抑菌活性、贝母素乙含量,为湖北贝母的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
贝母样品从恩施周边地区采集,由湖北省农业科学院中药材研究所鉴定。
试验仪器包括:DFY-1000中草药磨粉机(温岭市林大机械有限公司),Aglient Technologies 7890A/5975C GC-MS联用仪(安捷伦科技有限公司),agilent 19091S-433毛细管柱(HP-5MS 5% Phenyl Methyl Silox,30 m×250 μm)(安捷伦科技有限公司),NanoDropTMOne超微量紫外分光光度计(赛默飞世尔科技(中国)有限公司),CR-80CO2培养箱(广州市康恒仪器有限公司)等。
标准品贝母素乙购于上海阿拉丁生化科技股份有限公司,其余试剂均为国产分析纯。所有供试菌都由中国科学院南海海洋研究所中国科学院热带海洋生物资源与生态重点实验室鉴定。
LB培养基配制:酵母提取物5 g·L-1,胰蛋白胨10 g·L-1,NaCl 10 g·L-1,pH 7.2~7.4,121 ℃灭菌30 min(固体LB培养基加入琼脂20 g·L-1)。
MH液体培养基配制:牛肉粉2 g·L-1,可溶性淀粉1.5 g·L-1,酸水解酪蛋白 17.5 g·L-1,pH 7.2~7.6,121 ℃灭菌30 min。
1.2 试验方法
1.2.1 贝母乙酸乙酯组分获得
10 g干燥贝母粉碎,按料液比1∶50(g·mL-1),乙醇溶液(体积分数60%)浸泡18 h,500 W超声辅助浸提30 min,10 000 r·min-1离心获得上清液,减压旋蒸,得到乙醇提取物浸膏。再用乙酸乙酯萃取(萃取3次,每次间隔2 h),减压浓缩,获得贝母乙酸乙酯组分。
1.2.2 贝母乙酸乙酯组分挥发性成分检测
气相色谱条件:Agilent 19091S-433毛细管柱(HP-5MS 5% Phenyl Methyl Silox,30 m×250 μm);100 ℃保持3 min,15 ℃·min-1升至280 ℃,保持5 min,然后2 ℃·min-1升至300 ℃保持10 min,总运行时间40 min;进样口温度为310 ℃;载气为高纯度氦气(99.999%);流速为1.8 mL·min-1;进样量为5 μL;不分流。
质谱条件:电子轰击(EI)离子源;离子源温度230 ℃;四级杆温度150 ℃;电子能量70 ev,接口温度250 ℃,质量扫描范围30~500 amu,检索谱库为NIST08.LIB标准谱库鉴定挥发性成分,采用面积归一化法对挥发油成分进行定量分析[12]。
样品处理:贝母乙酸乙酯组分用二氯甲烷充分溶解,13 000 r·min-1离心10 min,吸取上清液进样分析,以分析纯二氯甲烷进样作为对照组,每组样品进样3次,作为3个重复。
1.2.3 贝母乙酸乙酯组分活性成分GC定量
采用气相色谱外标法[13]检测湖北贝母中贝母素乙的含量,设定贝母素乙标准品质量浓度:1.13、2.25、4.50、6.75、9.00、11.25 mg·mL-1。运用FID检测器,设置检测器温度为310 ℃,运用1.2.2节的气相色谱条件测定仪器信噪比(S/N),当贝母素乙标准溶液稀释至信噪比3
1.2.4 贝母乙酸乙酯组分抗菌活性测试
采用滤纸片法[14]测试湖北贝母乙酸乙酯组分对11株供试菌的抑菌活性,取20 μL培养至D600为0.6的测试菌菌液与20 mL LB固体培养基混合均匀倒平板。取10 μL湖北贝母乙酸乙酯组分(二甲基亚砜DMSO溶解),分三次滴加于滤纸片(直径为4.45 mm)上,将滤纸片置于混有菌液的培养基上,另设氨苄青霉素(100 mg·mL-1)作阳性对照、添加DMSO作阴性对照,37 ℃培养12 h,测抑菌圈直径。参照抗生素药敏标准:高敏(抑菌圈直径>20 mm)、中敏(10~20 mm)、轻敏或耐药(<10 mm)。采用微量肉汤稀释法测定湖北贝母乙酸乙酯组分对供试菌的MIC值,按美国临床和实验室标准化协会(CLSI)M07-A10[15]的标准操作程序:在96孔板上3~12列的每孔加入含湖北贝母乙酸乙酯组分样品的MH液体培养基100 μL,设置湖北贝母乙酸乙酯组分终浓度分别为189.69、94.84、47.42、23.71、11.86、5.93、2.37、1.00、0.50、0.25 mg·mL-1(3~12列)。将培养好的菌液稀释1 000倍,每孔加入稀释菌液100 μL,设氨苄青霉素(100 μg·mL-1)作阳性对照组,第1列为空白培养基对照组,第2列为菌液生长空白对照组(加DMSO),第3~12列为样品测试实验组。37 ℃培养16 h后使用NanoDropTMOne超微量紫外分光光度计检测D600,根据CLSI M100—S25标准[16]:与阳性生长对照组比较,抑制80%细菌生长的药物浓度为受试菌的MIC值。
1.3 数据处理
所有实验数据运用SPSS 19.0 软件进行统计分析,实验数据以“平均值±标准偏差”表示。P<0.05,表明具有显著性差异,P<0.01,表明具有极显著性差异。
2 结果与分析
2.1 贝母乙酸乙酯组分挥发性成分鉴定及相对含量测定
通过GC-MS分析共从湖北贝母乙酸乙酯组分中鉴定出223个离子峰(图1),这些离子峰的质谱数据在NIST08.LIB标准谱库中检索,匹配度≥90.0%,鉴定为同一个化合物。通过质谱数据共从湖北贝母乙酸乙酯组分中鉴定出16个挥发性代谢产物(表1)。
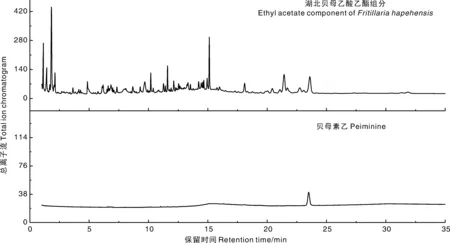
图1 总离子流色谱图Fig.1 Total ion chromatogram

表1 贝母乙酸乙酯组分挥发性成分及其含量测定结果
鉴定的湖北贝母乙酸乙酯组分挥发性物质主要包括脂肪烃、脂肪酸、含硫化合物和含氮的生物碱。如表1所示,脂肪烃类化合物有(1)、(2)、(4)、(5)、(10)、(14)共6个。脂肪酸类化合物有(3)、(7)、(8)、(9)、(12)、(13)共6个,其中(3)、(12)、(13)为不饱和脂肪酸,饱和脂肪酸类化合物的重要生理功能具有供应能量、增加胆固醇的浓度,但同时也能调节低密度脂蛋白(low-density lipoprotein)的代谢的作用,不饱和脂肪酸类化合物具有降低心脑血管疾病发生和调节胆固醇与血脂、降低血压作用、抗肿瘤和保护视力的作用[17]。化合物(15)、化合物(16)是生物碱类化合物,化合物(15)是首次在湖北贝母中鉴定的含氮生物碱,化合物(16)是贝母素乙。
采用GC-MS峰面积归一法定量分析,计算出各成分的相对含量(表1)。从乙酸乙酯组分中共检测出223个色谱峰,通过NIST08.LIB标准谱库鉴定16 种化合物(匹配度≥90.0%),占总相对含量的51.64%,主要成分为脂肪烃(4.55%)、脂肪酸(24.07%),以及含氮的生物碱(23.02%)。
2.2 贝母乙酸乙酯组分贝母素乙含量测定
通过GC 外标法测量贝母素乙标准品的检出限、定量限分别为15.77、52.57 μg·mL-1(6次重复实验),说明检测器灵敏度极高,适合用于检测。
贝母素乙在检测浓度1.13~11.25 mg·mL-1范围内,线性相关性好(R2≥0.999 0),标准曲线方程为y=13.33×A+4.89。配制本底浓度为1.00 mg·mL-1的贝母素乙标准品溶液,再向贝母素乙标准品溶液中准确添加贝母素乙标准品,使标准溶液浓度增加为0.80 mg·mL-1(已知加标量),得到贝母素乙标准品溶液的计算浓度为1.80 mg·mL-1。运用GC检测添加贝母素乙标准品后的溶液浓度为1.76 mg·mL-1。获得标准品的加标回收率为95%,相对标准偏差(RSD)为3.68%,证明通过GC检测贝母素乙的方法准确、重现性好且灵敏度较高。
利用GC外标法检测湖北贝母乙酸乙酯组分的贝母素乙含量为(16.19±0.16) mg·g-1,加标回收率为96.58%,相对标准偏差为3.98%(表2),证明通过GC检测贝母素乙的方法准确、简便且灵敏度较高。

表2 湖北贝母乙酸乙酯组分贝母素乙含量表(means±SD,n=6)
2.3 贝母乙酸乙酯组分抗菌活性研究
滤纸片活性粗筛结果显示,湖北贝母乙酸乙酯组分(25.00 mg·mL-1)对11株供试菌具有抗菌效果:贝母乙酸乙酯组分对苏云金芽孢杆菌(Bacillusthuringiensis)、溶藻弧菌(VibrioalginolyticusXSBZ14)、鲍曼不动杆菌(AcinetobacterbaumanniiATCC 19606)有中度敏感抑制作用,其抑菌圈直径大小分别为(13.32±1.08)、(12.18±0.88)、(12.15±0.47) mm。通过微量肉汤稀释法测定湖北贝母乙酸乙酯组分对苏云金芽孢杆菌、溶藻弧菌、鲍曼不动杆菌3株供试菌的MIC值,分别为2.37、5.93、11.86 mg·mL-1(表3)。
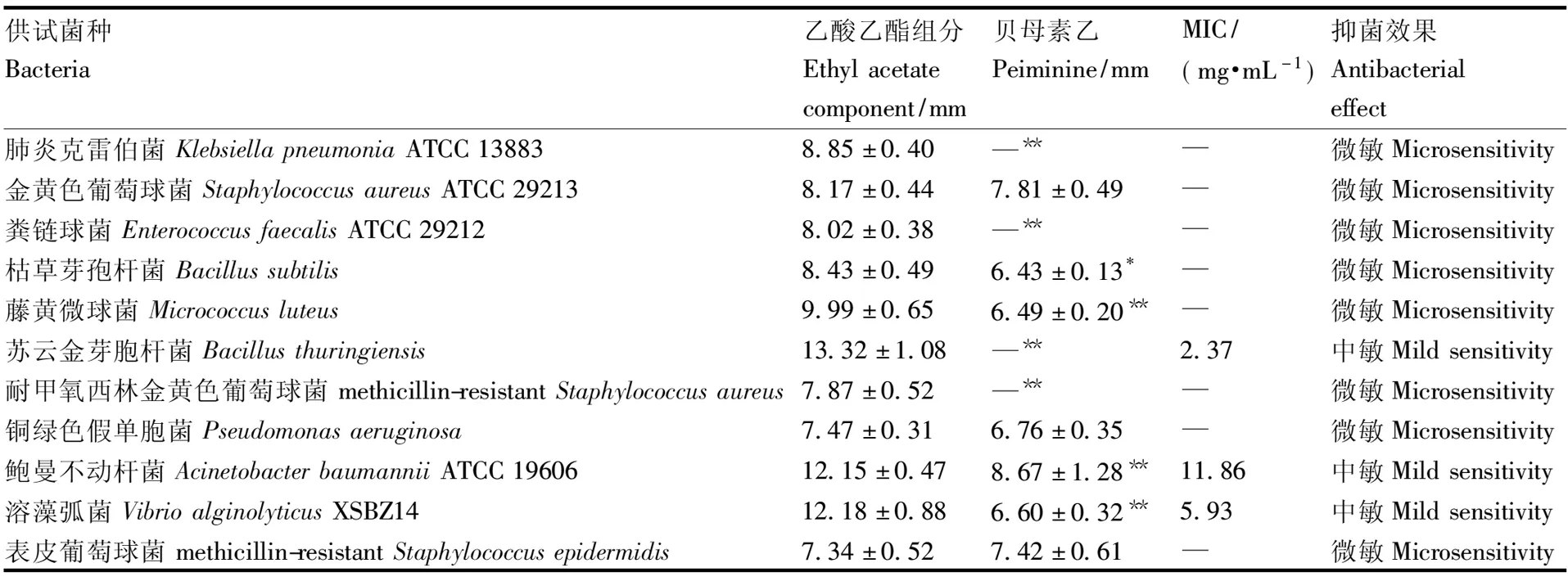
表3 湖北贝母乙酸乙酯组分的抗菌活性(means±SD,n=3)
贝母素乙在湖北贝母乙酸乙酯组分中的含量为(16.19±0.16) mg·g-1,以等量浓度的贝母素乙(0.41 mg·mL-1,25.00 mg·mL-1×1.62%)为对照组测试抑菌圈,首次发现贝母素乙对金黄色葡萄球菌(StaphylococcusaureusATCC 29213)、鲍曼不动杆菌(AcinetobacterbaumanniiATCC 19606)、表皮葡萄球菌(methicillin-resistantStaphylococcusepidermidis)有微弱的抑菌活性。其抑菌活性与湖北贝母乙酸乙酯组分的抑菌活性存在显著性差异,证明贝母素乙不是湖北贝母乙酸乙酯组分中主要发挥抑菌活性的成分。
3 讨论与结论
目前用于检测湖北贝母中贝母素乙等生物碱含量的主要方法是高效液相色谱-蒸发光散射检测法(HPLC-ELSD)[18-19]。ELSD检测的基本原理:被检测样品随流动相进入雾化器中,与载气混合形成均匀一致的雾滴;雾滴在通过蒸发器时,流动相被蒸发,被检测样品形成极细的雾状颗粒;雾状颗粒高速通过检测器的光路,并形成信号输出[20]。该方法主要受样品组分和流动相的挥发性影响,只有非挥发性化合物,流动相为易挥发的溶剂才能检测。该缺陷限制了挥发性样品检测,易挥发的溶剂的使用造成周围空气污染,其次样品和溶剂的挥发性极大影响基线噪音、检测灵敏度、检测线性范围[21]。
氢火焰离子化检测器(FID)的基本原理:有机样品随载气由喷嘴喷出并碰到氢火焰,在C层发生裂解反应并产生自由基;自由基反应导致火焰中大量水分子碰撞而发生分子离子化;离子化分子在检测器中向两极定向运动而产生微电流,并形成信号输出。因此,氢火焰离子化检测器是典型的质量型检测器,对有机化合物的检测具有极高的灵敏度[22]。
本研究首次开发了利用气相色谱配氢火焰检测器检测贝母素乙的方法,该方法准确、重现性好、灵敏度高,其检出限、定量限分别为15.77、52.57 μg·mL-1,在1.13~11.25 mg·mL-1的检测浓度范围内线性相关性良好。目前有文献报道湖北贝母乙醇提取物对乙型溶血性链球菌、枯草芽孢杆菌和金黄色葡萄球菌有抑菌活性[20]。通过对湖北贝母乙醇提取物成分进一步萃取分离,获得乙酸乙酯组分,本研究首次发现湖北贝母乙醇提取物中乙酸乙酯组分对苏云金芽孢杆菌、溶藻弧菌以及鲍曼不动杆菌有中度敏感抑制作用;并首次通过GC-MS检测从湖北贝母乙酸乙酯组分中共鉴定出16个挥发性物质,其中贝母素乙的含量为1.61%。
参考文献(References):
[1] 吴继洲,濮全龙. 湖北贝母化学成分的研究 Ⅲ.湖贝甲素甙的分离和鉴定[J]. 药学学报,1985,20(5): 372-376.
WU J Z,PU Q L. Studies on chemical constituents of Hubeibeimu(Fritillariahupehensis Hsiao et K. C. Hsia) ⅲ: isolation and identification of hupehenioside[J].ActaPharmaceuticaSinica,1985,20(5): 372-376.(in Chinese with English abstract)
[2] 国家药典委员会. 中华人民共和国药典:一部[S]. 北京: 中国医药科技出版社,2020:363.
[3] 姚丽娜,孙汉清,江湛,等. 湖北贝母、鄂北贝母、紫花鄂北贝母生物总碱对呼吸系统的药理作用[J]. 同济医科大学学报,1993,22(1): 47-49.
YAO L N,SUN H Q,JIANG Z,et al. The effects ofF.ebeiensis,F.ebeiensisvar. Purpura andF.hupehensishsinoes K.C. Hsia on respiratory function[J].JournalofTongjiMedicalUniversity,1993,22(1): 47-49.(in Chinese with English abstract)
[4] 徐仿周,张鹏,张勇慧,等. 湖北贝母总生物碱平喘作用及其机理的研究[J]. 时珍国医国药,2009,20(6): 1335-1337.
XU F Z,ZHANG P,ZHANG Y H,et al. Studies on the antiasthmatic effect and mechanisms of the total alkaloids fromFritillariahupehensisin Guinea pigs[J].LishizhenMedicineandMateriaMedicaResearch,2009,20(6): 1335-1337.(in Chinese with English abstract)
[5] 徐定平,吴晶晶,周鑫堂,等. 湖北贝母化学成分和药理作用研究进展[J]. 中国药业,2015,24(6): 92-94.
XU D P,WU J J,ZHOU X T,et al. Research advance in chemical constituents and pharmacological effects ofFritillariahupehensisHsiao[J].ChinaPharmaceuticals,2015,24(6): 92-94.(in Chinese with English abstract)
[6] ZHANG Y H,YANG X L,ZHANG P,et al. Cytotoxic alkaloids from the bulbs ofFritillariahupehensis[J].Chemistry&Biodiversity,2008,5(2): 259-266.
[7] 吴继洲,王永耀,凌大奎. 湖北贝母化学成分的研究Ⅴ.湖贝新的分离和鉴定[J]. 药学学报,1986,21(7): 546-550.
WU J Z,WANG Y Y,LING D K. Studies on chemical constituent of Hubeibeimu (FritillariahupehensisHsiao et k. c. Hsia) Ⅴ. isolation and identification of hupehenisine[J].ActaPharmaceuticaSinica,1986,21(7): 546-550.(in Chinese with English abstract)
[8] DU B X,CAO L,WANG K,et al. Peiminine attenuates acute lung injury induced by LPS through inhibiting lipid rafts formation[J].Inflammation,2020,43(3): 1110-1119.
[9] LUO Z C,ZHENG B B,JIANG B J,et al. Peiminine inhibits the IL-1β induced inflammatory response in mouse articular chondrocytes and ameliorates murine osteoarthritis[J].Food&Function,2019,10(4): 2198-2208.
[10] CHAO X,WANG G Q,TANG Y P,et al. The effects and mechanism of peiminine-induced apoptosis in human hepatocellular carcinoma HepG2 cells[J].bioRxiv,2018,DOI:10.1101/377069.
[11] 朱利霞,汪旭,张汉扬,等. 湖北贝母药材的质量标准研究[J]. 中华中医药学刊,2017,35(4): 838-842.
ZHU L X,WANG X,ZHANG H Y,et al. Study on quality standards ofFritillariaehupehensisbulbus[J].ChineseArchivesofTraditionalChineseMedicine,2017,35(4): 838-842.(in Chinese with English abstract)
[12] 韦静,李芳耀,杨新平,等. 容县八角叶中挥发油成分气质联用分析[J]. 中国实验方剂学杂志,2011,17(24): 58-61.
WEI J,LI F Y,YANG X P,et al. Study on chemical constitutes of volatile oil from leaves ofIlliciumverumin Rongxian by GC-MS[J].ChineseJournalofExperimentalTraditionalMedicalFormulae,2011,17(24): 58-61.(in Chinese with English abstract)
[13] SONG-LIN L,LI P,LIN G,et al. Simultaneous determination of seven major isosteroidal alkaloids in bulbs ofFritillariaby gas chromatography[J].JournalofChromatography.A,2000,873(2): 221-228.
[14] 左国营,韩峻,余巍,等. 47种中草药提取物的体外抗菌活性筛选研究[J]. 中国药房,2005,16(10): 798-799.
ZUO G Y,HAN J,YU W,et al. Antimicrobial activities screening of 47 traditional Chinese herbal medicine extracts[J].ChinaPharmacy,2005,16(10): 798-799.(in Chinese with English abstract)
[15] CLSI. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically,approved standard,tenth Edition: M07-A10[S]. Wayne,PA: Clinical and Laboratory Standards Institute,2015.
[16] CLSI. Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement: M100-S25[S]. Wayne,PA: Clinical and Laboratory Standards Institute,2015.
[17] 马力. 油菜籽的综合开发利用[J].中国食品添加剂,2007,8 (3): 126-129.
MA L. Comprehensive development and utilization of camellia seeds[J].ChinaFoodAdditives,2007,8 (3): 126-129.(in Chinese with English abstract)
[18] 徐玲,周伟,徐亚,等. 湖北贝母中3种生物碱含量的高效液相色谱-蒸发光散射检测法测定[J]. 时珍国医国药,2014,25(11): 2652-2654.
XU L,ZHOU W,XU Y,et al. Determination of three alkaloids inBulbusfritillariae hupehensis by HPLC-ELSD method[J].LishizhenMedicineandMateriaMedicaResearch,2014,25(11): 2652-2654.(in Chinese with English abstract)
[19] 徐玲,范志佳,杨萍,等. 湖北贝母中生物碱在蒸发光散射检测器中响应因子一致性考察[J]. 时珍国医国药,2015,26(7): 1639-1641.
XU L,FAN Z J,YANG P,et al. Consistency of response factors of alkaloids inFritillariahupehensisby evaporative light scattering detector[J].LishizhenMedicineandMateriaMedicaResearch,2015,26(7): 1639-1641.(in Chinese)
[20] 邓海根,曹雨震. 高效液相色谱仪的通用型质量检测器:蒸发光散射检测器(ELSD)[J]. 药物分析杂志,1994,14(3):61-63.
DENG H G,CAO Y Z. General purpose mass detector for high performance liquid chromatograph: evaporative light scattering detector (ELSD)[J].ChineseJournalofPharmaceuticalAnalysis,1994,14(3): 61-63.(in Chinese)
[21] 王琳,石刚,孙琴,等. 蒸发光散射检测器在药物分析中的应用[J]. 泸州医学院学报,2003,26(6): 547-549.
WANG L,SHI G,SUN Q,et al. Application of evaporative light scattering detector in drug analysis[J].JournalofLuzhouMedicalCollege,2003,26(6): 547-549.(in Chinese)
[22] 李兴洲. 氢火焰离子化检测器的工作原理与特性[J]. 印刷技术,2012(2): 45-46.
LI X Z. Working principle and characteristics of hydrogen flame ionization detector[J].PrintingTechnology,2012(2):45-46.(in Chinese)
[23] 牛换云,余河水,金施施,等. 湖北贝母体外抑菌活性研究[J]. 辽宁中医药大学学报,2016,18(1): 62-64.
NIU H Y,YU H S,JIN S S,et al. Study on the antibacterial activityinvitroof HubeiFritillaria[J].JournalofLiaoningUniversityofTraditionalChineseMedicine,2016,18(1): 62-64.(in Chinese with English abstract)

