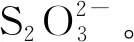海洋硫氧化菌Thiomicrorhabdus sp.B2-1的分离鉴定及氧化特性研究
陈小红,许贻斌,郑盛华,郑惠东,陈月忠,陈财珍
(1.福建省水产研究所,福建 厦门 361013; 2.福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
在近海养殖过程中,水动力条件的改变、大量饵料的投放以及强烈的生物沉降导致底质生境有机污染严重。在此过程中,含硫蛋白质降解和硫酸盐异化还原导致硫化物大量产生,对养殖区生态系统的结构和功能造成严重危害,成为制约海水养殖业健康发展的关键问题之一[1-2]。因此,研究控制海水养殖环境硫化物的技术显得尤为迫切,硫化物的生物控制具有环保、高效、持久的优点,是一种较有前景的控制技术[3]。

1 材料与方法
1.1 样品
从福建省湄洲湾近海养殖区采集沉积物样品,用于菌种分离。
1.2 培养基
选择性培养基:蒸馏水1 L,121℃灭菌15 min,加入过滤除菌的Na2S·5H2O(终浓度1 g/L)。
基础培养基[14]:MgSO4·7H2O 0.1 g、Na2S2O3·5H2O 5 g(由于Na2S·5H2O极易被氧化,影响实验准确,故选择Na2S2O3·5H2O替代)、K2HPO42 g、(NH4)2SO40.1 g、CaCl2·2H2O 0.1 g、FeSO4·7H2O 0.02 g、陈海水1 L,121℃灭菌15 min,用1 mol/L无菌HCl/NaOH调节pH至8.0。固体培养基在基础培养基基础上加15 g琼脂粉。
1.3 硫氧化菌的分离与纯化
取50 g沉积物样品于500 mL无菌三角瓶中,加入灭菌陈海水100 mL,在28℃、150 r/min进行摇瓶富集培养,每隔2天加1 mL选择性培养基到三角瓶中。20 d后将富集液按不同稀释梯度涂布于固体基础培养基上,28℃培养4 d。挑选优势菌落连续平板划线分离,纯化培养优势菌株,菌种保藏于4℃冰箱中备用。
1.4 菌株形态学与生理生化鉴定
将分离得到的菌株在固体基础培养基上培养,观察菌落形态。细菌革兰氏染色和生理生化特性实验参照北京陆桥生化试剂盒说明书进行。细菌的细胞形态及大小通过日本电子JEM-123透射电镜观测。
1.5 菌株分子生物学鉴定
将筛选得到的菌株保存平板送交生工生物工程(上海)股份有限公司进行16S rRNA基因序列分析鉴定。前端引物和后端引物分别为27F(5’-AGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)。25.0 μL扩增体系:基因组DNA 0.5 μL、10×Buffer 2.5 μL、Taq聚合酶0.2 μL、dNTP 1.0 μL、27F引物0.5 μL、1492R引物0.5 μL,加dd H2O 至25.0 μL。反应条件:94℃4 min,94℃45 s,55℃ 45 s,72℃ 60 s,共30个循环;72℃10 min。使用测序仪ABI3730XL进行DNA测序。
将测定所得到的序列提交到GenBank,并利用NCBI 的BLAST软件进行同源性比对。使用MEGA 7.0软件,运用Kimura 2-parameter Distance模型,将比对所得序列与相关菌株序列构建Neighbor-Joining系统发育树[15]。
1.6 氧化特性
1.6.1 种子液的制备
将菌种接种于盛有150 mL基础培养基的三角瓶中,于28℃、150 r/min摇床培养48 h,此时培养液pH降至6左右,作为种子液备用。
1.6.2 不同初始pH对菌株B2-1氧化硫代硫酸盐的影响
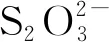
1.6.3 不同温度对菌株B2-1氧化硫代硫酸盐的影响
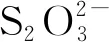
1.6.4 不同浓度Mg2+对菌株B2-1氧化硫代硫酸盐的影响
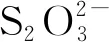
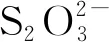
1.7 分析方法
pH值采用Multi 3430多参数分析仪测定。
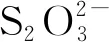
数据分析:应用Excel软件及SPSS 22软件对所得数据进行单因素方差分析(One-way ANOVA)和多重比较(LSD)。
2 结果
2.1 优势硫氧化菌的分离及其形态特征
将富集液稀释、涂布于基础培养基平板,28℃培养4 d后观察到平板菌落形态一致,均为白色圆形菌落。同时观察到菌落周围出现透明溶解圈,说明菌株具有氧化硫代硫酸盐并导致培养基酸化的能力。随机挑取一株作为优势菌并命名为B2-1。在固体基础培养基上,菌株B2-1菌落呈圆形、直径约1 mm、乳白色、中间凸起、湿润易挑取(图1-a)。
透射电镜照片(图1-b)显示,菌株B2-1是短杆状细菌,菌体大小为0.92 μm×2.03 μm,带极生鞭毛。生理生化实验结果(表1),菌株B2-1为革兰氏阴性,不能利用葡萄糖、乳糖、蔗糖、甘露醇等有机物进行异养生长。同时预实验表明,菌株不能在有机培养基上生长,在基础培养基中添加不同碳源(如葡萄糖、蛋白胨、酵母提取物等)也不能促进菌株的生长,推测该菌株为化能无机自养型。
注:a.菌株B2-1菌落图;b.单细胞TEM图(Bar,1 μm)。
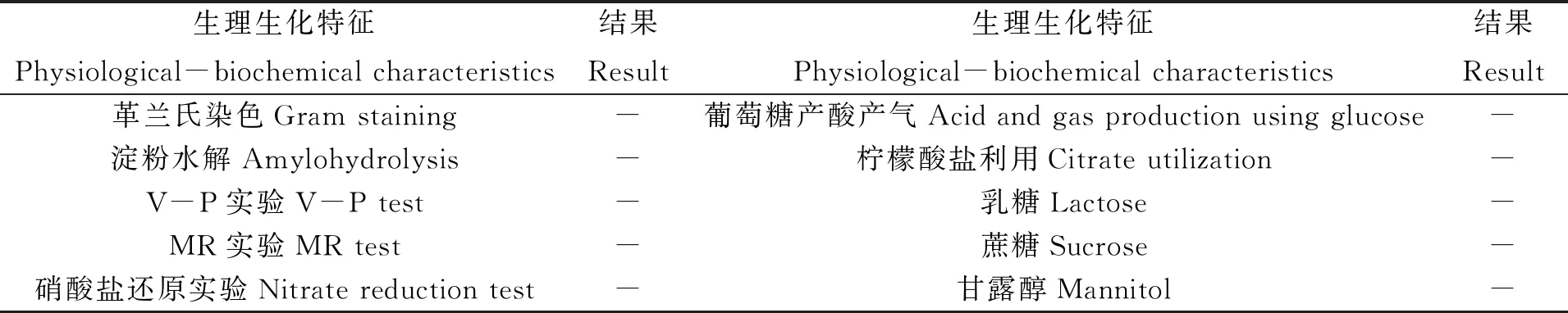
表1 菌株B2-1生理生化实验结果
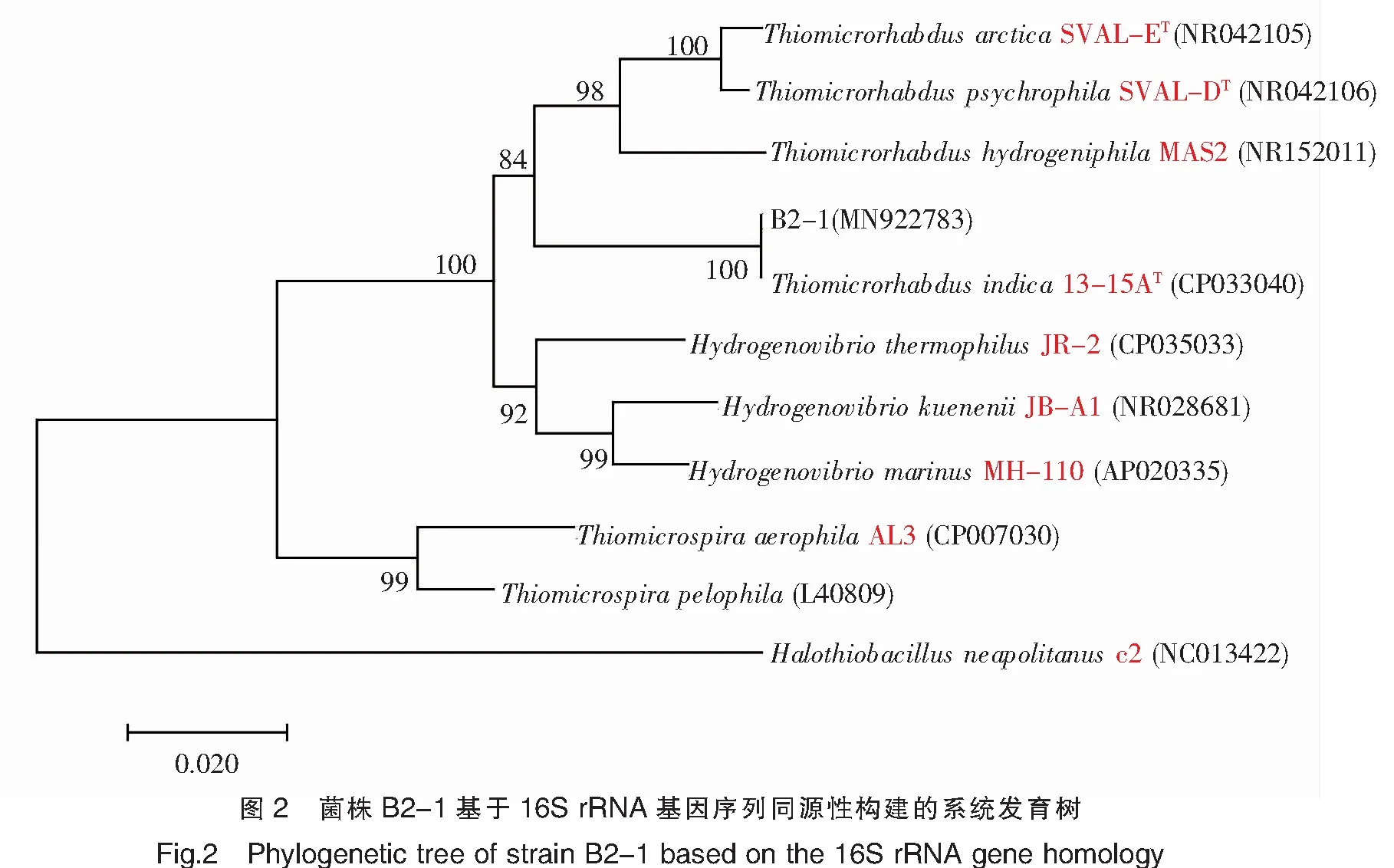
2.2 菌株16S rRNA序列分析及其系统发育树建立
对菌株B2-1的16S rRNA基因(1 475 bp)进行测序,在GenBank中获得序列登录号为MN922783。经过序列比对发现,菌株B2-1与最相似的菌株Thiomicrorhabdusindica13-15AT(CP033040)同源性为100%,且系统发育树显示这两株菌聚类在同一枝上,与硫微杆菌属(Thiomicrorhabdus)的其他种在同一个大的分枝(图2)。结合菌株的形态学特征,将菌株B2-1鉴定为Thiomicrorhabdussp.B2-1。
2.3 氧化特性
2.3.1 不同初始pH对菌株B2-1氧化硫代硫酸盐的影响

2.3.2 不同温度对菌株B2-1氧化硫代硫酸盐的影响

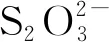
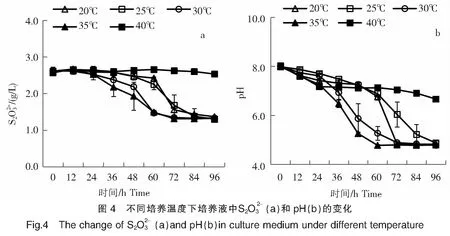
2.3.3 不同浓度Mg2+对菌株B2-1氧化硫代硫酸盐的影响
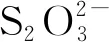
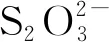


3 讨论
菌株B2-1在形态学特征上与伯杰氏细菌鉴定手册(第九版)中硫微螺菌属的特征描述较为相似,并且实验过程中发现,菌株B2-1存活期较短,在4°C保存2周以上,会因培养基酸化出现不可逆的生长抑制。Boden R等[20]在2017年将硫微螺菌属重新分类,提出硫微杆菌属(Thiomicrorhabdus),并列出该属包含5个正式发表的种,分别为T.frisia、T.chilensis、T.arctica、T.psychrophila、T.hydrogeniphila。近两年陆续有发现硫微杆菌属新种的研究报道,如2019年Kojima H等[21]从日本湖泊水分离得到一株硫氧化菌,命名为Thiomicrorhabdusaquaedulcis;2020年Liu X W等[22]从印度洋深海热液区分离得到一株专性化能自养型的硫氧化菌,命名为Thiomicrorhabdusindica13-15AT。本实验得到的菌株B2-1和Thiomicrorhabdusindica13-15AT同源性达100%,同时结合其形态特征及生理生化特征,初步鉴定该菌为Thiomicrorhabdussp.B2-1。

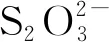
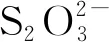

通过合理调节硫氧化菌与环境因子之间的作用关系,不但可以持续控制沉积物中硫化物的产生,还有益于生态系统的健康发展,是受损生境生态修复法的重要研究方向[28]。因此,在应用硫氧化菌进行海洋养殖环境修复之前,仍需获得更多的菌株资源,并对其氧化特性、氧化机制、固定化技术等方面进行深入的研究探索。
4 结论
1)从近海养殖区沉积物中分离筛选得到一株硫氧化菌Thiomicrorhabdussp.B2-1。