紫花苜蓿形态和生理指标响应干旱胁迫的品种特异性
臧真凤,白婕,刘丛,昝看卓,龙明秀,何树斌
(西北农林科技大学草原与草业学院,陕西杨凌712100)
紫花苜蓿(Medicago sativa)是一种产量高、营养价值丰富、适口性好、消化率高、经济价值高并且抗逆性较强的豆科牧草,素有“牧草之王”的美誉[1-2]。近些年来,在国家振兴奶业苜蓿发展行动及“粮改饲”等产业政策的带动下,我国紫花苜蓿种植面积增长速度较快。据不完全统计,仅2019年全国新增苜蓿种植面积8×1014m2,主要集中在我国西北地区的甘肃河西走廊、内蒙古阿鲁科尔沁、宁夏河套灌区等[3]。水资源短缺是限制紫花苜蓿生长和分布的最重要因素之一[4]。研究表明,干旱胁迫下,紫花苜蓿含水量降低[5]、叶绿素含量减少[6]、光合气体交换能力下降[7-8]、碳(carbon,C)、氮(nitrogen,N)代谢活性降低[9]、产量和营养价值减少[10]。为了适应干旱胁迫,紫花苜蓿通常会调整植物形态学特征、生物量分配和器官C/N计量特征模式[11-12],启动渗透调节和抗氧化机制等提高其自身抗旱性[13-14]。
植物在适应环境变化的规律方面存在一定的特异性[13]。研究表明,紫花苜蓿响应干旱胁迫的生物量分配策略、渗透调节能力和抗氧化酶机制等都具有品种特异性规律[15],也就是说不同紫花苜蓿品种对干旱胁迫的响应在形态学和生理学方面存在差异。然而,在生产中有关苜蓿品种特异性的研究相对较少。根系是紫花苜蓿获取营养、贮藏物质和感知土壤中的水分状态的主要器官[16-17],在适应干旱胁迫的过程中发挥着重要作用。有关紫花苜蓿适应干旱胁迫的品种特异性研究多侧重于地上部分,而对叶片和根系协同响应干旱胁迫的品种特异性研究相对较少。因此,本研究选用我国北方地区紫花苜蓿生产中推广范围较广的WL 363HQ和巨能7紫花苜蓿品种,在温室内模拟干旱胁迫,通过分析株高、分枝数、生物量、叶片和根系中的丙二醛(malondialdehyde,MDA)、脯氨酸、抗氧化酶类物质、C、N、C/N、稳定性C同位素(δ13C)和稳定性N同位素(δ15N)等,旨在明确供试品种在叶片和根系水平上响应干旱胁迫的形态和抗逆生理方面的品种特异性规律。研究结果将为进一步掌握紫花苜蓿叶片和根系协同抗旱机制及抗旱丰产紫花苜蓿新品种的选育提供理论依据。
1 材料与方法
1.1 试验材料和设计
供试紫花苜蓿品种WL 363HQ和巨能7来源于北京克劳沃种业有限公司。试验于2020年4-9月在西北农林科技大学草业与草原学院智能温室中完成。选取大小均匀、颗粒饱满健康的紫花苜蓿种子,用75%酒精溶液浸泡消毒5 min,蒸馏水冲洗5~6次后,放入装有滤纸的培养皿中,浸润后置于温度25℃/18℃(白天/黑夜),14 h/10 h(光/暗)、相对湿度60%的恒温培养箱中。发芽7 d后,选取生长均一且完整的幼苗移栽到装有1.5 kg取自田间耕作层土壤的花盆中(盆口直径为12 cm,底直径为7 cm,高为19 cm)。每花盆移栽一株植物,装盆前土壤预先过筛,土壤主要营养成分如下:C(13.5 g·kg-1)、全N(1.26 g·kg-1)、全磷(0.8 g·kg-1)、有效钾(8.29 mg·kg-1)、钙(92.85 mg·kg-1)、钠(138.39 mg·kg-1)。移栽80 d后,选取健康、长势均一的植株采用称重法进行干旱胁迫。试验设正常水分70%±5%(对照)和干旱胁迫35%±5%(干旱)两个水分梯度。通过称重法每隔2 d用蒸馏水补充植物蒸腾失去的水分,使其处于不同的水分梯度下。本试验共有4个处理,每个处理20盆植物,共计80盆紫花苜蓿。干旱胁迫处理28 d后,分别采集紫花苜蓿的叶片和根系测定各项指标。
1.2 试验指标与方法
用直尺测定紫花苜蓿从茎基部到植株顶端的株高,并在茎基部计数其分枝数;将收获的紫花苜蓿冲洗干净后,再用吸水纸擦去多余水分,分别称取地上部分和根系的鲜重,再将其置于105℃的烘箱中杀青10 min,之后在80℃将植物烘干至恒重后称取干重,将植物的地下部分干重与其地上部分干重相比获得根冠比;采用硫代巴比妥酸法测定MDA含量[18];采用酸性茚三酮法测定脯氨酸含量[19];采用氮蓝四唑光化还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性[20];采用愈创木酚法测定过氧化物酶(peroxidase,POD)活性[21]。叶片和根系C、N含量及δ13C和δ15N在中国农业科学院农业环境与可持续发展研究所分析测试中心采用ATC-185稳定性同位素质谱仪测定;C/N为植物组织中全C、N含量的质量比。
1.3 数据分析
利用Excel软件对数据进行整理,所有数据均为3次重复的平均值。使用SPSS 25.0软件对数据进行双因素方差分析(two-way ANOVA),并利用Origin 2020b进行作图。
2 结果与分析
2.1 干旱胁迫对2个供试品种生长指标的影响
干旱胁迫下,WL 363HQ和巨能7之间的株高差异显著(P<0.05)(图1)。干旱胁迫显著降低了巨能7的株高(P<0.05),但WL 363HQ的株高在干旱胁迫下与对照相比差异不显著(P>0.05)。WL 363HQ和巨能7分枝数之间对干旱胁迫的响应不同,与对照相比,干旱胁迫处理下WL 363HQ的分枝数显著降低(P<0.05),而巨能7分枝数差异不显著(P>0.05)。

图1 干旱胁迫下WL 363HQ和巨能7的株高和分枝数Fig.1 Plant height and br anch number of WL 363HQ and MagnumⅦunder drought str ess
在对照和干旱胁迫下,WL 363HQ地上部分鲜重和干重均高于巨能7(表1)。相比对照,巨能7地上部分的鲜重和干重在干旱胁迫下显著降低(P<0.05)。WL 363HQ根系干重和鲜重在干旱胁迫处理下显著降低(P<0.05),但巨能7根系鲜重和干重与对照相比差异不显著(P>0.05)。巨能7品种的根冠比在干旱胁迫下显著增加(P<0.05),而WL 363HQ的根冠比在干旱胁迫下减小,但差异不显著(P>0.05)。

表1 干旱胁迫下WL 363HQ和巨能7的生物量分配规律Table 1 Biomass allocation of WL 363HQ and MagnumⅦunder drought stress
2.2 干旱胁迫对2个供试品种叶片和根系MDA含量的影响
在对照和干旱胁迫下,WL 363HQ叶片和根系中的MDA含量均高于巨能7,且根系中MDA含量均高于叶片。干旱胁迫显著提高巨能7叶片中MDA的含量34.30%(P<0.05),也显著增加WL 363HQ根系中的MDA含量24.50%(P<0.05)(图2)。

图2 干旱胁迫下WL 363HQ和巨能7叶片和根系中的MDA含量Fig.2 MDA content in leaf and root of WL 363HQ and MagnumⅦunder drought stress
2.3 干旱胁迫对2个供试品种叶片和根系中脯氨酸含量的影响
WL 363HQ和巨能7叶片和根系中脯氨酸的含量在干旱胁迫下均有增加,尤其是干旱胁迫显著提高WL 363HQ叶片中脯氨酸的含量(P<0.05),比对照提高了69.95%;干旱胁迫也显著提高巨能7根系中脯氨酸的含量(P<0.05),比对照提高了120.78%,且巨能7根系中的脯氨酸含量均高于WL363HQ根系脯氨酸的含量(图3)。
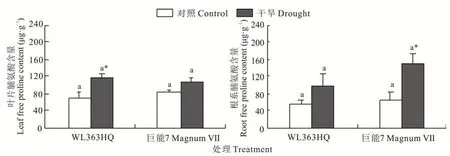
图3 干旱胁迫下WL 363HQ和巨能7叶片和根系中的脯氨酸含量Fig.3 Free proline content in leaf and root of WL 363HQ and MagnumⅦunder drought stress
2.4 干旱胁迫对2个供试品种叶片和根系中SOD和POD活性的影响
在干旱胁迫下,WL363HQ根系中SOD活性显著高于巨能7根系中SOD活性(P<0.05)(图4)。与对照相比,WL 363HQ和巨能7叶片中SOD活性在干旱胁迫时分别增加了21.52%和72.16%,且差异显著(P<0.05)。WL 363HQ根系中SOD活性在干旱胁迫下显著增加(P<0.05),与对照相比增加了75.64%;而干旱胁迫下根系中POD的活性与对照相比差异不显著(P>0.05)。干旱胁迫显著提高了巨能7根系中POD活性(P<0.05),比对照提高了135.74%。在对照和干旱胁迫下,叶片中SOD和POD活性分别高于根系中SOD和POD的活性。
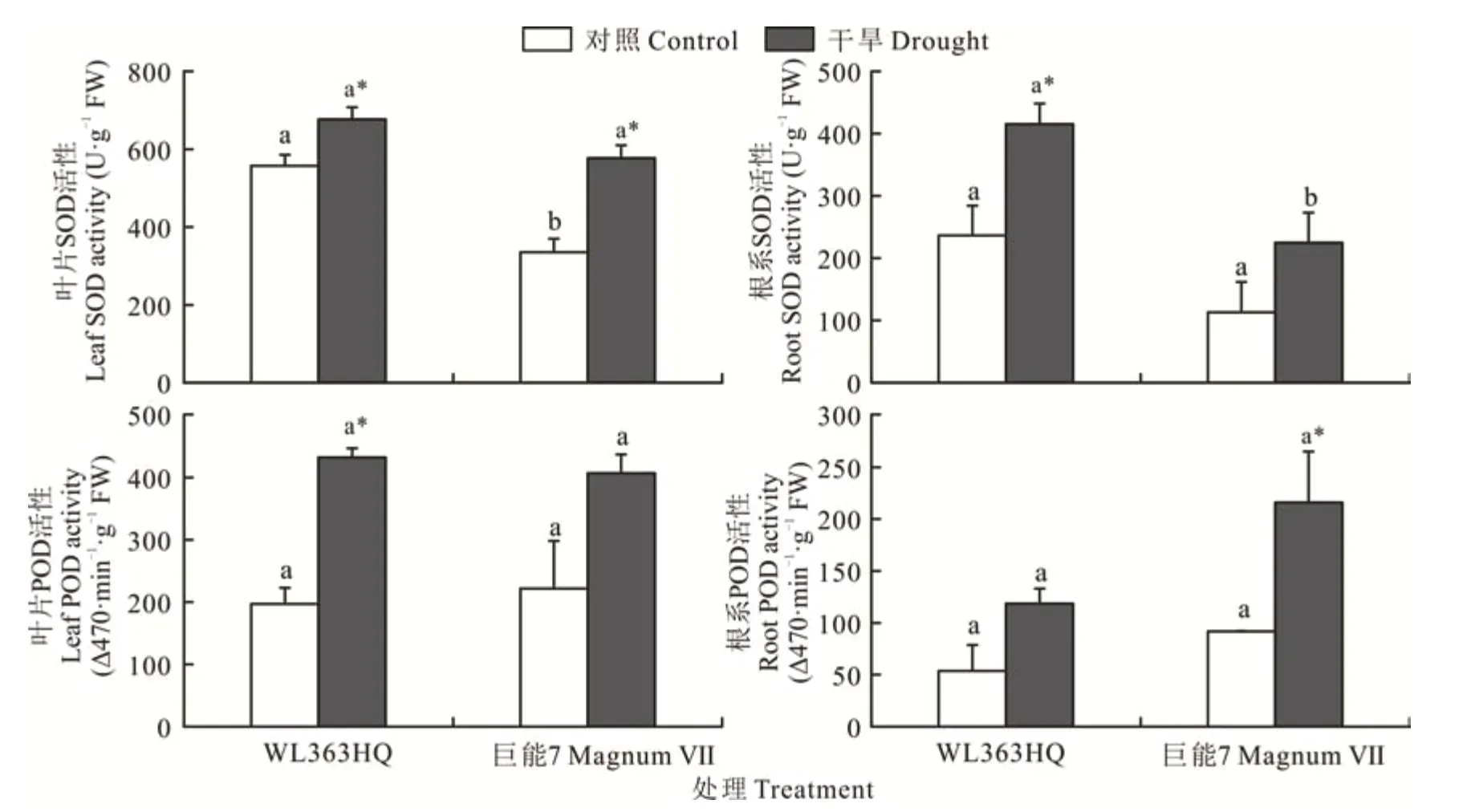
图4 干旱胁迫下WL 363HQ和巨能7叶片和根系中的SOD和POD活性Fig.4 SOD and POD activity in leaf and root of WL 363HQ and MagnumⅦunder drought stress
2.5 干旱胁迫对2个供试品种叶片和根系中C和N含量的影响
在对照处理下,WL 363HQ和巨能7之间的C含量差异不显著(P>0.05)(图5)。干旱胁迫下WL 363HQ和巨能7叶片和根系的C、N含量,与对照相比差异不显著(P>0.05)。对照处理下,WL 363HQ和巨能7叶片之间C/N差异不显著(P>0.05),而在根系中,WL 363HQ的C/N显著高于巨能7(P<0.05)。干旱胁迫显著增加巨能7叶片和根系中C/N(P<0.05),而WL 363HQ紫花苜蓿叶片和根系内C/N在干旱胁迫下差异不显著(P>0.05)。
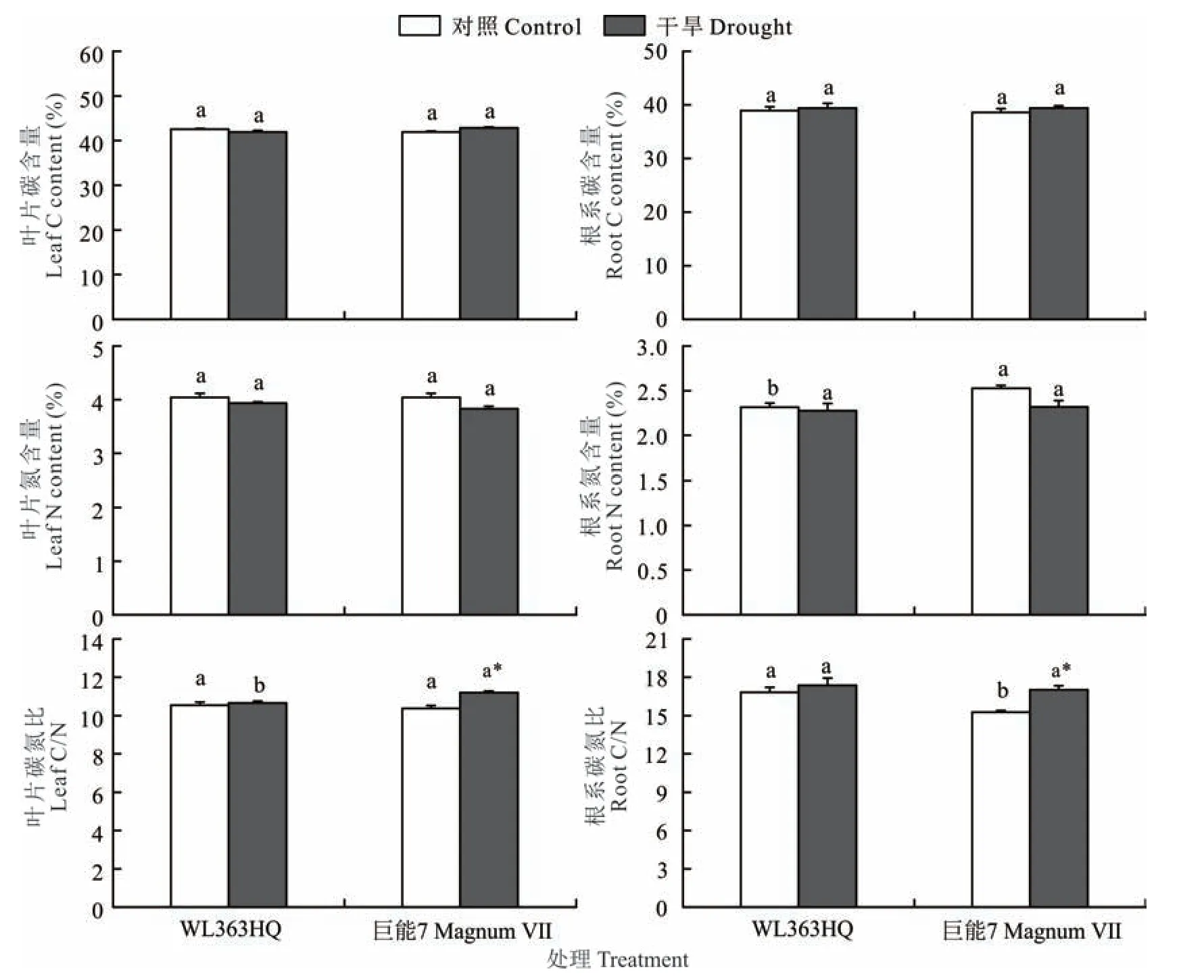
图5 干旱胁迫下WL 363HQ和巨能7叶片和根系中的C和N含量Fig.5 Carbon and nitr ogen content in leaf and r oot of WL 363HQ and M agnumⅦunder dr ought str ess
2.6 干旱胁迫对2个供试品种叶片和根系中δ13C和δ15N的影响
在对照和干旱胁迫下,WL363HQ和巨能7叶片δ13C差异不显著(P>0.05)(图6)。干旱胁迫显著增加了巨能7叶片内的δ13C(P<0.05),干旱胁迫也显著增加了WL 363HQ和巨能7根系中δ13C(P<0.05),分别比对照提高了8.85%和4.61%。在对照和干旱胁迫下,WL363HQ和巨能7叶片中的δ15N差异显著(P<0.05),并且WL363HQ叶片δ15N显著高于巨能7(P<0.05),而WL363HQ和巨能7根系内的δ15N差异不显著(P>0.05)。WL 363HQ和巨能7叶片和根系中δ15N均受干旱胁迫而下降,但差异不显著(P>0.05)。
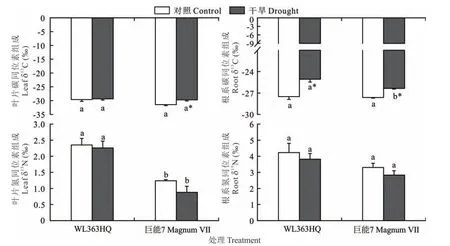
图6 干旱胁迫下WL 363HQ和巨能7叶片和根系中的δ13C和δ15NFig.6δ13C andδ15N values in leaf and root of WL 363HQ and MagnumⅦunder drought stress
3 讨论
紫花苜蓿调整生物量分配策略是其适应干旱胁迫的重要机制之一[22]紫花苜蓿地上生物量和根系生物量,这个结果与其他有关紫花苜蓿干旱胁迫的研究结果一致[7,23]。干旱胁迫下紫花苜蓿气孔关闭[8],光合气体交换能力下降,叶面积缩小[7]是其生物量降低的主要原因之一。紫花苜蓿分枝数与其生物量大小相关,是抗旱评价的重要指标之一[24]。WL 363HQ和巨能7紫花苜蓿分枝数在干旱胁迫下显著减少,这与其他研究结果也一致[25-26]。本研究中WL 363HQ和巨能7根系生物量对干旱胁迫的响应较为明显,这与干旱胁迫对紫花苜蓿根系生物量的影响较小的研究结论相反[22],这说明紫花苜蓿根系对干旱胁迫的响应受供试紫花苜蓿品种、胁迫程度和处理时间等因素的影响[7]。干旱胁迫下多年生草本植物向根系分配更多的生物量,增加其根冠比,以获取更多限制性的营养物质,这是其适应干旱胁迫的重要机制之一[12]。本研究中干旱胁迫增加了巨能7的根冠比,但降低了WL 363HQ的根冠比,这意味着植物在适应环境变化的规律方面存在一定的特异性[13],不同紫花苜蓿品种在响应干旱胁迫的生物量分配策略等方面具有品种特异性[15]。
MDA是植物细胞膜系被氧化的产物,是植物受到逆境胁迫的标志[27]。渗透调节和抗氧化酶清除机制是紫花苜蓿适应干旱胁迫的重要机制,可调节植物细胞的水势,减小干旱对细胞的影响[10]。本研究中,干旱胁迫下供试品种叶片和根系MDA和脯氨酸含量及抗氧化酶活性较对照均升高,这与国内外其他相关研究的结果是一致的[7,15,28]。然而,供试品种的叶片和根系MDA和脯氨酸的含量及抗氧化酶类物质的活性,在器官水平也具有品种特异性规律,这可能是叶片和根系所处的地上和地下环境的差异,导致其物理、化学属性以及在时间和空间上资源获取策略的不同形成的[29]。WL363HQ叶片MDA含量相对较少,说明光合同化器官受到干旱损伤相对较低,且叶片和根系对干旱胁迫具有相对较强的渗透调节和抗氧化协同机制,推测这可能是WL363HQ在对照和干旱胁迫下生物量相对较高的重要原因,也说明渗透调节机制和活性氧清除机制是紫花苜蓿在抗旱胁迫下的重要响应机制[7]。
紫花苜蓿叶片和根系中C、N代谢对干旱胁迫的响应较为敏感,干旱胁迫往往降低了紫花苜蓿叶片和根系中C、N代谢[9]。本研究中干旱胁迫并没有显著降低供试品种叶片和根系中C、N含量,这可能是由于豆科牧草中根系贮藏的C、N营养物质较多,干旱胁迫下贮藏的营养物质发生转运,调整了C、N营养物质的同化和需求能力[30]。此外,不同研究中选取的紫花苜蓿品种、固氮菌属性、干旱胁迫时间等不同都会导致研究结果之间的差异。尽管植物体内N浓度在一定程度上决定了生物量大小,本研究中干旱胁迫下供试品种N含量虽然没有显著变化,但生物量却显著减低,这是由于紫花苜蓿在干旱胁迫下的生长不仅取决于N的吸收,而且取决于N在器官中的分配规律及结构组织和光合组织中的分布策略等[23]。尽管干旱胁迫对供试品种叶片和根系C、N含量没有显著影响,但干旱胁迫显著增加了WL363HQ和巨能7紫花苜蓿根系的δ13C。这可能是因为干旱胁迫降低了紫花苜蓿的气孔导度,限制了CO2向羧化位点的供应[31],降低了C同位素的分馏,增加了光合同化产物中的13C的比例,且这部分增加的光合产物通过木质部转运到了根系[32]。干旱胁迫降低了土壤N的有效性,紫花苜蓿更加依赖生物固氮获取N[33],这是干旱胁迫下两个供试品种根系δ15N均降低的重要原因之一。此外,本研究中WL 363HQ叶片和根系的δ15N均显著高于巨能7,说明WL 363HQ紫花苜蓿的N代谢活性较高,即使在干旱胁迫下也能维持较高N代谢及N转运的效率[34],这也是WL 363HQ在干旱胁迫下生物量较高的另外一个重要原因。然而植物的δ15N受到土壤硝化、植物吸收特性(如时间和吸收类型)和微生物侵染率等的影响[34],有关紫花苜蓿不同组织δ15N响应水分胁迫的深层次的原因还需深入研究。根系C/N的变化是植物适应环境的重要信号调节机制[35],反映了植物C、N营养物质的吸收及转运策略[36]。值得注意的是,本研究中干旱胁迫仅增加了巨能7紫花苜蓿的C/N,这说明紫花苜蓿生物量的分配模式、营养物质的浓度与其根系C/N计量关系存在一定的联系,植物采用适应性策略,调整器官C/N,优化了生理防御与生长发育之间的协同关系[37]。本研究中干旱胁迫下供试品种C、N代谢参数并没有在叶片和根系水平上表现出较为明显的品种特异性规律,深层次的机制还有待进一步探讨。
4 结论
干旱胁迫下紫花苜蓿WL 363HQ和巨能7的株高和根冠比都具有品种特异性的规律;干旱胁迫下供试品种的叶片和根系MDA和脯氨酸的含量及抗氧化酶的活性在器官水平也具有品种特异性规律。干旱胁迫增加了WL 363HQ和巨能7根系的δ13C,提高了巨能7叶片和根系的C/N,但是C、N代谢参数并没有在叶片和根系水平上表现出较为一致的品种特异性规律。在对照和干旱胁迫下,WL 363HQ相比巨能7具有相对较高的生物量,其叶片和根系也具有相对较强的渗透调节和抗氧化协同能力及相对较高的N代谢活性(δ15N)。

