用于代谢气体分析的化学改性微流控肺泡芯片*
魏昕钰,李明虓,张灵倩,赵 阳,黄成军
(1.中国科学院微电子研究所 健康电子研发中心,北京 100029;2.中国科学院大学 电子信息与技术学院,北京 100029)
0 引 言
肺癌疾病的早期筛查对于此类疾病的治疗具有重要意义[1]。生物学研究表明细胞的异常代谢气体会溶于血液,通过呼吸作用排出体外。因此,对呼吸气体的检测结果可反映潜在病变细胞的新陈代谢水平,应用于癌症,尤其是肺癌的筛查和诊断[2]。目前已发现超过196种代谢气体与肺癌疾病相关[3],然而这种方法缺乏理论研究和数据支持,难以用于临床治疗。因此,在细胞级别进行实验验证和数据支持是十分必要的。
微流控芯片具有集成度高,样品消耗少等优点[4]。微通道尺寸与体内尺寸相当,可进行细胞三维培养和生物微环境模拟,构建与细胞尺度匹配的三维空间,模拟体内细胞的生长状况,真实地反映其生物学特征,为医学和生物学方面的研究提供一个新思路。
本文提出了一种结构简单、反应灵敏的肺泡芯片。该芯片由聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微通道和聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET)核孔膜组成,可实现肺癌细胞的三维培养和醛类代谢气体的捕获,为呼吸检测方法提供理论支持。
1 芯片制备
1.1 结构设计与制备
1.1.1 结构设计
考虑到肺泡尺寸和肺部的气血屏障结构[5],肺泡微流控芯片由两层结构化PDMS(30 mm×15 mm×2 mm)和一层PET核孔膜(15 mm×5 mm×5 μm,孔径5 μm)组成,分层示意图如图1所示。

图1 肺泡芯片分层结构示意
1.1.2 芯片制备
PDMS结构采用软光刻方法翻膜得到,模具为硅基结构。首先设计微通道版图,制作掩模版。之后,通过光刻、刻蚀等工艺进行硅基图形化。将PDMS预聚物和固化剂以10︰1的体积比充分混合,浇入硅基结构,在80 ℃下烘烤固化3 h,之后脱模切割,用直径3 mm的打孔器在两端打孔,作为细胞悬液和培养基等液体的出入口。PDMS内部微通道的深度为100 μm,宽度为500 μm,长度为15 mm,体积为7.5 μL(制作工艺如图2(a)所示)。PET核孔膜通过重离子打孔和化学扩孔的工艺方法产生[6],如图2(b)所示,膜上有致密的小孔,每个小孔的形状和尺寸基本相同,孔径为7 μm。
PDMS-PET层间键和采用化学浸泡法[7]和表面氧等离子体处理相结合的方法,用到的化学试剂为GLYMO 和 APTES两种硅烷偶联剂。具体的处理方法为:1)首先,用去离子水分别配制1 %浓度的GLYMO溶液和5 %浓度的APTES溶液;2)将PDMS和PET分别放入1 %的GLYMO溶液中和5 %的APTES溶液中,各浸泡20 min;之后用去离子水冲洗后吹干;3)将PDMS和PET的键合面向上,放入等离子体腔室中,进行氧等离子体表面处理,功率设置为中档,注氧90 s,取出后对准键合到一起,完成芯片制作。得到最终的芯片实物如图2(c)所示。

图2 肺泡芯片的制备
1.2 表面改性
1.2.1 化学改性原理
为完成代谢气体的片内捕获,这里使用氨氧基季铵盐—乙醇溶液完成PDMS化学改性,化学方程式为H2NO-Z-N+/A-,其中Z是连接基团,可以取代芳基、烷基或者醚类基团,A可以是任意一种卤族元素,如氯、溴、碘等。该分子一端的—ONH2基团可以快速与细胞代谢产生的羰基化合物发生肟化反应,得到醛肟或酮肟分子[8],其可通过质谱检测方法识别。肟化反应结构式如图3所示。
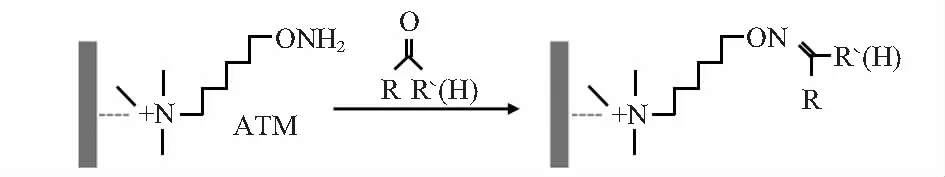
图3 化学改性反应式
1.2.2 改性处理方法
使用氨氧基季铵盐对PDMS通道进行化学改性处理,改性物质化学名称为2—氨氧乙基季甲铵碘盐 (ATM),化学式如图3所示。具体改性方法为:1)使用无水乙醇稀释氨氧基盐溶液,制备浓度为4 mmol/L的改性试剂;2)滴加10 μL改性试剂到PDMS微通道表面;3)待乙醇溶剂挥发后改性物质存留在通道表面,完成PDMS的表面修饰。
2 细胞实验
2.1 细胞培养
首先配制实验中使用的培养基溶液。由于PDMS通道狭长,和传统培养皿培养细胞的环境相比更具挑战性,因此增加培养基中FBS(胎牛血清)的比例,促进细胞的生长代谢,实验结果证明细胞的贴壁和生长状态较好。具体培养基配制方法为RPMI 1640︰FBS︰双抗=100︰20︰1。
之后进行微流控肺泡芯片的预处理,将键合好的芯片紫外照射30 min以上,之后用大量磷酸盐缓冲液(PBS)冲洗通道,排出沟道内气泡;然后用去离子水配制20 mg/mL的人纤连蛋白溶液缓缓注入通道内,放入细胞培养箱(37 ℃,5 %浓度CO2)3 h以上;取出芯片后,使用培养基溶液冲洗通道,将混合均匀的,密度在106/mL的肺癌细胞(A549)悬液注入下层通道,培养1天左右,在倒置显微镜下观察细胞贴壁形态和增殖情况。
2.2 代谢气体检测
2.2.1 质谱检测方法
质谱(mass spectrometry,MS)分析利用电场和磁场将运动的离子按它们的质荷比分离后进行检测,通过分析这些粒子可获得化合物的分子量、化学结构等信息。实验中使用的质谱检测仪器为Orbitrap Fusion LUMOs,它具有可自动进样、电场/磁场双模式及检测精度高的优势。
如图4所示是一次实验测得的质谱图,设置FTMS-pESI模式(p代表positive,正离子模式),自动进样1 μL。图中得到每个峰代表一种化合物,其中,质荷比m/z=119.12代表原始的改性物质(ATM),m/z=131.12代表改性物质捕获到的甲醛气体(CH2O),m/z=145.13代表捕获到的乙醛气体(C2H4O),m/z=159.15代表捕获到的丙酮气体(C3H6O),m/z=173.17代表捕获到的2—丁酮气体(C4H8O),物质的具体结构由气相色谱—质谱联用(GC-MS)得到[9]。通过观察混合溶液中每一种化合物的峰值强度,可以得知各种化合物在混合溶液中的相对含量,以及不同控制变量下各种物质的变化。
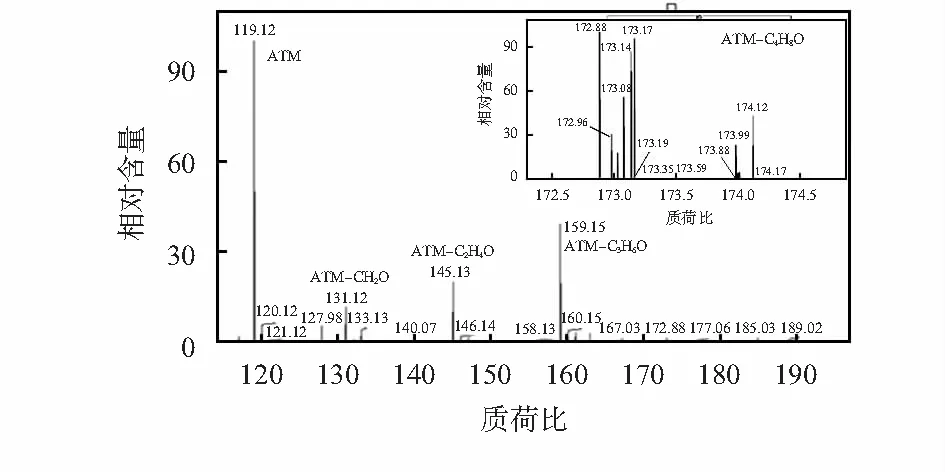
图4 洗脱后的细胞代谢气体羰基化学物质谱图
2.2.2 实验组测试
每12 h为沟道内的细胞更换培养基,确保细胞在沟道内有足够的营养物质。细胞代谢气体经过微孔膜与改性区域充分接触。一天以后取下上层改性PDMS,使用无水甲醇进行洗脱富集,得到50 μL左右的反应后溶液,将溶液进行有机质谱检测,确定其反应后成分。
2.2.3 实验说明
实验中使用的PET核孔膜购自武威科近新发技术有限责任公司,细胞培养相关溶液购自ThermoFisher,化学改性相关的试剂和溶液购自Sigma-Aldrich,基于肟化反应的改性试剂由已公开的方法[10]合成,PDMS预聚物及其固化剂(SYLGARD 184)购自TORAY(日本),其他实验中用到的仪器包括倒置显微镜(CX41 OLYMPUS),细胞培养箱(Thermo SCIENTIFIC),生物安全柜(BIOBASE BSC—1100),等离子体清洗机(HARRICK PLASMA),水浴锅(KEWEI)。
3 结果与讨论
3.1 改性物质在PDMS沟道内的气体捕获效果
在微孔膜上进行细胞培养后,细胞代谢过程中产生的羰基化合物可与改性物质结合,起到代谢气体捕获的作用,气体捕获后的PDMS改性区域的显微镜图片如图5所示 。

图5 改性区域捕获气体后显微镜图
3.2 细胞在PDMS沟道内的生长特性
实验中使用荧光染料确定通道内细胞的生长情况:将10 μL Calcein-AM(2 μmol/L )和400 μL PI(16 μg/mL )加入4 590 μL PBS溶液里混合均匀,配制成Calcein-AM/PI(Propidium Iodide)细胞双染试剂,在荧光显微镜下同时观察PDMS通道里的活细胞和死细胞。Calcein-AM可透过细胞膜,通过活细胞内的酯酶作用脱去AM基团,产生的Calcein(钙黄绿素)发出强绿色荧光,因此活细胞在荧光显微镜下可被检测到绿色荧光。另一方面PI通过受损的细胞膜进入到死细胞内并嵌入细胞的DNA双螺旋从而产生红色荧光,因此死细胞会被检测到红色荧光。
如图6所示,细胞在通道内正常贴壁,形态良好,可以持续保持细胞活性,染色后发现活细胞数量较多,死细胞数量很少,证明了微流控芯片可以较好地模拟细胞生长环境,维持细胞代谢水平。

图6 细胞在微通道内贴壁生长情况
3.3 实验工艺和细胞培养对质谱检测结果的影响评估
在开始肺泡芯片的实验前,进行了对照组实验,测试在化学改性时,PDMS材料本身、表面氧等离子体处理、以及培养基对气体检测结果的影响。如图7所示,对照组为改性试剂的质谱检测结果,PDMS组为将改性试剂滴加在PDMS之后重新富集的质谱结果,等离子体组为将PDMS注氧后滴加改性试剂再富集,而培养基组为将改性试剂混合少量培养基(≈2 μL)之后进行质谱分析。

图7 三组变量实验结果
观察质谱图发现,这三组实验变量的结果与空白对照组类似,三种气体成分的变化在实验误差允许的范围内,证明PDMS材料本身,表面氧等离子体处理方法,以及培养基成分对实验结果的影响较小,在实验中可以正常使用。
3.4 细胞代谢气体捕获成分分析
统计每次实验组中捕获的各羰基化合物成分的浓度含量,与对照组进行对比,观察4种羰基化合物成分的变化,做出它们的含量增值部分曲线,如图8所示。图中可观察到4种气体含量均有所增加,气体量级在0~80 μmol,其中丙酮气体增加最显著,甲醛和乙醛气体也有明显增多。而分析对照组的质谱图发现其中并未存在2—丁酮气体,证明细胞代谢过程也会产生少许2—丁酮。

图8 代谢气体分析
相关生物学研究表明,肺癌会诱导氧化酶的生成并带来“氧化应激”,即机体活性氧成分与抗氧化系统之间平衡失调引起的一系列适应性的反应,这会引起特定挥发性代谢产物浓度的增高[11]。而羰基化合物气体常在机体内生化反应过程中以中间产物形式生成,一些羰基化合物在给定的反应中具有特异性,例如脂质氧化会生成自由基。在本次实验中,通过将微流控芯片与化学捕获方法结合,本文进行了四种羰基标志物气体在肺癌细胞代谢过程中的识别,结果表明肺癌细胞的生长代谢过程会生成较多的丙酮气体、甲醛和乙醛气体以及少量的2—丁酮气体。
4 结 论
介绍了一种用于细胞代谢气体捕获的微流控肺癌芯片,可进行细胞的片上培养和醛类代谢气体的识别。文中使用肺癌细胞(A549)进行实验,芯片可以较好地完成细胞培养和气体捕获的功能,证明了芯片功能的有效性,为细胞代谢气体的分析提供了一种有效的途径,为呼吸检测在肺癌疾病的应用提供了一定的理论依据。

