甲烷氧化菌素-铜配合物模拟过氧化物酶检测面粉中的过氧化钙
张嘉钰,辛嘉英,, ,刘丰源,夏春谷,许锡凯,王广交,崔添玉
(1.哈尔滨商业大学食品科学与工程重点实验室,黑龙江哈尔滨 150076;2.中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃兰州 730000)
过氧化钙(CaO2)又称二氧化钙,是一种白色或淡黄色粉末,难溶于水,不溶于乙醇、乙醚等有机溶剂,是一种新型的多功能无机精细化工产品,目前开发和应用较为广泛[1]。CaO2对紫外线有吸收作用,可脱色、增氧、杀菌、防腐,现已广泛应用在环境保护、冶金工业、水产养殖以及食品加工中。在食品加工中一般用作杀菌剂、漂白剂、防腐剂等[2-3]。CaO2作为面粉添加剂,可以改善面粉的色泽并且加快后熟,也可作为面粉增筋剂和面包改良剂等,能代替过氧化苯甲酰,曾被列入使用卫生标准[4]。但经长期研究表明,使用过量的CaO2会对身体造成损害,如刺激肠道、诱发癌症等,极性毒性LD50(大鼠经口)大于5000 mg/kg[5]。在2011年3月1日,卫生部等7部联合发布全面禁止过氧化苯甲酰、过氧化钙两种面粉增白剂的使用[6]。但为了提高利益,仍有大量不良商家向面粉中非法添加CaO2,对人们的健康造成极大影响。目前,国内外关于面粉中CaO2的检测资料较少,开发新型的检测方法意义重大。
目前,对于CaO2的检测有热分解法、乙二胺四乙酸滴定法(ethylene diamine tetraacetic acid,EDTA)、间接碘量法、高锰酸钾法等[7-10],但这些方法只适用于对CaO2纯品的检测,并且滴定的速度难以控制,准确度过低,不能实现对CaO2的痕量检测。过氧化物酶(Peroxidase,POD)可通过过氧化氢催化多种有机化合物的氧化,并且可以产生颜色变化,已经广泛的用于对过氧化氢的酶法测定[11-12]。张玉荣等[2]提出了酶催化法测定小麦粉中的过氧化钙,所采用的过氧化物酶是辣根过氧化物酶(horseradish peroxidase, HRP),然后利用CaO2与酸反应可生成过氧化氢(H2O2),再以碘化钾(KI)为增敏剂,可使季胺(4,4’-二甲氨基-二苯基甲烷)氧化显色,成功实现了对面粉中CaO2定性定量的分析。HRP已经被广泛的应用于检测H2O2[13-14],但HRP为天然酶,它存在一些严重的缺点,它的催化活性易受温度和pH影响,并且它的制备和纯化非常繁琐耗时,价格昂贵,在实际应用中难以推广。为了克服这些局限性,学者们在探索模拟酶取代天然过氧化物酶的研究中做了大量的工作[15],甲烷氧化菌是一类利用甲烷作为唯一能源和碳源的细菌[16],甲烷氧化菌素(Mb)是甲烷氧化菌向周围环境中释放的一种铜捕获小肽,与铜离子结合时具有高亲和力和特异性[17-19]。目前文献报导的Mb具有能与铜配位的五元杂环尾基和含有巯基或二硫键的头基[20-21],且配位后具有POD的活性。此外,相较于其他模拟酶Mb具有可以忽略不计的毒性,具有良好实用价值[22]。Xin等[23]研究了Mb-Cu不同配位方式对催化速度的影响,结果表明该配合物符合生物催化剂的一般规律,且比天然酶催化剂稳定性更高,Mb2-Cu配位形式具有最高的催化能力。
本研究建立和优化小麦粉中过氧化钙的酶-分光光度法,利用CaO2与酸反应生成过氧化氢(H2O2),在模拟酶Mb-Cu存在的条件下,催化氧化对苯二酚(Hydroquinone,HQ)生成对苯二醌,从而用分光光度法进行检测,以期实现定性定量的分析,具体反应的方程式如下:

可用于对面粉中CaO2的痕量检测,为食品监督单位提供参考。
1 材料与方法
1.1 材料与仪器
甲基弯菌OB3b 清华大学赠送;甲烷 99.99%,哈尔滨黎明气体有限公司;甲醇 分析纯,国药集团化学试剂有限公司;无水乙醇 分析纯,天津富宇精细化工有限公司;硝酸盐培养基 参照文献[24]制备;大孔树脂 美国Supelco公司;五水合硫酸铜、磷酸氢二钠、磷酸二氢钠 分析纯,天津天力化学试剂有限公司;过氧化钙 70%,美国Alfa Aesar公司;对苯二酚 分析纯,Aladdin化学试剂公司;浓硫酸 分析纯,北京化学试剂公司;市售面粉 购自当地超市;实验用水 均为二级水。
UV-2550型紫外-可见分光光度计 日本岛津公司;FDU-1200型冷冻干燥机 东京理化器械公司;2-16 K型高速冷冻离心机 美国Sigma公司;HL-2S型恒流泵 上海沪西分析仪器厂;组合式紫外检测器 上海金达公司;5BG型生化发酵罐 上海保兴生物设备公司;RV8V型旋转蒸发仪 德国IKA公司。
1.2 实验方法
1.2.1 甲烷氧化菌素的分离与纯化 参照文献[23]的方法,使用甲基弯菌(Methylosinus trichosporium OB3b)为菌种,在NMS培养基中培养5~7 d,得到的发酵液用离心机(4 ℃,8000 r/min)离心20 min,得到的上清液经活化后的Diaion HP-20大孔树脂的吸附,再用甲醇洗脱,从而得到Mb,通过30 ℃旋转蒸发后,再经过冷冻干燥得到粉末状Mb粗品放入-30 ℃冰箱中备用。
1.2.2 Mb-Cu的制备 将上述粉末状Mb配制成浓度为5×10-4mol/L的溶液放入比色皿中,在紫外分光光度计的监测下,使用5 μL微量进样器向比色皿中每隔10 min加入2 μL浓度为5 mmol/L的Cu(Ⅱ),观察390 nm处的峰,直至峰值不再下降为止,得到Mb-Cu待用。
1.2.3 标准曲线的绘制 过氧化钙标准液的配制:称取一定量过氧化钙,配制成0.1 mg/mL的标准储备液,再加入10 mL浓度为1%的稀硫酸,涡旋混匀5 min,得到标准工作液,避光保存,现用现配。
拟酶溶液的配制:取一只100 mL容量瓶,依次加入Mb-Cu和对苯二酚,用磷酸缓冲溶液进行定容,使Mb-Cu的浓度为3.9×10-6mol/L,对苯二酚的浓度为5×10-4mol/L,上下摇动,使其溶解,放入冰箱冷藏备用。
在标准工作液中分别取0.00、0.20、0.50、1.00、2.00、3.00、4.00 mL,放入50 mL比色管中,再分别加入10 mL拟酶溶液,加水至刻度线,60 ℃恒温水浴3 min,以过氧化钙浓度为X轴,以288 nm处的吸光度下降值为Y轴,绘制标准曲线。
1.2.4 样品的测定 准确称取1 g面粉,加入10 mL 1%的稀硫酸,涡旋混匀后,加水定容至100 mL,摇匀后转入离心管,以8000 r/min离心5 min,吸取上清液40 mL,再加10 mL拟酶溶液,测定288 nm处吸光度,再于60 ℃恒温水浴3 min,288 nm处测定吸光度,计算前后差值,与标准曲线对比读出过氧化钙的含量。以无添加过氧化钙的小麦粉作为空白样品。
1.2.5 实验条件的选择 讨论了Mb-Cu用量、温度、pH、反应时间对过氧化氢和对苯二酚反应速度的影响。
1.2.5.1 Mb-Cu用量对过氧化氢和对苯二酚反应速度的影响 取10 mL的玻璃小瓶五只,将粉末状Mb-Cu配制成各种浓度,使其在拟酶试剂中的浓度 分 别 为0.0×10-6、1.3×10-6、2.6×10-6,3.9×10-6、5.2×10-6、6.5×10-6mol/L的溶液,再加入与拟酶试剂等量的过氧化钙标准工作液,观察288 nm处吸光度的下降速度,检验Mb-Cu的浓度对过氧化氢和对苯二酚反应速度的影响。
1.2.5.2 温度对过氧化氢和对苯二酚反应速度的影响 取五只离心管,每只加入等量过氧化钙标准工作液与拟酶试剂溶液,分别在30 、40、50、60、70 ℃的反应温度下反应3 min后,测量288 nm处的吸光度的下降值,考察温度在30~70 ℃之间对反应速度的影响。
1.2.5.3 pH对过氧化氢和对苯二酚反应速度的影响 分别试验pH在1~5时对实验反应速度的影响,采用氢氧化钠溶液调节pH。取五只10 mL的玻璃小瓶,分别加入等量的过氧化钙标准工作液与拟酶试剂溶液,用质量分数为0.1%的氢氧化钠溶液调节pH,放入60 ℃水浴锅中水浴3 min后,于288 nm测定吸光度,计算反应速度。
1.2.5.4 反应时间对过氧化氢和对苯二酚反应速度的影响 取12只离心管,分别加入2mL过氧化钙标准工作液与2 mL拟酶试剂溶液,采用最佳反应温度(60 ℃),在反应时间分别为0、20、40、60、80、100、120、140、160、180、200、220 s时测量288 nm处的吸光度,探究反应时间对反应体系的影响。
1.2.6 对过氧化氢和对苯二酚反应速度的测定 反应速度计算公式如下:
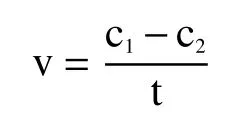
式中:v 为 过氧化氢和对苯二酚的反应速度(mol/L·s);c1为对苯二酚初始浓度(mol/L);c2为对苯二酚剩余浓度(mol/L);t 为反应时间(s)。
1.2.7 精密度和准确度的测定 采用没有添加过氧化钙的面粉,称取1 g并在其中分别加入不同量(200、400、600 μg/g)的过氧化钙标准品,按照步骤
1.2.4进行实验,每一个浓度水平做4组每组6次的平行实验,计算得出精密度和准确度。
1.3 数据处理
实验均重复4次,采用Origin 8.0和SPSS13.0对实验数据进行处理。
2 结果与分析
2.1 Mb-Cu的结合
Mb-Cu的结合过程如图1,由曲线可以观察查到,随着Cu(Ⅱ)的不断加入,通过紫外-可见分光光度计的监测可以发现,在340 nm和390 nm处的吸收峰逐渐下降,由文献 [23] 可知这说明Cu(Ⅱ)分别与Mb中的4 -羟基- 5 -硫酰咪唑(HTI)和4-硫酰- 5 -羟基咪唑(THI)发生结合,390 nm处吸收峰的下降表明Cu(Ⅱ)与THI中的S发生配位;340 nm处吸收峰变化表明Cu(Ⅱ)与HTI基团中的S发生了配位。直到340 nm和390 nm处的吸收峰不再下降,配位结束,Mb与Cu结合为Mb-Cu。
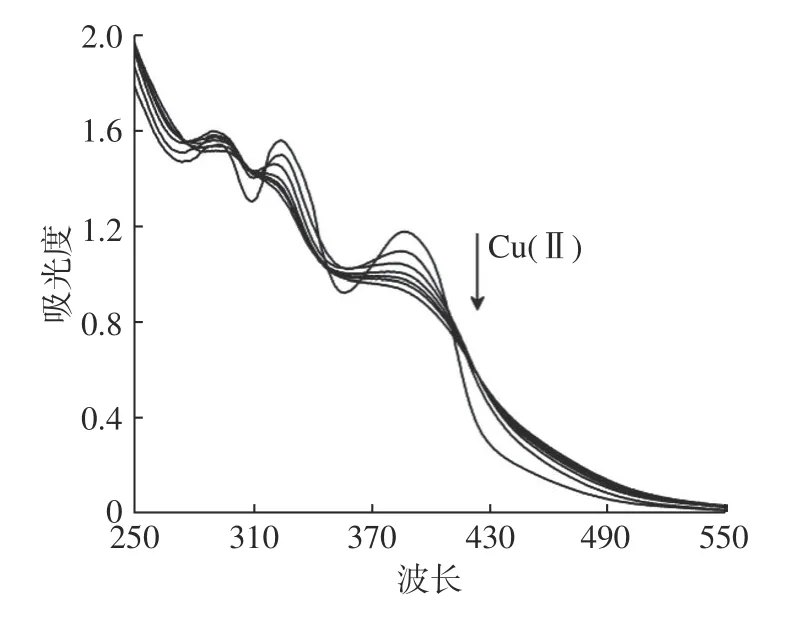
图1 Mb-Cu配位的紫外-可见吸收光谱图Fig.1 UV-visible absorption spectrum of Mb-Cu complex
2.2 检测波长的选择
CaO2与酸反应可生成H2O2,利用Mb-Cu模拟酶催化H2O2氧化对苯二酚生成对苯二醌并伴有轻微颜色变化,反应机理如图2所示。
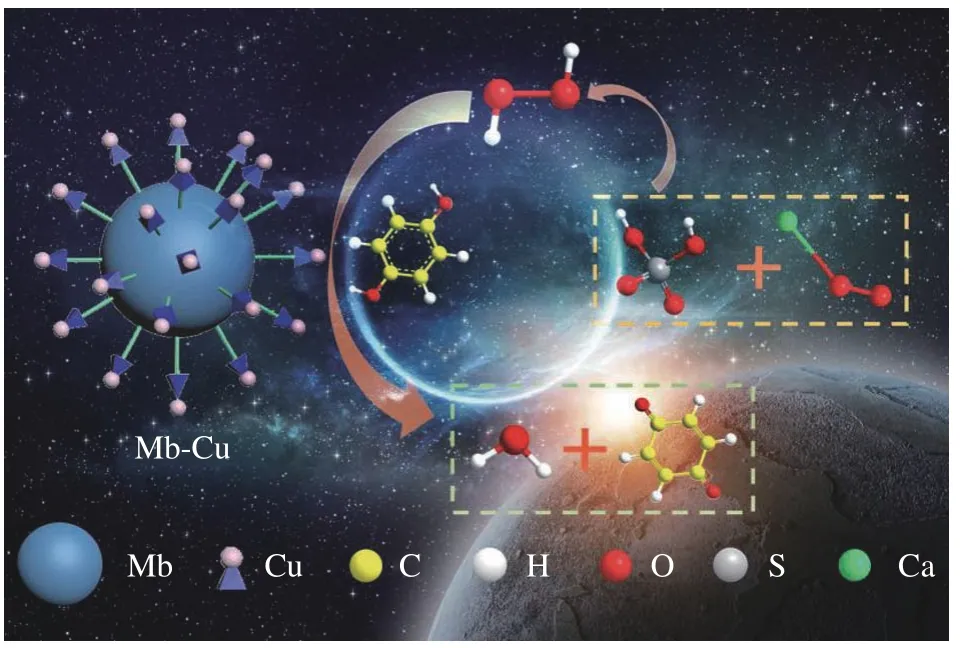
图2 Mb-Cu催化反应机理Fig.2 Mb-Cu catalytic reaction mechanism
取3只50 mL比色管,分别加入0.0、1.0、2.0、3.0、4.0 mL的过氧化钙标准工作液,再加入10 mL的模拟酶试剂溶液,定容后于60 ℃水浴锅水浴3 min后进行全光谱扫描,测定结果如图3。由图3可知,随着过氧化钙浓度的升高,245 nm处吸收峰逐渐升高,288 nm处吸收峰逐渐下降。由文献[25]可知,245 nm处的吸收峰为产物对苯二醌的吸收峰,288 nm处为对苯二酚的吸收峰,可利用对苯二酚的消耗量得出过氧化钙的含量,所以,将采用288 nm为测定波长。
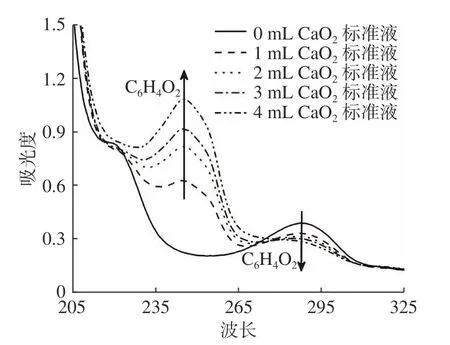
图3 不同CaO2含量下的紫外-可见吸收光谱图Fig.3 Ultraviolet-visible absorption spectra at different CaO2 concentrations
2.3 反应条件的优化
2.3.1 Mb-Cu用量的影响 在Mb-Cu浓度在10-6mol/L的条件下[23],将粉末状Mb-Cu配制成各种浓度,使其在拟酶试剂中的浓度分别为0.0×10-6、1.3×10-6、2.6×10-6、3.9×10-6、5.2×10-6、6.5×10-6mol/L的溶液,检验Mb-Cu的浓度对过氧化氢和对苯二酚反应速度的影响,结果如图4,当Mb-Cu浓度在0~3.9×10-6mol/L时,由于模拟酶浓度增加,催化效果增强,所以反应速度随着Mb-Cu浓度的增加而增大,当浓度超过3.9×10-6mol/L时,反应速度增加缓慢,催化效果达到顶峰,所以采用Mb-Cu的浓度为3.9×10-6mol/L。

图4 Mb-Cu浓度对反应速度的影响Fig.4 Effect of Mb-Cu concentration on reaction rate
2.3.2 温度对反应速度的影响 一般所使用的过氧化物酶为辣根过氧化物酶,是天然酶,酶是一种蛋白质,强酸、强碱、高温等外界条件会对催化速度产生巨大影响,一般的催化条件为常温、常压、pH在5.0~8.0之间[26]。而模拟酶可通过提高温度来提高反应速度。
取五只离心管,分别加入等量过氧化钙标准工作液与拟酶试剂溶液,反应时间为5 min,考察温度在30~70 ℃之间对反应速度的影响,结果如图5,图5的曲线表明该反应的反应速度随温度的升高而上升,在60 ℃时,反应速率增加最快,60 ℃后,反应速度依然上升,但上升趋势不明显,且温度过高Mb-Cu可能发生部分变性,最终导致失活,高温也易发生副反应,所以,实验选择的反应温度为60 ℃。
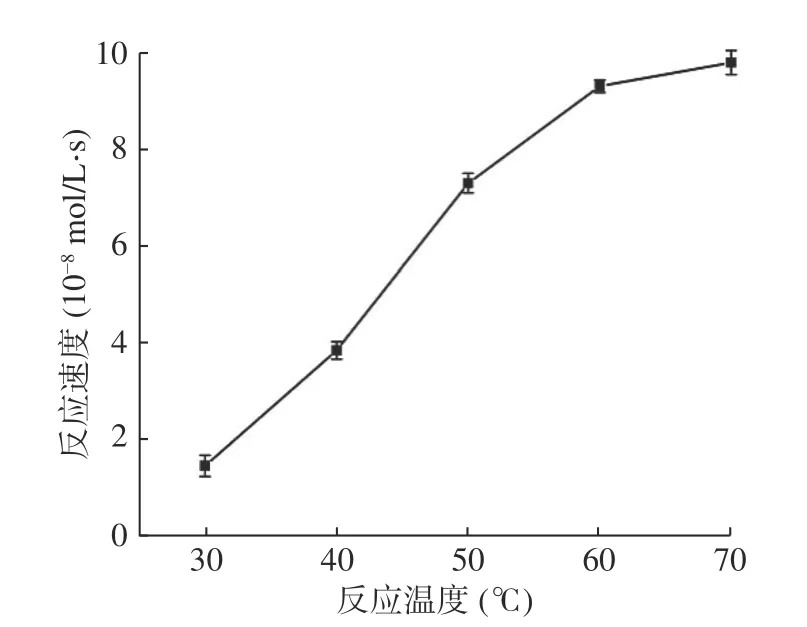
图5 温度对反应速度的影响Fig.5 Effect of temperature on reaction speed
2.3.3 pH对反应速度的影响 pH会影响反应物表面的离子状态。通常情况下,天然过氧化物酶最佳反应pH在5.0~8.0之间,过高或过低都会使其失活[26]。分别试验pH在1~5时对实验反应速度的影响,采用氢氧化钠溶液调节pH,在过氧化钙浓度一定,反应温度为60 ℃时,反应3 min,结果如图6所示,由图6可知,反应速度随着pH的升高略有下降,但从整体来看,pH对实验反应速度影响不大,证明甲烷氧化菌素模拟酶对pH环境要求不高,在pH在1~5时仍保持活性,可省略实验中用氢氧化钠调节pH的步骤,相对于天然酶检测来说,模拟酶的催化简化了实验过程。

图6 pH对反应速度的影响Fig.6 Effect of pH on reaction speed
2.3.4 反应时间对反应体系的影响 在过氧化钙浓度和酶用量一定时,采用最佳反应温度(60 ℃),在0~220 s中选取12个时间点来探究反应时间对对应体系的影响,结果如图7,可以看出,0~180 s时,288 nm处的吸光度下降较快,180 s后吸光度下降速度减慢,以后几乎不变,说明已经反应完全,所以选择180 s作为反应时间。

图7 反应时间对反应速度的影响Fig.7 Effect of reaction time on reaction speed
2.3.5 标准曲线的绘制 当反应条件为Mb-Cu浓度为3.9×10-6mol/L、反应温度为60 ℃、反应时间为180 s时,按梯度吸取过氧化钙标准工作液于比色管中,按照1.2.3的操作步骤进行,得到如图8的标准曲线,结果表明该体系在吸光度A288的值与过氧化钙浓度在0.0~8.0 mg/L之间存在线性关系,决定系数R2为0.99281。对空白面粉做11组平行实验,通过计算,可得出标准偏差S=6.49×10-4,从而根据三倍标准偏差与斜率之比,得出检出限(LOD)为1.82×10-2mg/L。
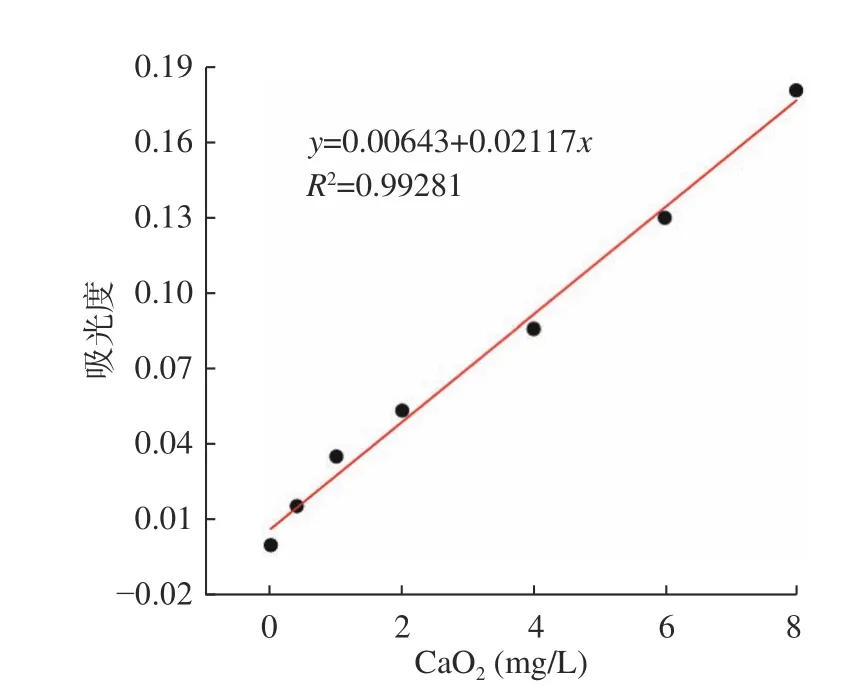
图8 CaO2的标准曲线Fig.8 CaO2 standard curve
2.3.6 精密度和准确度 采用没有添加过氧化钙的面粉,称取1 g并在其中分别加入不同量(200、400、600 μg/g)的过氧化钙标准品,按照步骤1.2.4进行实验,每一个浓度水平做4组每组6次的平行实验,结果如表1。其平均加标回收率为98.2%~100.6%,相对标准偏差RSD为0.49%~1.32%,表明本方法用于检测面粉中的过氧化钙具有良好的精密度和准确度。

表1 加标回收结果(n=6)Table 1 Results of spike recovery (n=6)
3 结论
本文利用CaO2与酸反应生成过氧化氢的原理,采用Mb-Cu配合物模拟过氧化物酶催化过氧化氢氧化对苯二酚,建立了一种面粉中过氧化钙的定量检测方法。酸碱度调节的实验结果表明,Mb-Cu模拟酶与天然过氧化物酶不同,pH在检测中对反应速度的影响可忽略不计,不易受环境酸碱度的影响,从而省去了传统过氧化物酶法需要调节pH的操作步骤,由此降低了检测时间,提高了检测效率。此外对其他条件进行了优化,成功实现了对面粉中CaO2快速、准确的测量,此方法抗干扰能力强,操作步骤简单,可用于对实际样品的分析。

